
Ко 2 сессии / Малашонок Неорганическая химия
.pdfAlH3 + 3H2O → Al(OH)3 + 3H2↑
AlH3 взаимодействует с основными гидридами в эфирном растворе с образованием гидридоалюминатов:
AlH3 + LiH → Li[AlH4]
Медленно вступает в реакцию с дибораном, образуя борогидрид алюминия:
AlH3 + B2H6 → Al(BH4)3
Al(BH4)3 – очень реакционноспособное вещество, перспективно в качестве ракетного топлива.
Оксид и гидроксид алюминия. Физические свойства. Al2O3 –
твердое тугоплавкое вещество; существует в нескольких кристаллических модификациях. Наиболее известен α-Al2O3 (корунд): белое, тугоплавкое, химически инертное вещество. Химическая стойкость, термическая устойчивость Al2O3 объясняются прочностью связей Al–O, в образовании которых участвуют свободные d-орбитали атома алюминия и неподеленные электронные пары атома О (донорно-акцепторное взаимодействие).
Сильно прокаленный Al2O3 называется алундом, он используется при изготовлении тиглей и огнеупорных материалов.
Al(OH)3 – твердое вещество белого цвета, нерастворимое в воде. Формула Al(ОН)3 условна, точнее Al(ОН)3×nН2О.
Химические свойства оксида и гидроксида алюминия
|
Реагенты. Характерные реакции |
Примеры реакций |
||
Оксид алюминия Al2O3 – |
амфотерный |
|
||
оксид |
с преобладанием |
основных |
Al2O3 + H2O ≠; |
|
свойств. С водой не реагирует. |
||||
1) |
С кислотами |
|
Al2O3 + 6HCl → 2AlCl3 + 3H2O |
|
|
|
|
|
|
2) |
C растворами щелочей |
|
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4] |
|
3) |
Сплавляется со щелочами или кар- |
t |
||
Al2O3 + 2NaOH ¾® 2NaAlO2 + H2O |
||||
бонатами щелочных металлов |
t |
|||
|
|
|
|
Al2O3 + Na2CO3 ¾® 2NaAlO2+ CO2 |
4) |
С основными оксидами |
|
t |
|
|
Al2O3 + СаO ¾® Сa(AlO2)2 |
|||
5) С некоторыми кислотными оксидами |
Al2O3 + 3SO3 → Al2(SO4)3 |
|||
|
|
|||
Гидроксид алюминия Al(OH)3 – |
|
|||
слабый |
электролит с амфотерными |
|
||
свойствами. |
|
Al(OH)3 + 3HCl → AlCl3 + 3H2O |
||
1) |
С кислотами (как основание) |
|||
|
|
|
|
|
191
2) С растворами и расплавами щелочей |
Al(OH)3 + NaOH → Na[Al(OH)4] |
||
|
|
||
(как кислота) |
Al(OH)3 + 3NaOH ® Na3[Al(OH)6] |
||
|
t |
+ 2H2O |
|
|
Al(OH)3 + NaOH ¾® NaAlO2 |
||
3) Сплавляется с основными оксидами |
t |
+ 3H2O |
|
2Al(OH)3 + СaO ¾® Сa(AlO2)2 |
|||
4) Некоторыми кислотными оксидами |
2Al(OH)3 + 3SO3 → Al2(SO4)3+ 3H2O |
||
5) Термически неустойчив, теряет воду |
t |
|
|
2Al(OH)3 ¾® Al2O3 + 3H2O |
|||
при нагревании ~ 1000С |
|
|
|
|
|
|
|
Получение оксида и гидроксида алюминия |
|
||
|
|
|
|
Способы получения |
Реакции |
|
|
Получение Al2O3 |
|
|
|
1) Прямое окисление порошкообразно- |
4Al + 3O2 → 2Al2O3; DН о298 = –3350 кДж |
||
го алюминия |
|
|
|
2) Термическое разложение гидроксида |
t |
|
|
алюминия |
2Al(OH)3 ¾® Al2O3 + 3H2O |
||
|
|
||
Получение Al(OH)3 |
AlCl3 + 3NaOH(нед.) → Al(OH)3 + 3NaCl |
||
1) Осаждение из растворов солей щело- |
|||
чами (в недостатке) или гидроксидом |
Al2(SO4)3 + 6NH4OH → 2Al(OH)3 + |
||
аммония |
|||
+ 3(NH4)2SO4 |
|
||
|
|
||
2) Подкисление растворов алюминатов |
Na[Al(OH)4] + CO2 → Al(OH)3 + NaНCO3 |
||
3) Гидролиз сульфида |
Al2S3 + 6H2O ® 2Al(OH)3¯ + 3H2S |
||
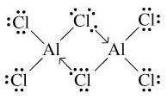
Некоторые свойства солей алюминия. Алюминий образует со-
ли с большинством известных кислот. В парах и органических растворителях хлориды, бромиды и иодиды алюминия существуют в виде димеров с мостиковыми галогенами:
В галогенидах алюминия реализуется дативная связь. Соединения широко используют в органической химии в качестве катализаторов. Это легколетучие (кроме фторида) вещества (хлорид алюминия возгоняется уже при 180оС), бурно реагирующие с водой, поскольку заменяется окружение атома алюминия:
Al2Cl6 + 6H2O = 2[Al(H2O)6]Cl3
192
Алюминаты под действием воды практически полностью разлагаются:
NaAlO2 + 2H2O ® Al(OH)3 + NaOH
Алюминаты также разлагаются кислотами. Состав продукта зависит от количественного соотношения между солью и кислотой:
Na[Al(OH)4] + HCl(нед.) → Al(OH)3 + NaСl + H2O
NaAlO2 + HCl(нед.) + H2O ® Al(OH)3 + NaСl
Na[Al(OH)4] + 4HCl(изб.) → AlCl3 + NaСl + 4H2O
Na3[Al(OH)6] + 6HCl(изб.) → AlCl3 + 3NaСl + 6H2O
NaAlO2 + 4HCl(изб.) ® AlCl3 + NaСl + 2H2O
Соли Al3+ выделяются из растворов в виде кристаллогидратов: AlCl3×6H2O, Al(NO3)3×9H2O. Сульфаты алюминия с сульфатами щелочных металлов образуют двойные соли – квасцы (KAl(SO4)2×12Н2О
– алюмокалиевые квасцы), квасцы широко применяются для очистки воды, дубления кож, протравления тканей перед покраской.
Все соли Al3+растворимы, кроме AlPO4, AlF3. В водных растворах соли Al+3подвергаются гидролизу:
Al2(SO4)3 + 2H2O 2AlOHSO4 + H2SO4
Al3+ + H2O AlOH2+ + H+
Соли алюминия, образованные слабыми кислотами (сульфиды, сульфиты, карбонаты, цианиды), не могут быть выделены из водных растворов, так как полностью гидролизуются:
Al2S3 + 6H2O ® 2Al(OH)3 + 3H2S
Ион Al3+ характеризуется большим зарядом, малым радиусом и наличием вакантных s-, p- и d-орбиталей. Поэтому из всех s- и p-металлов алюминий является наилучшим комплексообразователем. Для него характерны координационные числа 4, 6, что соответствует sp3- и sp3d2- гибридизации атомных орбиталей.
Для алюминия наиболее характерны комплексы с Н2О, ОН– , F– , при этом образуются октаэдрические комплексы (к.ч. = 6), например:
3NaF + AlF6 = Na3[AlF6] гексафтороалюминат натрия.
193
Галлий, индий, таллий
Существует принципиальное отличие химии галлия, индия и таллия от химии алюминия: возможность устойчивого существования соединений этих элементов в степени окисления +1, которая не характерна для алюминия. Устойчивость этого состояния возрастает в ряду Ga—In— Т1, а для таллия она более стабильна, чем степень окисления +3. Современное объяснение такой особенности основано на концепции инертной пары s-электронов и уменьшении прочности связей с участием элементов с большим радиусом. У алюминия велика разница между потенциалами ионизации первого электрона 3p1 и последующих (3s2). Трудность возбуждения второго и третьего электронов у галлия, индия и таллия становится еще больше. Эти элементы стоят сразу же после переходных металлов, и на них сказывается эффект d- и f-сжатия: электроны, заполнившие внутренние d- и f-орбитали, не увеличивают размер атомов, однако экранируют валентные электроны у атомов элементов больших периодов III А-группы.
Значения окислительно-восстановительных потенциалов Ga, In, Т1 более низкие, чем у элементов подгруппы цинка и при этом значительно отрицательнее водородного. Поэтому у элементов семейства галлия восстановительные свойства более выражены, чем у элементов подгруппы цинка, но менее, чем у щелочноземельных металлов (металличность выше подгруппы цинка и ниже щелочноземельных металлов). Элементы семейства галлия не встречаются в природе в свободном состоянии, вытесняют водород из растворов кислот, не выделяются при электролизе водных растворов солей. Ga, In и Тl проявляют способность к комплексообразованию.
Радиусы атомов и ионов растут от Ga к Т1, соответственно с этим восстановительные свойства увеличиваются, увеличивается различие энергий связи s- и р-электронов внешнего слоя и соответственно уменьшается наиболее характерная степень окисления: для Ga и In она равна +3, а для Т1 – +1. По химическому поведению галлий близок к алюминию с учетом особенностей строения внешней электронной оболочки. Подобно алюминию, галлий на воздухе покрывается плотной оксидной пленкой Gа2О3 и поэтому практически не изменяется. У Ga, как и у алюминия, амфотерные свойства, реагирует с разбавленными кислотами и со щелочами в присутствии окислителей (или при нагревании):
2Ga + 6HCl → 2GaCl3 + 3H2
2Ga + 6NaOH + 3H2O2 → 2Na3[Ga(OH)6]
194
2Ga + 6NaOH + 6H2O ¾t ® 2Na3[Ga(OH)6] + 3H2
In и особенноТl в отсутствие сильных окислителей к щелочам устойчивы. Тl не растворяется в галогеноводородных кислотах, т.к. образуются нерастворимые галогениды таллия (I).
Ga, In и Тl могут реагировать с галогенами:
2Ga + 3Cl2 → 2GaCl3
Tl + 3Cl2 → TlCl3
2Tl + Cl2 → 2TlCl
Образуются белого цвета соединения, молекулы ЭГ3 димеризованы:
2GaCl3 Ga2Cl6
Известно соединение состава GaCl2, которое может быть получено: 2GaCl3 + Ga → 3GaCl2
GaCl2 следует относить к соединениям со смешанной степенью окисления Ga+ и Ga+3: Ga[GaCl4].
По отношению к холодной воде галлий вполне устойчив. Концентрированная серная и концентрированная азотная кислоты пассивируют алюминий, но взаимодействуют с галлием, индием, таллием:
2Ме + 6H2SO4конц → Ме2(SO4)3 + 3SO2 + 6H2O
2Tl + 2H2SO4 конц → Tl2SO4 + SO2 + 2H2O
Реакция галлия с серной кислотой имеет особенность: выделяющаяся сера окутывает поверхность галлия плотной пленкой и препятствует его дальнейшему растворению:
2Ga + 4H2SO4 = Ga2(SO4)3 + S↓ + 4H2O
Гидроксид галлия амфотерен:
Ga(OH)3 + NaOH → Na[Ga(OH)4] (в растворе) Gа(ОН)3 + NaOH ¾t ® NaGaO2 + 2H2O (при нагревании)
Из гидроксида прокаливанием можно получить оксид, который легко растворяется в воде:
2Gа(ОН)3 ¾t ® Gа2O3 + ЗН2О Gа2O3 + ЗН2О = 2Gа(ОН)3
Прямым синтезом могут быть получены сульфид Ga2S3, а также являющиеся полупроводниками фосфид GaP, арсенид GaAs, ан-
195
тимонид GaSb. Водородные соединения галлия хотя и существуют, но они неустойчивы и по поведению похожи на водородные соединения алюминия.
Соли галлия хорошо растворимы в воде, при осаждении из растворов выделяются кристаллогидраты: Ga2(SO4)3·18H2O,
Gа(NО3)3·9Н2О и др.
Индий и таллий – довольно тяжелые металлы серебристо-белого цвета (плотность индия 7,31 г/см3, а таллия – 11,85 г/см3). На воздухе индий покрывается плотной и прочной оксидной пленкой, а таллий медленно окисляется, и поэтому его хранят под слоем кипяченой дистиллированной воды или покрывают лаком. Оба металла мягкие и хрупкие с хорошей электрической проводимостью. При прокаливании энергично соединяются с кислородом и серой. С галогенами – хлором и бромом – они реагируют уже при обычной температуре, а с иодом при небольшом нагревании. Для индия и таллия известны два ряда соединений, соответствующих степеням окисления +3 и +1. Желтый оксид In2O3 может быть получен взаимодействием простых веществ, а коричневый Tl2O3 – при окислении таллия озоном:
2Tl + O3 = Tl2O3
В воде оксиды практически нерастворимы, но способны растворяться в кислотах
In2O3 + 6НС1 = InС13 + 3Н2О Тl2O3 + 6НС1 = ТlС13 + ЗН2О
При движении от Ga к Tl кислотные свойства оксидов ослабевают, а основные усиливаются. В связи с этим Тl2O3 не взаимодействует со щелочами. Устойчивость оксидов сверху вниз падает. Тl2O3 при небольшом нагревании разлагаетсяc с образованием Тl2O и O2. Тl2O растворяется в H2O:
Тl2O + H2O → 2TlOH (TlOH – щелочь)
По размерам ион Тl+1 близок к иону К+, отсюда близость свойств их соединений.
Основные свойства гидроксидов последовательно измененяются:
Ga(ОН)3 |
In(ОН)3 |
Тl(ОН)3 |
ТlOН |
амфотерный |
амфотерный гидроксид с бо- |
основание |
средсильное ос- |
гидроксид |
лее выраженными основными |
ней силы |
нование |
|
свойствами |
|
|
196
Биогенная роль р-элементов III A группы
Аалюминий – самый распространенный металл в земной коре (8,13% по массе), однако человеческий организм содержит небольшое количество бора и алюминия (их содержание не превышает 10-5%), а галлия, индия и таллия – еще меньше.
Бор концентрируется в легких (0,34 мг), щитовидной железе (0,3 мг), селезенке (0,26 мг), печени, мозге (0,22 мг), почках, сердечной мышце. Имеются данные, что бор снижает активность адреналина.
Алюминий концентрируется в сыворотке крови, легких, печени, почках, костях, ногтях, волосах. Al +3 замещает Са+2, Mg+2. (У них одинаковые координационные числа, равные 6, радиус атома и энергия ионизации). Избыток Al в организме тормозит синтез гемоглобина.
Cоединения бора в почве, образуя неустойчивые пероксидные соединения, облегчают корневое дыхание растений; пониженное содержание бора в почве особенно вредно сказывается на развитии сахарной свеклы (появляются болезненные изменения – так называемая гниль сердечка).
Суточная потребность в алюминии взрослого человека 30-50 мг. В повседневной жизни мы получаем его в основном из хлебопродуктов. К источникам алюминия относятся вода, атмосферный воздух, лекарственные препараты, алюминиевая посуда, дезодоранты и др.
Соединения Ga, In, Tl ядовиты. Если для растений таллий умеренно токсичен, то для животных и человека этот элемент понастоящему страшный яд. Токсичность таллия связана с нарушением баланса ионов натрия и калия – вследствие близости радиусов K+ и Tl+ эти ионы обладают сходными свойствами и способны замещать друг друга в ферментах. Катион Tl+ образует прочные соединения с серосодержащими белками и подавляет активность ферментов, содержащих тиольные группы. Таллий нарушает функционирование различных ферментных систем, ингибирует их и препятствует синтезу белков, токсичность его соединений для человека выше, чем свинца и ртути. Попадание в организм даже очень незначительных количеств соединений Tl+ вызывает выпадение волос, поражение нервной системы, почек, желудка. Металл выводится из организма в течение длительного времени главным образом с мочой и калом. При острых отравлениях через одни, максимум двое суток возникают первые признаки поражения желудочно-кишечного тракта (тошнота, рвота, боли в животе, понос, запор) и дыхательных путей. Через три-четыре дня может наступить мнимое улучшение. Спустя две или три недели на-
197
чинается выпадение волос, появляются признаки авитаминоза (сглаживание слизистой оболочки языка, трещины в углах рта и прочие). В случаях тяжелого отравления могут развиться полиневриты, психические расстройства, поражения зрения и другие.
Применение р-элементов III A группы и их соединений
Н3ВО3 – антисептическое средство, высокая растворимость борной кислоты в липидах обеспечивает быстрое проникновение ее в клетки через липидные мембраны. В результате происходит свертывание белков (денатурация) цитоплазмы микроорганизмов и их гибель. Как антисептик применяют буру Na2В4О7×10Н2О. Фармакологическое действие препарата обусловлено гидролизом соли с выделением Н3ВО3.
Бура Na2B4O7×10H2O применяется при пайке металлов. Бура в расплавленном состоянии растворяет оксиды металлов:
Na2B4O7 + CuO ¾t ® NaBO2 + Cu(BO2)2
(Na2O·B2O3)
При соприкосновении накаленного паяльника с бурой, оксиды металлов растворяются в ней (поверхность очищается), и припой хорошо пристает к поверхности металла.
Бор – микроэлемент, оказывает специфическое влияние на углеводный обмен в растениях, необходим для нормального роста и деления клеток, образования семян.
Болотные и подзолистые почвы бедны бором. При борном голодании растения не образуют семян или их мало. Внесение борных удобрений повышает урожай сахарной свеклы, бобовых и овощных культур, менее реагируют на борные удобрения злаковые культуры.
Подкормку ведут через почву или опрыскиванием (внекорневая подкормка), эффективна предпосевная подкормка семян водными растворами борной кислоты или солями.
Алюминий – второй после железа металл по масштабам его применения в современной технике. Используют как чистый Al (изготовление проводов, металлотермия), так и его многочисленные облегчённые, коррозионноустойчивые сплавы.
Алюминий используют для получения термита. Теплоты, выделяющейся при сгорании термита, достаточно для сварки железнодорожных рельсов:
198

3Fe3O4 + 8Al → 4Al2O3 + 9Fe
термит
КAl(SO4)2×12H2O – алюмокалиевые квасцы. КAl(SO4)2 – жженые квасцы применяют для полосканий, промываний и примочек при воспалительных процессах слизистых оболочек и кожи, применяют как кровоостанавливающее средство при порезах.
Разнообразное применение в фотоэлементах, полупроводниковых лазерных, оптических приборах имеют материалы, содержащие остальные р-элементы IIIА-группы – Ga, In, Tl. Они также широко используются в производстве огнеупорной керамики, лазеров, абразивных материалов.
Соли таллия в небольших дозах приводят к временному облысению, что используют при лечении стригущего лишая. С начала 1980-х годов возрастает применение радиоактивного изотопа 201Tl (период полураспада 72,912 ч) для диагностики болезней сердечно-сосудистой системы и онкологических заболеваний.
199

