
Ко 2 сессии / Малашонок Неорганическая химия
.pdf
Получают Pb(OH)2 действием избытка раствора аммиака на растворимые соли свинца (II):
Pb(CH3COO)2 + 2NH3×H2O = Pb(OH)2¯ + 2CH3COONH4
Ge(OH)2 ® Sn(OH)2 ® Pb(OH)2
усиление основных свойств
Ge(OH)4 ® Sn(OH)4 ® Pb(OH)4
усиление основных свойств
Большинство солей Pb2+ малорастворимы. Из солей наиболее значимы PbSO4 (белый кристаллический порошок, растворимый в горячей воде), PbI2 (жёлтые кристаллы, растворимые в горячей воде), PbCO3, Pb3(OH)2(CO3)2 (свинцовые белила). Реакция образования жёлтого осадка PbI2 при действии на растворы, содержащие ионы Pb2+, иодида калия используется, как аналитическая реакция. Растворение осадка PbI2 в горячей воде с последующим охлаждением раствора сопровождается выделением красивых золотисто-жёлтых кристаллов (реакция «золотого дождя»). Малорастворимые соли растворяются в концентрированных растворах кислот, щелочей и солей с образованием комплексных соединений, например:
PbCl2 + 2HCl = H2[PbCl4]
PbSO4 + H2SO4 конц. = H2[Pb(SO4)2]
PbI2 + 2KI = K2[PbI4]
Из растворимых солей свинца (II) следует отметить нитрат Pb(NO3)2 и ацетат Pb(CH3COO)2 (свинцовый сахар).
Гидриды GeH4, SnH4 и PbH4. Подобно углероду и кремнию германий способен образовывать с водородом германоводороды GenH2n+2 (где n=1-9), аналогичные насыщенным углеводородам. Простейший германоводород GeH4 – устойчивый на воздухе газ с температурой кипения -88,5оС. На свету или при нагревании он разлагается на германий и водород. Для олова и свинца известны неустойчивые
тетрагидриды SnH4 (tкип.= -51,8оC) и PbH4 (tкип.= -13оС), которые разлагаются на металл и водород (при комнатной температуре гидрид
олова разлагается в течение нескольких часов, а гидрид свинца сразу же после получения). Тетрагидриды германия и олова можно получить действием на германиды или станниды магния разбавленными кислотами:
Mg2Ge + 4HCl = GeH4- + 2MgCl2
171
Mg2Sn + 2H2SO4 = SnH4− + 2MgSO4
а также восстановлением алюмогидридом лития тетрахлоридов олова или германия в среде безводного эфира:
SnCl4 + Li[AlH4] = SnH4−+ LiCl + AlCl3
На практике SnH4 образуется как побочный продукт при восстановлении соединений олова цинком или магнием в соляной кислоте:
H[SnCl3] + Zn + 3HCl = SnH4−+ 3ZnCl2
Тетрагидрид свинца PbH4 в незначительных количествах получается при действии соляной кислоты на смесь металлического свинца с цинком или магнием. Все гидриды обладают восстановительными свойствами и горят на воздухе. SnH4 горит пламенем василькового цвета:
SnH4 + 3O2 = SnO2 + 2H2O
Эту реакцию применяют для качественного обнаружения олова. Тетрагидрид германия, в отличие от CH4 и SiH4, проявляет слабые
кислотные свойства:
GeH4 + 4AgNO3 = Ag4Ge↓ + 4HNO3
SnH4, в отличие от GeH4, более сильный восстановитель и из раствора AgNO3 осаждает металлическое серебро.
Соединения с серой. Германий, олово и свинец образуют с серой сульфиды GeS, SnS, PbS и GeS2, SnS2. У германия (IV) и олова (IV) существуют также тиосоли.
Моносульфиды MS – малорастворимые соли, их получают пропусканием сероводорода через слегка подкисленные растворы солей
Ge(II), Sn(II) и Pb(II):
GeCl2 + H2S 2HCl + GeS↓ (красно-коричневый)
SnCl2 + H2S 2HCl + SnS↓ (коричневый)
Pb(NO3)2 + H2S 2HNO3 + PbS↓ (чёрный)
Все моносульфиды проявляют основные свойства, но реагируют только с концентрированными кислотами, например:
SnS + 3HClконц. = H[SnCl3] + H2S−
172
Вотличие от PbS сульфиды олова (II) и германия (II) растворимы
врастворах полисульфидов. При этом происходит окисление металлов и образование тиосолей олова (IV) и германия (IV), например:
SnS + (NH4)2S2 = (NH4)2SnS3
Моносульфиды растворяются в кислотах-окислителях:
3PbS + 8HNO3 = 2NO + 3Pb(NO3)2 + 3S + 4H2O
Дисульфиды GeS2 и SnS2 получают взаимодействием простых веществ при нагревании или пропусканием сероводорода через кислые растворы солей германия (IV) или олова (IV):
K2GeO3 + 2H2S + 2HCl = 2KCl + 3H2O + GeS2↓ (белый) H2[SnCl6] + 2H2S 6HCl + SnS2↓ (золотисто-жёлтый, сусальное золото)
Дисульфиды германия и олова обладают кислотными свойствами и хорошо растворимы в щелочах, концетрированном аммиаке, сульфидах металлов:
3SnS2 + 6NaOH = 2Na2SnS3 + Na2[Sn(OH)6]
3GeS2 + 6NH4OHконц. = 2(NH4)2GeS3 + (NH4)2GeO3 + 3H2O
GeS2 + K2S = K2GeS3
Образующиеся тиосоли щелочных металлов и аммония растворимы в воде. Растворимые тиогерманаты на воздухе неустойчивы и легко разлагаются. Растворимые тиостаннаты устойчивы в растворах при рН > 10, а в присутствии даже слабых кислот разлагаются:
Na2SnS3 + 2HCl = SnS2↓+ 2NaCl + H2S−
Na2SnS3 + 2CO2 + 2H2O = SnS2↓+ 2Na HCO3 + H2S−
Na2SnS3 + 8HClконц.= H2[SnCl6] + 3H2S− + 2NaCl
Биогенная роль р-элементов IV группы
Углекислый газ в малых концентрациях возбуждает дыхательный центр, в больших – угнетает. СО вытесняет кислород из оксигемоглобина крови благодаря образованию прочного комплекса с железом.
Синильная кислота и цианиды блокируют дыхательные ферменты, "выключая" дыхательный и сосудодвигательный рефлексы. Ткани перестают потреблять кислород.
173
Фосген поражает капилляры легких – резко повышается проницаемость для воды и белка капилляров и стенок альвеол. В результате развивается отек легких, сопровождаемый денатурацией белка (повышается вязкость крови).
Все соединения германия, олова и свинца токсичны. Чрезвычайно опасны гидриды и особенно их органические производные GeR4, SnR4, PbR4, где R – углеводородный радикал. Попадая в организм, свинец накапливается в костях, вызывая их разрушение. Свинец обладает кумулятивным эффектом.
Применение р-элементов IV группы и их соединений
Металлический германий применяют для изготовления полупроводниковых приборов, термисторов, фотоэлементов. Диоксид германия используется в производстве специальных стёкол с высоким показателем преломления и прозрачных в инфракрасной области, а также для изготовления специальной керамики. Металлические олово и свинец находят применение в качестве стойких к коррозии покрытий, труб и оболочек электрических кабелей и химических реакторов, и в составе разнообразных легкоплавких сплавов (припои, подшипники, бронзы, типографские сплавы). Металлическое олово применяют в качестве восстановителя и катализатора. Оксиды олова и свинца применяют для изготовления специальных стёкол и керамики. Комплексные соединения олова и германия используются как катализаторы.
На консервные банки идет примерно половина мирового производства олова. Другая половина – в металлургию, для получения различных сплавов.
Свинец мягок и легкоплавок, очень легко куется и прокатывается. Чтобы получить на свинце какое-нибудь изображение или надпись, достаточно простого тиснения. Отсюда – свинцовые печати старины. Изделия из этого металла (монеты, медальоны) использовались в Древнем Египте, свинцовые водопроводные трубы – в Древнем Риме. До 1990 г. большое количество свинца использовалось (вместе с сурьмой и оловом) для отливки типографских шрифтов, а также в виде тетраэтилсвинца – для повышения октанового числа моторного топлива.
Большие количества свинца расходуются для изготовления защитных устройств от радиации, электродов для свинцовых аккумуляторов и промышленных электролизёров. Сплав меди со свинцом используют в сверхпроводниковой технике. В температурном интервале 0,1...5°K этот сплав проявляет линейную зависимость сопротивления от темпе-
174
ратуры. Поэтому его используют в приборах для измерения низких температур. Свинцовое стекло варится без каких-либо осложнений, оно легко выдувается и гранится, сравнительно просто нанести на него узоры и обычную нарезку, винтовую, в частности. Такое стекло хорошо преломляет световые лучи и потому находит применение в оптических приборах. Использование свинцовых белил 2PbCO3×Pb(OH)2 в качестве красящего пигмента теперь не так распространено, как ранее, из-за их разложения под действием сероводорода H2S.
Ацетат свинца (свинцовый сахар) Pb(CH3COO)2·3H2O обладает вяжущим действием, но так как содержит ионы ядовитого свинца, то применяется как наружное средство в ветеринарии. Ацетат свинца применяют также в аналитической химии, крашении, ситценабивном деле, как наполнитель шёлка и для получения других соединений свинца. Хромат свинца PbCrO4 известен как хромовый желтый краситель, является важным пигментом для приготовления красок, для окраски фарфора и тканей. В последнее время его применение ограничено.
175
Тема 5. p – ЭЛЕМЕНТЫ III A ГРУППЫ
Общая характеристика элементов
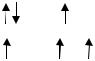
III-A группа – B, Al, Ga, In, Tl – характеризуются наличием 3-х электронов в наружном электронном слое атома, причем у бора на предвнешнем слое атома 2 электрона, у алюминия – 8 электронов, Ga, In, Tl – 18 электронов. В невозбужденном состоянии конфигурация внешнего уровня … ns2np1, в возбужденном состоянии – … ns1np2.
В невозбужденном состоянии имеется 1 неспаренный электрон, однако соединения В, Al, Ga, In, в которых их степень окисления +1, неустойчивы (за исключением таллия) и для В, Al, Ga, In наиболее характерна степень окисления +3 в возбужденном состоянии:
|
|
2s |
|
|
2p |
||
5B 2s22p1 |
|
|
|
|
|
(+1) |
|
|
|
|
|
|
|||
1 |
2 |
|
|
|
|
(+3) |
|
|
|
|
|
|
|||
5B 2s 2p |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
B – неметалл, имеет высокое значение энергии ионизации, Al проявляет амфотерные свойства, Ga, In, Tl – типичные металлы.
Основные характеристики атомов элементов III А группы представлены в таблице 5.1.
Таблица 5.1.
Основные характеристики атомов
Характеристика |
|
B |
Al |
Ga |
In |
Tl |
|
|
|
|
|
|
|
|
|
Электронная конфигурация |
|
2s22р1 |
3s23p1 |
4s24p1 |
5s25p1 |
6s26p1 |
|
Ковалентный радиус атома, нм |
|
0,082 |
0,118 |
0,126 |
0,144 |
0,148 |
|
|
|
|
|
|
|
|
|
Металлический радиус, нм |
|
0,091 |
0,143 |
0,139 |
0,166 |
0,171 |
|
|
|
|
|
|
|
|
|
Энергия ионизации I1, кДж/моль |
|
800,64 |
577,54 |
578,84 |
558,30 |
589,35 |
|
Сродство к |
электрону Ее_, |
|
|
|
|
|
|
кДж/моль |
|
|
26,987 |
41,759 |
41,5 |
29 |
19,3 |
Электроотрицательность |
χ |
|
|
|
|
|
|
(по шкале Полинга) |
|
2,04 |
1,61 |
1,81 |
1,78 |
1,8 |
|
Температура плавления, ° С |
|
2075 |
660,32 |
29,771 |
156,6 |
304 |
|
|
|
|
|
|
|
|
|
Температура кипения, ° С |
|
4000 |
2519 |
2204 |
2072 |
1473 |
|
|
|
|
|
|
|
|
|
Агрегатное состояние |
|
|
твердые вещества |
|
|||
Ео, В (Э3+ + 3е– |
= Э) |
|
|
–1,662 |
–0,549 |
–0,338 |
0,741 |
176
При переходе от Al к Ga радиус атома уменьшается. Это связано с тем, что у Ga заполнение р-подуровня начинается после того, как заполняется 3d10-подуровень. Заполнение d-оболочки сопровождается последовательным сжатием атомов, оно оказывается настолько сильным, что компенсирует возрастание радиуса при появлении четвертого энергетического уровня. В результате d-сжатия, при переходе от алюминия к галлию наблюдается уменьшение атомного радиуса. Вследствие этого энергии ионизации алюминия и галлия близки по значению, и свойства соединений алюминий +3 во многом схожи со свойствами соединений галлия +3. Металлические свойства резко усиливаются при переходе от бора к алюминию, несколько ослабевают у галлия, и вновь постепенно растут при переходе к таллию.
Рост энергии ионизации при переходе от In к Tl является результатом d- и f-сжатия, приводящего к усилению взаимодействия валентных электронов с ядром атома. Увеличение энергии связи 6s2-электронов Tl с ядром затрудняет их участие в образовании химических связей, поэтому для таллия степень окисления +1 становится более стабильной. Это подтверждает общую закономерность для р-элементов – вниз по группе усиливается устойчивость соединений в низших степенях окисления. Таким образом, в ряду Al – Ga – In – Tl основные свойства соединений усиливаются, а кислотные ослабевают.
Температура кипения закономерно уменьшается от B к Tl. Температура плавления изменяется незакономерно из-за особенностей строения кристаллической решетки.
Ga – один из самых легкоплавких металлов (tпл = 29,771оС, плавится на ладони). Низкая по сравнению с другими металлами температура плавления галлия, объясняется тем, что кристаллы металлического галлия состоят из молекул Ga2, связанных между собой слабыми межмолекулярными силами, при наличии определенной доли металличности связи.
Бор по своим свойствам наиболее схож с элементом IV A группы кремнием («диагональное сходство»). Для бора образование простого катиона В3+ не характерно. Решающая роль в химии бора принадлежит образованию ковалентных связей. В случае перехода в sp2- состояние электроны бора спариваются с тремя электронами других атомов, а в sp3-состоянии на вакантную р-орбиталь бора помещаются 2 электрона другого атома – донора электронной пары. Соответственно числу σ-связей координационное число бора (в степени окисления
177
+3) равно либо 3 для sp2-состояния (ВС13, ВО33− состояния (BF −4 , BH +4 ).
), либо 4 для sp3-
В природе бор встречается в виде кислородных соединений (свободной борной кислоты – H 3BO3 и буры – Na 2B4O7·10H2O), а также в виде сложных минералов.
Физические свойства. Бор – кристаллическое вещество, черного цвета, тугоплавкое. Очень чистый бор бесцветен. Он имеет плотность 2,3 г/см3, имеет высокие температуры плавления и кипения. Наиболее распространены две модификации бора: аморфный и кристаллический. Кристаллический бор – полупроводник; с повышением температуры его электропроводность возрастает, в отличие от металлов. Аморфная модификация бора более реакционноспособна.
Получение бора. В свободном состоянии бор может быть получен из борной кислоты. Нагреванием её переводят в борный ангидрид (В2О3), который затем прокаливают с металлическим магнием или углеродом:
В2О3 + 3Mg ¾t ® 3MgO + 2B (с примесью боридов магния) B2O3 + 3C ¾t ® 3CO + 2B (с примесью карбидов бора)
После обработки продуктов реакции соляной кислотой (для удаления MgO) остаётся элементарный бор.
Восстановление из хлорида бора:
2BCl3 + 3Zn ¾t ® 3ZnCl2 + 2B
Очень чистый бор можно получить термическим разложением паров ВВr3 на нагреваемой электрическим током танталовой проволоке в присутствии водорода:
2BBr3 + 3H2 ¾t ® 6HBr + 2B
Разложением водородных соединений:
2B2H6 ¾t ® 2B + 3H2
Химические свойства бора. В обычных условиях бор весьма инертен и взаимодействует лишь с фтором. При высоких температурах он соединяется не только с кислородом, хлором и бромом, но и с серой, азотом и углеродом:
2B + 3F2 → 2BF3 4B + 3O2 ¾t ® 2B2O3 2B + N2 ¾t ® 2BN
178
4B + 3C ¾t ® B4C3
Бор реагирует с горячими концентрированными кислотами H2SО4
и HNO3:
2B + 3H2SO4конц. → 2H3BO3 + 3SO2↑
B + 3HNO3конц. → H3BO3 + 3NO2↑
B + HNO3конц + 4HF → HBF4 + NO↑ + 2H2O
Со щелочами реагирует только в присутствии сильных окислителей:
2B + 2NaOH + 3H2O2 → 2NaBO2 + 4H2O
Однако аморфный бор может реагировать со щелочами при кипячении:
2Bаморфн. + 2NaOH ¾t ® 2NaBO2 + H2↑
Бориды – соединения бора с металлами, в которых бор проявляет отрицательные степени окисления. Подобно нитридам, карбидам и силицидам, некоторые из боридов по своему составу формально отвечают валентностям, известным для соответствующих элементов. Та-
ковы, например, MnB, MnB2, CrB, CrB2, MoB2, WB2, VB, TiB. В дру-
гих случаях это не соблюдается. Составы боридов можно отобразить общими формулами: M4B (M = Mn), M2B (M = Na, Mo, W), MB (M =
Ti, Hf, V, Cr, Mo, Mn, Fe, Ni), M3B4 (M = V, Nb, Cr, Mn), MB6 (M = La)
и другие. Как правило, бориды образуются при сплавлении простых веществ:
Mg + 2B ¾t ® MgB2
Бориды обладают высокой твёрдостью и хорошей электропроводностью. Многие из них отличаются очень высокими температурами плавления, например, для ZrB2 – 3040° С, для HfB2 – 3250° С. Довольно высока устойчивость большинства боридов по отношению к кислотам. Для боридов состава ЭВ2 устойчивость возрастает в ряду
MgB2 < VB2 < CrB2 < ZrB2 < TiB2 < NbB2 < TaB2, причём MgB2 разла-
гается не только любыми кислотами, но и водой, а на TaB2 (tпл. = 3200° С) не действует даже кипящая царская водка.
Галогениды бора общей формулы ВГ3 могут быть получены взаимодействием элементов при обычных условиях (ВF3), при 400° С (ВСl3), 700° С (ВBr3) или 900° С (ВI3).
179
Для получения BF3 более применим другой метод: нагревание смеси B2O3 и CaF2 с концентрированной серной кислотой. Реакция при этих условиях идёт по суммарному уравнению:
B2O3 + 3CaF2 + 3H2SO4 = 2BF3 + 3CaSO4 + 3H2O.
BF3 |
BCl3 |
BBr3 |
BI3 |
газ |
газ |
жидкость |
твердый |
Ecвязи кДж 644 |
443 |
376 |
284 |
устойчивость падает
Устойчивость галогенидов бора уменьшается от F→I: BF3 термически устойчив, а BI3 под действием света разлагается уже при обычных условиях.
ВF3 образуется посредством взаимодействия трех электронов атома бора в возбужденном состоянии с неспаренными электронами атомов фтора. Образуются три связи по спин-валентному (обменному) механизму, тип гибридизации sp2:
|
|
B* |
F |
F |
F |
|
||
|
|
Так как в галогенидах BГ3 у атома бора имеется свободная орбиталь, то молекулы BГ3 могут быть акцепторами электронной пары и участвовать в образовании связей по донорно-акцепторному механизму:
BF3 + F − → BF −4 (валентность бора = 4)
BF3 + NH3 → BF3 · NH3 (BF3 – кислота Льюиса) Ион BF −4 имеет тетраэдрическую структуру (sp3-гибридизация).
Галогениды бора представляют собой бесцветные вещества, дымящие во влажном воздухе. Они имеют кислотный характер и гидролизуются:
BCl3 + 3H2O → H3BO3 + 3HCl
В отличие от своих аналогов ВF3 гидролизуется незначительно, образующийся при гидролизе HF реагирует с BF3:
BF3+ H2O → H[BF4] + H3BO3
BF3+ HF → H[BF4] (тетрафтороборная кислота)
180
