
Ко 2 сессии / Малашонок Неорганическая химия
.pdf
PbS + 2O3 → PbSO4 + O2
2KOH + 7/3O3 → O2 + 2KO3 + H2O
озонид калия
Кислород может проявлять положительные степени окисления в
соединениях с фтором: +2 (O+2F2) и +1 (О2+1F2):
2F2 + 2NaOH → 2NaF + O+2F2 + H2O-2
В большинстве бинарных соединений кислорода с другими элементами (оксидах) степень окисления кислорода равна –2 . Чем более выражены неметаллические свойства элемента, тем более кислотный характер проявляет его оксид:
Na2O |
MgO |
Al2O3 |
SiO2 |
P2O5 |
SO3 |
Cl2O7 |
|
|
амфотерный |
|
|
|
|
основные |
|
|
кислотные |
|
||
Кислотный характер усиливается
Если элемент проявляет разные степени окисления и образует несколько оксидов, то чем выше степень окисления элемента, тем более кислотный характер будет проявлять этот оксид:
MnO |
MnO2 |
Mn2O7 |
основный |
амфотерный |
кислотный |
Вода (H2O) – самое распространенное вещество на Земле. Строение молекулы воды установлено экспериментально с большой точностью. Молекула воды имеет угловое строение в виде равнобедренного треугольника с атомом кислорода в вершине. Угол НОН = 104,5°. В соответсвии с методом ВС орбитали атома кислорода находятся в sp3- гибридном состоянии (рис. 2.2):
2p
2s
O
H1s H1s
Рис. 2.2.Механизм образования связей и строение воды
Электронная конфигурация валентной оболочки атома кислорода 2s22р4. На внешнем электронном уровне у него находятся две неподе-
41

ленные электронные пары и два неспаренных электрона. При образовании химических связей гибридизации подвергаются все четыре атомные орбитали кислорода. Атом кислорода расположен в центре неправильного тетраэдра, две неподеленные электронные пары кислорода занимают две вершины тетраэдра, а две другие заняты атомами водорода, что приводит к угловому строению молекулы воды. Валентный угол HОН 104,5° близок к теоретическому значению 109°28´. Меньшее значение валентного угла объясняется расталкиванием между собой неподеленных пар электронов.
Физические свойства воды. При обычных условиях вода - жидкость без вкуса и запаха. В тонком слое она бесцветна. При толщине более 2м вода приобретает голубоватый оттенок. Температура плавления 0° С, температура кипения +100° С, что значительно выше, чем у H2S, H2Se, H2Te. Аномально высокие температуры плавления и кипения воды объясняются существованием водородных связей между молекулами.
Связи Н-О в молекуле воды сильно поляризованы, электроны связи Н-О смещены к более электроотрицательному атому кислорода.
Поэтому атомы О приобретают избыточный от-
|
рицательный заряд, атомы Н – избыточные по- |
|
ложительные заряды. Наличие избыточных за- |
|
рядов на Н и О, а также неподеленных элек- |
|
тронных пар у атома кислорода обусловливает |
|
образование между молекулами воды водород- |
|
ных связей (рис. 2.3). |
Рис. 2.3. Образова- |
У воды проявляется еще одна аномалия – |
ние водородных |
аномалия плотности. Как правило, вещество в |
связей (…) в воде |
твердом агрегатном состоянии имеет большую |
|
плотность, чем в жидком. Вода в твердом агре- |
гатном состоянии (лед) имеет меньшую плотность, чем жидкая вода. Это объясняется тем, что при образовании водородных связей
(рис. 3) в алмазоподобной структуре льда образуются пустоты. Поэтому лед имеет меньшую плотность. Плавление льда сопровождается частичным разрушением водородных связей и заполнением пустот молекулами воды. Плотность жидкой воды при Р = 1,013·105 Па имеет максимальное значение 1 г/см3 при +4° С. Выше этой температуры плотность воды опять начинает уменьшаться. Однако это уменьшение незначительно, при химических расчетах плотность жидкой воды принимается равной 1 г/см3.
На рис. 2.4. представлена диаграмма состояния воды. Поскольку вода – единственное присутствующее в системе вещество, число неза-
42
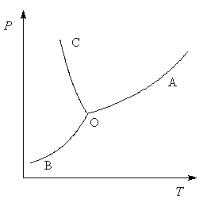
висимых компонентов К = 1. В системе возможны три фазовых равновесия: между жидкостью и газом (линия ОА – зависимость давления насыщенного пара воды от температуры), твердым телом и газом (линия ОВ – зависимость давления насыщенного пара надо льдом от температуры), твердым телом и жидкостью (линия ОС – зависимость температуры плавления льда от давления). Три кривые имеют точку пересечения О, называемую тройной точкой воды; тройная точка отвечает равновесию между тремя фазами.
В тройной точке система трехфазна (Ф = 3) и число степеней свободы в соответствии с правилом фаз Гиббса (С = К – Ф + 2) равно нулю. Три фазы могут находиться в равновесии лишь при строго определенных значениях температуры и давления (для воды тройная точка отвечает состоянию с Р = 0,61 кПа и Т = 0,01оС).
Рис. 2.4. Диаграмма состояния воды
Кривая ОВ теоретически продолжается до абсолютного нуля, а кривая давления насыщенного пара над жидкостью ОА заканчивается в критиче-
ской точке воды (Tкрит = 374°C и давлении 22,064 МПа (218 атм)); выше критической температуры газ и жидкость не могут существовать как от-
дельные фазы. Кривая ОС в верхней части (при высоких давлениях) изменяет свой наклон (появляются новые кристаллические фазы, плотность которых, в отличие от обычного льда, выше, чем у воды).
Внутри каждой из областей диаграммы (АОВ, ВОС, АОС) система однофазна; число степеней свободы системы (С) равно двум (система дивариантна), т. е. можно одновременно изменять и температуру,
идавление, не вызывая изменения числа фаз в системе:
С= 1 – 1 + 2 = 2.
43

На каждой из линий число фаз в системе = 2 и, согласно правилу фаз, система моновариантна, т. е. для каждого значения температуры имеется только одно значение давления, при котором система двухфазна:
С = 1 – 2 + 2 = 1.
Кривая равновесия ОС «твердое вещество – жидкость» на диаграммах состояния воды и висмута наклонена влево, а на диаграммах состояния остальных веществ – вправо. Это связано с тем, что плотность воды больше, чем плотность льда, т. е. плавление сопровождается уменьшением объема ( V < 0).
Чистая вода имеет незначительную электропроводность, которую можно объяснить самоионизацией воды:
Н2О Н+ + ОН- или 2Н2О Н3О+ + ОН- .
(Ион гидроксония)
В чистой воде при стандартной температуре концентрации ионов водорода (гидроксония) и гидроксид-ионов равны:
С(Н+) = С(ОН-) = 10-7моль/л; рН чистой воды при 25° С = 7.
Химические свойства воды
Тип реакции |
Пример |
|
Взаимодействие cо щелочными и |
Ca + 2H2O = Ca(OH)2 +H2 |
|
щелочноземельными металлами |
|
|
При высокой температуре с некото- |
t o |
|
Mg + 2H2O ¾¾® Mg(OH)2 +H2 |
||
рыми другими металлами (Mg, Fe, |
|
o |
|
3Fe+ 4H2O ¾¾® Fe3O4 +4H2 |
|
Zn) |
t |
|
|
|
|
С Al и Zn в присутствии щелочей |
2Al + 6H2O + 2NaOH = 2Na[Al(OH)4] +3H2 |
|
|
|
|
С некоторыми неметаллами |
Cl2 + Н2О НClО + НCl |
|
|
2F2 + 2Н2О = 4НF + O2 |
|
|
C + Н2О ¾¾® CO + H2 |
|
|
t o |
|
С Si в присутствии щелочей |
Si + 2H2O + 2NaOH = Na2SiO3 +2H2 |
|
|
|
|
Со сложными веществами |
CaO + H2O = Ca(OH)2 |
|
|
|
|
|
P2O5 + 3H2O = 2H3PO4 |
|
|
KH + Н2О = KOH + H2 |
|
|
Na2CO3 + H2O NaНCO3 + NaОН |
|
|
Ca3P2 + 6H2O = 3Ca(OH)2 + 2PH3 |
|
|
Ca2Si + 4H2O = 2Ca(OH)2 + SiH4 |
|
|
|
|
44
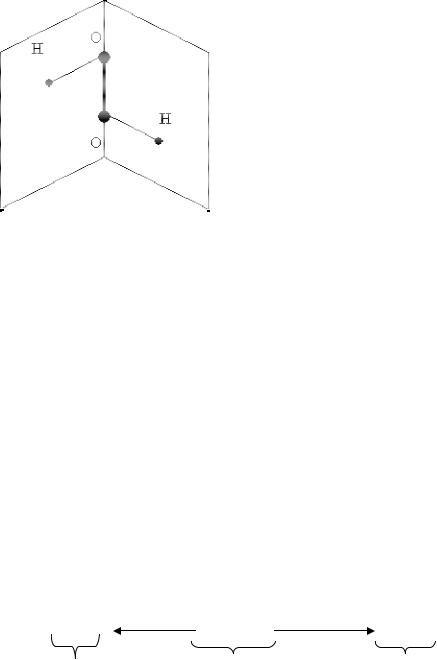
Пероксид водорода - Н2О2. Строение пероксида водорода Н2О2
|
показано на рис.2.5. Молекула H2O2 не- |
||
|
плоская, имеет строение H−O−O−H |
с |
σ- |
|
связью O−O на ребре и σ-связями H–O |
на |
|
|
плоскостях двугранного угла. Степень |
||
|
окисления кислорода равна −I, |
валент- |
|
|
ность атома O равна 2. Группу –O–O– |
на- |
|
|
зывают пероксогруппой. |
|
|
|
Пероксид водорода H2O2 - бесцветная |
||
|
жидкость, неограниченно смешивается с |
||
|
водой. На свету и под действием катализа- |
||
Рис.2.5. Строение пероксида |
торов (MnO2) легко разлагается (при нагре- |
||
водорода |
вании - со взрывом): |
|
|
2H2O2 = 2H2O + O2↑
В водных растворах пероксид водорода значительно устойчивее и является слабой кислотой:
H2O2 Н+ + НО2− (Кдис. = 1,4·10-12)
H2O Н+ + ОН– (Кдис. = 1,8·10-16)
Ионизация по второй ступени в водной среде практически не протекает. Как кислота H2O2 реагирует со щелочами:
2NaOH + Н2О2 = Na2О2 + 2Н2О
Пероксид водорода, содержащий кислород в промежуточной степени окисления –1, может выступать в окислительновосстановительных реакциях либо в качестве окислителя, либо в качестве восстановителя:
восстановление |
окисление |
|
Н2О-2 |
Н2О2− |
О2 |
восстановитель |
двойственные свойства |
окислитель |
Примеры ОВР с Н2О2 в качестве окислителя:
Н2О2 + 2KI + H2SO4 = I2+ K2SO4 + 2Н2О
Н2О2 + 2KI = 2KOH + I2
С сильными окислителями пероксид водорода – восстановитель, окисляется до свободного кислорода:
45
2KMnO4 + 5Н2О2 + 3H2SO4 = 2MnSO4 + K2SO4 +5O2 + 8Н2О
Эти процессы характеризуются следующими значениями стандартных окислительно-восстановительных потенциалов:
а) как окислитель:
Н2О2 + 2Н+ + 2ē = 2Н2О; Е˚ = 1,776 В (в кислой среде) Н2О2 + 2ē = 2ОН– ; Е˚ = 0,88 В (в щелочной среде)
б) как восстановитель:
Н2О2 – 2 ē = О2 + 2Н+; Е˚ = 0,695 В (в кислой среде)
НО2− + ОН– – 2 ē = О2 + Н2О; Е˚ = –0,076 В (в щелочной среде)
Из значений электродных потенциалов следует, что окислительные свойства у Н2О2 выражены сильнее, чем восстановительные. Окислительные свойства Н2О2 сильнее выражены в кислой среде.
В промышленности Н2О2 получают при электролизе 50%-ного раствора серной кислоты:
анод 2SО24− – 2 ē = S2О82− ; Е˚ = 2,01 В
С последующим гидролизом пероксодисерной кислоты:
Н2S2O8 + 2Н2О = 2H2SO4 + Н2О2↑
Образующийся пероксид водорода извлекают из раствора отгонкой в вакууме.
В лаборатории Н2О2 получают действием 20%-ной серной кислоты на влажный пероксид бария:
Ва + О2 ¾t ® ВаО2 ВаО2 + H2SO4 = ВаSO4↓ + Н2О2
Пероксид водорода окисляет многие органические вещества (волосы, текстильные волокна и др.). На этом свойстве основано использование его разбавленных растворов в качестве обесцвечивающего и отбеливающего средства.
Применение пероксида водорода в медицине как дезинфицирующего средства также основано на его окислительной способности. В медицинской практике пероксид водорода применяется как наружное средство в качестве антисептика. Антисептическое действие обусловливается окислительными свойствами пероксида водорода, который выделяет кислород в присутствии ферментов – каталазы крови. Каталаза быстро разлагает пероксид водорода, при этом бурно выде-
46
ляется кислород, что создает видимость пены. Пероксид водорода применяется как кровоостанавливающее средство при порезах.
В продажу пероксид водорода поступает в виде 30%-ного раствора (пергидроля) или 3% водного раствора.
Свойства пероксида водорода определяют и условия его хранения – в склянках из оранжевого стекла, имеющего отрицательную реакцию на щелочность. Склянки должны быть закупорены парафинированными или стеклянными пробками. Хранить препарат следует в прохладном, защищенном от света месте, концентрированные растворы более нестойки. Поэтому пергидроль хранят в склянках, покрытых внутри парафином (шероховатая поверхность может ускорить и усилить разложение пероксида водорода).
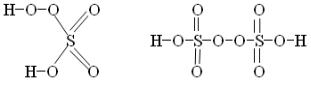
Производные Н2О2 – надкислоты и надоснования (пероксосоединения). В их структуре существует пероксидная цепочка (− О– О−). Надкислоты получаются при замещении водорода в молекуле Н2О2 на кислотные радикалы, например:
При замене одного атома водорода на металл получаем надоснования: К− О− ОН. КО2Н можно рассматривать как кислую соль пероксида водорода и называть гидропероксидом калия.
Сера
Сера – типичный неметалл, неметаллические свойства серы выражены слабее, чем у кислорода. При стандартных условиях простое вещество сера представляет собой порошок или кристаллы желтого цвета.
Одно из характерных свойств атомов халькогенов – их способность связываться друг с другом в кольца или цепи. Это явление называют катенацией. Причина образования гомоцепей связана с различной прочностью одинарных и двойных связей:
Элемент |
Связь Э = Э |
Энергия, |
Связь Э – |
Э – Э |
Энергия |
|
|
кДж/моль |
|
|
кДж/моль |
|
|
|
|
|
|
|
|
|
|
|
|
Кислород |
О = О |
493,6 |
О – О – |
О |
146·2 = 292 |
|
|
|
|
|
|
|
|
|
|
|
|
Сера |
S = S |
421,3 |
S – S – S |
265·2 = 530 |
|
|
|
|
|
|
|
|
|
|
|
|
|
47

Из приведенных значений следует, что образование двух одинарных σ-связей для серы вместо одной двойной связано с выигрышем в энергии (530 – 421 = 108,7 кДж). Для кислорода, напротив, одна двойная связь энергетически предпочтительнее (494 – 292 = 201,6 кДж), чем две одинарные. Уменьшение прочности двойной связи при переходе от кислорода к сере связано с увеличением размеров р-орбиталей и уменьшением их перекрывания. Таким образом, для кислорода катенация ограничивается небольшим числом нестойких соединений, например озон O3.
Гомоцепи серы имеют зигзагообразную форму, поскольку в их образовании принимают участие электроны взаимно перпендикуляр-
ных р-орбиталей.
Аллотропные модификации се-
|
ры. Существуют три аллотропные мо- |
|
дификации серы: ромбическая, моно- |
|
клинная и пластическая. Ромбическая |
Рис. 2.6. Строение молекулы |
и моноклинная модификации построе- |
ромбической серы. |
ны из циклических молекул S8. При |
комнатной температуре устойчива ромбическая сера. Молекула S8 имеет форму короны (рис. 2.6).
При плавлении кристаллов серы (tпл = 99,5оС) разрываются слабые межмолекулярные связи и освобождаются циклические молекулы S8, приобретающие при этом легкую подвижность. Вязкость расплава в этих условиях меньше вязкости воды. При 159,4оС все свойства жидкой серы изменяются скачкообразно (теплоемкость, плотность,
цвет, электропроводность, поверхностное натяжение и др.). Осо-
бенно резко меняется вязкость расплава, которая при нагревании до 195оС возрастает в 10 тысяч раз (расплав перестает выливаться из пробирки). Это связано с процессом двухступенчатой полимеризации, в результате которой образуются гомоцепи:
цикл S8 → цепь S8
цепь S8 + цикл S8 → цепь S16 и т.д.
В результате полимеризации собираются цепи длиной более 200 тысяч атомов серы. При дальнейшем нагревании вязкость расплава понижается из-за начинающейся деполимеризации. Цепи постепенно укорачиваются до ~1000 атомов при 400оС и до ~100 атомов при 600оС. Выше 445оC давление насыщенного пара над жидкой серой превышает 105 Па (1атм). В газообразном состоянии присутствуют все молекулы Sn (2 
 n
n 

 10), включая молекулы с нечетным числом атомов.
10), включая молекулы с нечетным числом атомов.
48
|
Химические свойства серы |
|
|
|
|
Тип реакции |
|
Пример |
Взаимодействие |
|
2K + S = K2S |
c металлами |
|
|
|
Cu + S = CuS |
|
|
|
|
|
|
Hg + S = HgS (комнатная температура) |
С неметаллами |
|
C + 2S = CS2 |
|
|
2P + 5S = P2S5 |
|
|
S + 3F2 = SF6 |
С водородом |
|
H2 + S = H2S |
|
|
|
С кислородом |
|
S + O2 = SO2 |
|
|
|
Со сложными веществами |
S + 2HNO3 = 2NO + H2SO4 |
|
|
|
|
|
|
S + 2H2SO4(конц.) = 3SO2 + 2H2O |
|
|
S + K2Сr2O7 ¾¾® K2SO4 + Cr2O3 |
|
|
t o |
|
|
3S + 6KOH = K2S+4O3 + 2K2S-2 + 3H2O |
|
|
|
В промышленности серу в основном получают выплавкой ее из самородных месторождений. Менее используются способы, основанные на окислении промышленных газов, содержащих сероводород:
2H2S + O2 = 2S + 2H2O; |
H2S + SO2 = 2H2O + 3S. |
Сероводород H2S – ковалентное соединение. В отличие от воды молекулы сероводорода не образуют между собой водородных связей. Атом серы менее электроотрицательный, чем атом кислорода, имеет больший размер и, как следствие, меньшую плотность заряда. Валентный угол HSH составляет 92°, что свидетельствует об отсутствии гибридизации орбиталей атомов серы.
Физические свойства. При обычных условиях сероводород – бесцветный газ, с сильным характерным запахом тухлых яиц.
tпл = -86° С, tкип = -60° С, плохо растворим в воде, хорошо растворим в спирте. Очень ядовит. В природе выделяется в составе вулканических
газов, образуется при гниении растительных и животных организмов. H2S придает водному раствору слабокислый характер. При растворении в воде образует слабую двухосновную сероводородную кислоту. Диссоциация сероводородной кислоты протекает обратимо и
ступенчато:
I ступень |
+ |
- |
; Кдис 1 |
= 6·10 |
-8 |
|
H2S H + HS |
|
|||
49

II ступень |
- |
H |
+ |
+ S |
2- |
; Кдис 2 = 1·10 |
-14 |
|
HS |
|
|
|
Сероводородной кислоте присущи все свойства слабых кислот. Как двухосновная, кислота образует два типа солей – сульфиды (K2S)
и гидросульфиды (КHS):
H2S + 2KOH = K2S + 2H2O
H2S + KOH = KHS + H2O
H2S + CuSO4 = CuS↓ + H2SO4
H2S + 2NH3 = (NH4)2S
Гидросульфиды, сульфиды щелочных и щелочноземельных металлов хорошо растворимы в воде, сульфиды тяжелых металлов практически нерастворимы.
Получение H2S и сульфидов:
H2S в промышленности прямым |
H2 + S = H2S |
|
синтезом |
|
|
H2S в лаборатории |
FeS + 2HCl(конц.) = FeCl2 + H2S |
|
|
|
4Ca + 5H2SO4( конц.) = 4CaSO4 + 4H2O + H2S |
|
|
|
Сульфиды: |
взаимодействие |
Fe + S = FeS |
простых веществ |
|
|
|
|
|
Из растворов солей по реакции |
Pb(NO3)2 + (NH4)2S = PbS↓ + 2NH4NO3 |
|
ионного обмена |
|
|
|
|
|
Аналогично оксидам сульфиды классифицируют в соответствии с типом связей в молекулах сульфидов на кислотные, основные, амфотерные. Характер сульфидов элементов III периода:
Na2S |
MgS |
Al2S3 |
SiS2 |
P2S5 |
|
основные |
амфотерный |
|
кислотные |
Различные по кислотно-основному характеру сульфиды по-разному реагируют с Н2О:
основные Na2S + H2O → NaHS + NaOH (рН > 7) амфотерный Al2S3 + 6H2O → Al(OH)3 + H2S− кислотные SiS2 + 3H2O → H2SiO3↓ + 2H2S−(рН < 7)
Различные по характеру сульфиды взаимодействуют между собой: Na2S + CS2 → Na2CS3 – тиокарбонат натрия
50
