
Ко 2 сессии / Малашонок Неорганическая химия
.pdfи мозга. Фтор в виде фторидов нужен для нормального роста и пигментации зубов. Избыток солей фтора в организме вызывает остеохондроз, а затем огрубление суставов и их неподвижность. Человек начинает с трудом передвигаться. Под действием кислот растворяется минеральная основа зубных тканей – гидроксилапатит Са5(РО4)3ОН. Фторирование воды, применение фторированных зубных паст является эффективным средством профилактики этого заболевания:
NаF(паста) + Са5(РО4)3ОН = NаОН + Са5(РО4)3F(зубная эмаль)
Фторапатит образует более твердый эмалевый слой.
В организме человека содержится примерно 100 г хлора. Хлоридионы не обладают токсическим действием. С1– – постоянный спутник ионов натрия в организме. NaCl регулирует распределение воды в организме. Хлорид-ион имеет оптимальный радиус для проникновения через мембрану клеток. Вместе с ионами натрия и калия создает определенное осмотическое давление. Суточная потребность хлорида на-
трия – 5 – 10 г.
Бром в организме высших животных и человека, в том числе и в крови, часто находится в виде броморганических соединений. Соединеия КBr и NaBr применялись в медицине как успокаивающие средства. Более эффективное действие оказывают броморганические вещества, которые используются в борьбе с инфекциями (бромтетрациклин) и как антисептики (ксероформ – трибромфенолят висмута). Бро- мид-ионы могут замещать хлорид- и иодид-ионы и наоборот. Поэтому при отравлении бромом вводят большое количество хлорида натрия и обильное питье.
Для увеличения срока хранения овощей и фруктов их обрабатывают раствором бромида калия. Броматы натрия и калия добавляют в тесто для получения пышного белого хлеба.
В организме человека содержание иода невелико (около 25 мг), концентрируется он главным образом в щитовидной железе (15 мг или около 0,1 %). В виде органического соединения – триоксина, активной части гормона, выделяемого щитовидной железой, йод играет важную роль в процессах обмена веществ, являясь регулятором их скорости. Триоксин повышает усвоение кальция и фосфора, сопротивляемость организма к инфекциям и ядам. Недостаток триоксина ведет к развитию зоба, в детстве задерживает рост, физическое и психическое развитие. Иод является также и антисептиком, который оказывает антибактериальное, противовирусное, фунгицидное действие. Недостаток иода, кроме базедовой болезни или отклонений в умст-
31
венном развитии, может вызывать изменения в хромосомах и способствовать возникновению раковых заболеваний. Кроме того, соединения иода вызывают расширение мельчайших сосудов капилляров и усиливают таким образом кровообращение. NаI и КI используют как отхаркивающее средство при воспалительных заболеваниях дыхательных путей. Для предотвращения недостатка йода нужно использовать иодированную пищевую соль (10 г КI на 1 т NaС1) и другие йодированные продукты
Применение галогенов и их соединений
Хлор применяется для обеззараживания питьевой воды (1,5 г хлора на 1м3 воды) и сточных вод
Хлор и его производные – белильная известь, гипохлорит натрия используют для отбеливания тканей, очистки воды от органических примесей.
Тетрафторэтилен в результате полимеризации дает ценный полимер – тефлон, устойчив к химическим реагентам и незаменим в производстве веществ особой чистоты, для изготовления различной аппаратуры. Фторопроизводные материалы – в медицине, заменители кровеносных сосудов и сердечных клапанов.
В холодильной технике применяют фреоны – фторо- и хлорзамещенные углеводородов (СС13F, CC12F2 и др.). Фреоны не принадлежат к огнеопасным веществам, не взаимодействуют с металлами.
Хлоропроизводные углеводородов – хлороформ, дихлорэтан, тетрахлорид углерода – ценные растворители. Их используют для обезжиривания материалов, для растворения и экстракции жиров.
KClO3 – хлорат калия (бертолетова соль) – используется в спичках (около 50% состава спичечной головки). Причиной возгорания спичек является превращение красного фосфора, находящегося на поверхности спичечного коробка (при трении), в белый:
|
[Ркрасный] = [Рбелый] |
|
НOf , 298 кДж/моль |
–17,6 |
0 |
Под действием теплоты, выделяющейся при трении, белый фосфор воспламеняется и поджигает спичку.
Один из основных компонентов современных твердых ракетных топлив – перхлорат аммония NH4ClO4. Пример реакции горения:
6NH4ClO4 + 10Al = 3N2 + 9H2O + 6HCl + 5Al2O3
32
Mg(ClO4)2 – перхлорат магния – используется в сельском хозяйстве как дефолиант – вещество, вызывающее опадение листьев растений (например, при уборке хлопка).
Безводный перхлорат магния Mg(ClO4)2 жадно поглощает воду, образуя кристаллогидраты. Это один из наиболее сильных осушителей. Техническое название ангидрон. Он удобен тем, что после поглощения воды может быть вновь обезвожен нагреванием.
Раствор I2 в водном растворе KI: I2 + KI – раствор Люголя в медицине – используется при лечении ангины.
BaCl2 – ядовитое вещество. Используется для борьбы с вредителями в сельском хозяйстве.
CaCl2 – для осушения газов (образуется CaCl2·6Н2О).
HgCl2 – сулема – сильный яд, разбавленные растворы используются для протравливания семян.
AgBr – в медицине для успокоения нервной системы.
Хлораты NaClO3, Mg(ClO3)2, Ca(ClO3)2 – гербициды сильного действия, т. е. уничтожают все растения. В меньших дозах действуют как дефолианты.
33
Тема 2. р-ЭЛЕМЕНТЫ VI A ГРУППЫ (ХАЛЬКОГЕНЫ)
Общая характеристика элементов
VI A группа: O (кислород), S (сера), Se (селен), Te (теллур) и Po (полоний – радиоактивный элемент). Общее название – халькогены.
Полные электронные формулы атомов халькогенов:
8O: 1s22s22р4;
16S: 1s22s22р63s23р4;
34Se: 1s22s22р63s23р64s24р4;
52Te: 1s22s22р63s23р63d104s24р64d105s25р4.
Сокращенная электронная конфигурация … ns2np4. На внешнем электронном уровне атомов 6 электронов: две электронные пары и два неспаренных электрона:
|
2p |
3s |
3p |
3d |
2s |
|
|||
|
|
|
||
O |
|
S |
|
|
До завершения внешней электронной оболочки атомам не хватает по два электрона, поэтому все элементы проявляют в своих соединениях минимальную степень окисления -2. Кислород по электроотрицательности уступает только фтору. В соединениях с фтором он проявляет положительные степени окисления: O +21 F2, O+2F2. В пероксидах
степень окисления кислорода равна -1: H2O −21 , K2O −21 . Атомы серы, селена и теллура в соединениях с более электроотрицательными элементами проявляют положительные степени окисления +2, +4, +6.
Для кислорода, элемента 2-го периода, максимальная валентность теоретически равна четырем. Однако в соединениях чаще проявляется
валентность (II), в некоторых соединениях (III): С  О, Н3О+. У серы и атомов халькогенов, расположенных в периодической системе ниже серы, появляются d-подуровни, что повышает валентные возможности элементов:
О, Н3О+. У серы и атомов халькогенов, расположенных в периодической системе ниже серы, появляются d-подуровни, что повышает валентные возможности элементов:
3s |
3p |
3d |
|
||
|
|
Валентность четыре S*
|
3s |
3p |
3d |
|
|
||
|
|
|
|
Валентность шесть |
S** |
|
|
|
|
|
Кислород – самый распространенный элемент на Земле. В виде простого вещества (О2) кислород входит в состав атмосферы (≈ 21%
34
по объему). В связанном виде кислород – составная часть воды, многих минералов и образуемых ими руд. Сера в природе встречается в самородном состоянии, в виде соединений с металлами – сульфидов:
FeS2, PbS, HgS, ZnS.
Основные характеристики атомов халькогенов представлены в таблице 2.1.
|
|
|
|
|
|
|
|
|
Таблица 2.1 |
|
|
Основные характеристики атомов халькогенов |
|
|
|||||||
|
|
|
|
|
|
|
|
|
||
Характеристика |
|
O |
|
S |
|
Se |
|
Te |
||
|
|
|
|
|
|
|
|
|
||
Ковалентный радиус, нм |
|
0,073 |
|
0,102 |
|
0,116 |
|
0,135 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
увеличение |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Ионный радиус Э2-, нм (к.ч.= 6) |
0,140 |
|
0,184 |
|
0,198 |
|
0,221 |
|||
|
|
|
|
увеличение |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Энергия ионизации I1, кДж/моль |
1313,94 |
|
999,59 |
|
940,96 |
|
869,20 |
|||
|
|
|
|
уменьшение |
|
|
|
|||
|
|
|
|
|
|
|
|
|
||
Сродство к |
электрону |
Ее_, |
140,975 |
|
200,410 |
|
194,968 |
|
190,153 |
|
кДж/моль |
|
|
|
|
уменьшение |
|
|
|
||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|||
Электроотрицательность |
χ |
3,44 |
|
2,58 |
|
2,55 |
|
2,1 |
||
(по шкале Полинга) |
|
|
|
|
|
|
|
|
||
|
|
уменьшение |
|
|
|
|||||
Ео, В (Э + 2е– |
= Э2– ) |
|
|
|
|
–0,476 |
|
–0,924 |
|
–1,143 |
|
|
|
|
уменьшение |
|
|
|
|||
|
|
|
|
|
|
|
|
|
||
Характерные |
степени |
окисле- |
|
|
– 2,+2, +4, |
|
– 2,+2, +4, |
|
– 2,+2, |
|
ния в соединениях |
|
|
–1, –2 , +2 |
|
+6 |
|
+6 |
|
+4, +6 |
|
Температура |
плавления |
про- |
–218,79 |
|
110,2 |
|
221 |
|
449,51 |
|
стых веществ, ° С |
|
|
|
|
|
|||||
Температура |
кипения |
простых |
–182,95 |
|
444,6 |
|
685 |
|
988 |
|
веществ, ° С |
|
|
|
|
|
|
||||
Агрегатное состояние |
|
|
газ |
|
Твердые вещества |
|||||
|
|
|
|
|
|
|
|
|||
Содержание в литосфере W,% |
46,1 |
|
0,035 |
|
5 × 10– 6 |
|
1 × 10– 7 |
|||
По мере роста заряда ядра атомов увеличивается ковалентный радиус атомов и соответственно уменьшается энергия ионизации.
Следовательно, сверху вниз по группе неметаллические свойства элементов халькогенов ослабевают, а металлические нарастают. Для халькогенов значения ковалентных радиусов больше, а энергии ионизации – меньше, чем для галогенов, расположенных в том же периоде.
Сродство к электрону у атомов халькогенов достаточно высокое, что указывает на выраженные неметаллические свойства. Однако, сродство к электрону меньше, чем для галогенов того же периода. Для кислорода сродство к электрону меньше, чем для серы, что объясняет-
35
ся меньшими размерами атома кислорода и большим межэлектронным расталкиванием в атоме кислорода.
С ростом заряда ядра атомов уменьшается электроотрицательность, неметаллические свойства элементов халькогенов по группе ослабевают. Так как у халькогенов электроотрицательность ниже, чем у галогенов, ионный характер связей в бинарных соединениях выражен слабее. Ионный тип связи характерен для соединений со щелочными и щелочноземельными металлами: Na2S, CaO, BaS.
Кислород
Кислород существует в виде двух аллотропных модификаций: кислород и озон. Аллотропия кислорода обусловлена различным числом атомов в молекулах веществ O2 и O3.
Физические свойства аллотропных модификаций кислорода:
Вещество |
Цвет |
Запах |
|
tпл, ° С |
tкип, ° С |
|
|
|
|
|
|
Кислород О2 |
Бесцветный, в жидком |
Без запаха |
|
–218,79 |
–182,95 |
|
состоянии - голубой. |
|
|
|
|
|
|
|
|
|
|
Озон О3 |
Бесцветный, в жидком |
Характерный |
|
–251 |
–112 |
|
состоянии – синий |
резкий запах |
|
|
|
|
|
|
|
|
|
Получение кислорода в промышленности – 1) фракционная пе-
регонка жидкого воздуха (tкип.(O2) = -182,95oC), tкип.(N2) = -195,79oC); 2) Электролизом водных растворов щелочей, который сводится к
электролизу H2O. Щелочь необходима для электоропроводности раствора:
катод 2H2O + 2e– = H2 + 2OH–
анод 4OН– – 4 e– = O2 + 2H2O
2H2O 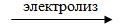 2H2 + O2
2H2 + O2
В лаборатории - прокаливание легко разлагающихся кислородсодержащих веществ, таких как H2O2, KClO3, HgO, KNO3, KMnO4:
2HgO = 2Hg + O2 |
2KMnO4 = K2MnO4 + MnO2 + O2. |
2KСlО3 = 2KСl + 3О2 |
2H2O2 = 2H2O + O2 |
2KNО3 = 2KNО2 + О2 |
2Na2O2 + 2CО2 = 2Na2CO3 + O2 |
t |
KO2 + 2CО2 = 2K2CO3 + O2 |
BaO2 ¾® BaO + О2 |
36
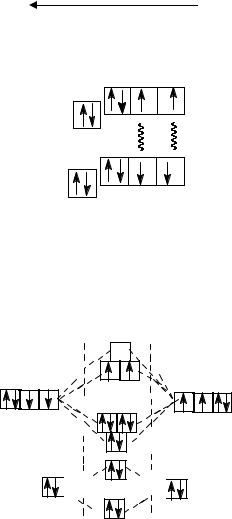
Озон получают из кислорода под действием электрического разряда:
Электрический разряд
3O2  2O3.
2O3.
В соответствии с методом ВС порядок связи в молекуле O2 равен 2, неспаренные электроны отсутствуют:
2p
2s
O
O
Однако жидкий кислород обладает парамагнитными свойствами, втягивается в магнитное поле, следовательно, у него есть неспаренные электроны. Более правильно объясняет строение молекулы О2 метод молекулярных орбиталей (рис.2.1):
|
МО |
( O |
) |
АО(O ) |
2 |
АО(O ) |
|
|
|||
|
σ2разрp . |
|
|
|
|
||
|
|
||
|
πразр2p . |
2p |
π 2свp. |
2p |
|
|
σсв2p. |


 σразр2S .
σразр2S . 




2s |
2s |
св.
σ2s
Рис.2.1. Энергетическая диаграмма молекулярных орбиталей молекулы О2
Два неспаренных электрона на π- разрыхляющих орбиталях обуславливают парамагнетизм молекулы кислорода. Порядок связи в молекуле кислорода и соответствующих молекулярных ионов кислорода (равен разнице электронов на связывающих и разрыхляющих орбиталях, деленной на 2):
О2+ , |
О02 , |
О-2 , |
О22- |
ПС (порядок связи) 2,5 |
2 |
1,5 |
1 |
37
Положительный молекулярный ион О+2 - диоксигенил-катион – самая прочная из всех частиц. О+2 , был впервые получен в 1962 г. в соединении O2[PtF6] – гексафтороплатинат(V) диоксигенила.
При заполнении одной πразр 2pу орбитали образуется ион О2− (существует в надпероксидах) со связью, имеющей кратность 1,5:
О2 + ē → О2−
K + O2 → K+O 2− (надпероксид калия)
При полном заполнении обеих πразр 2p орбиталей происходит образование ионов O 22- с одинарной слабой связью, содержащейся в пероксидах:
2Na + O2 → Na2+O 22- (пероксид натрия)
Химические свойства кислорода. Так как в молекуле кислорода довольно прочная двойная связь О=О, при обычных условиях кислород относительно неактивен. Активность его резко возрастает при повышении температуры. При нагревании кислород реагирует с большинством простых веществ. Исключение – инертные газы, галогены, благородные металлы (Ag, Au, Pt).
Реакции с кислородом обычно сопровождаются выделением большого количества тепла и света. Кислород во всех реакциях выполняет функцию окислителя. Горение – быстро протекающая химическая реакция, при которой происходит окисление веществ с выделением тепла и света. Вещества могут гореть не только в атмосфере кислорода, но и в хлоре, фторе и др.
В природе протекают также процессы медленного окисления веществ кислородом. К таким процессам относятся коррозия металлов,
гниение, дыхание.
Наиболее характерные реакции для кислорода:
Тип реакции |
Пример |
|
Окисление всех металлов, кроме Ag, |
4Al + 3O2 = 2Al2O3; |
|
Au, Pt. Наиболее активные металлы об- |
3Fe + 2O2 = Fe3O4; |
|
разуют пероксиды (Na), смесь перокси- |
||
2Na + O2 = Na2O2; |
||
дов и надпероксидов (K, Rb, Cs) |
||
|
K + O2 = KO2 |
|
|
|
|
Окисление неметаллов, кроме галоге- |
S + O2 = SO2; |
|
нов и благородных газов |
4Р + 5О2 = 2Р2О5; |
|
|
38
Тип реакции |
Пример |
|
|
С + О2 = СО2; |
|
|
2Н2 + О2 = 2Н2О. |
|
Окисление водородных соединений |
2LiН + О2 = 2LiOН |
|
металлов и неметаллов |
4NН3 + 3О2 = 2N2 + 6Н2О; |
|
|
||
|
2Н2S + 3О2 = 2SО2 + 2Н2О |
|
|
СН4 + 2О2 = СО2 + 2Н2О |
|
Окисление низших оксидов и гидро- |
4FeO + О2 = 2Fe2О3; |
|
ксидов поливалентных металлов и не- |
4Fe(OH)2 + О2 + 2Н2О = 4Fe(OH)3 |
|
металлов |
||
4NO2 + О2 + 2Н2О = 4HNО3 |
||
|
||
Окисление сульфидов металлов |
2CuS + 3O2 = 2CuO + 2SO2; |
|
|
4FeS2 + 11O2 = 2Fe2O3 + 8SO2 |
|
|
|
Озон – сильнейший окислитель, окислительная способность обусловлена нестойкостью его молекул, образованием атомарного кислорода, который активнее молекулы кислорода О2:
O |
O + O |
H |
о |
= –142 кДж |
3 |
2 |
|
298 |
|
Озон окисляет почти все металлы, неметаллы, обесцвечивает красители, убивает микробы. При высоких концентрациях – яд. Молекула имеет угловое строение (sp2-гибридизация):
2p
2s
O
O
О* 








Предполагается, что один из aтомов кислорода находится в возбужденном состоянии, и с ним центральный атом кислора по донор- но-акцепторному механизму образует связь. Две sp2- гибридные орбитали центрального атома кислора образуют σ-связи, а 3-я гибридная орбиталь является несвязывающей и содержит электронную пару. В результате делокализации π-связи образуется 3х-центровая 2хэлектронная связь с концевыми атомами кислорода.
39

Озон существует в нескольких таутомерных формах. Срединному атому кислорода приписывается степень окисления, равная +4, концевым атомам – –2:
Качественная реакция на озон: крахмальная бумага, смоченная раствором KI, синеет в присутствии озона в результате выделения I2:
2KI + O3 + H2O = I2 + O2 + 2KOH
Озон применяют при обработке питьевой воды, так как он не только уничтожает микроорганизмы, но и устраняет неприятный вкус и запах у воды, содержащей пахучие вещества (сероводород, сернистые соединения и т. д.). Озон также используют для обеззараживания сточных вод, содержащих цианиды и фенолы, для уничтожения запаха у жиров и масел, как дезодоратор в системах кондиционирования воздуха.
Ввоздухе, которым мы дышим, объемная доля О3 составляет 10–6 %. Малое содержание озона придает воздуху приятный освежающий запах, повышение содержания озона в воздухе вызывает раздражение дыхательных путей и становится опасным для жизни. Озон ослабляет работу легких.
Всовременной городской атмосфере озон может быть довольно опасным загрязнителем атмосферы, так как озон и оксиды азота относятся к газам, наиболее характерным для фотохимического смога.
Растения также чувствительны к озону, он повреждает растения путем изменения проницаемости клеток для важных ионов, например ионов калия.
Земля окружена слоем озона, располагающегося на высоте 25 км от её поверхности. Он образуется за счёт поглощения кислородом ультрафиолетового излучения Солнца. Озоновый слой ограничивает поток ультрафиолетового излучения, падающего на Землю. Увеличение интенсивности ультрафиолетового излучения, достигающего Землю, могло бы привести к возрастанию заболеваний раком кожи.
Химичесие свойства О3. Озон – сильнейший окислитель, окисляет многие малоактивные металлы (серебро, ртуть) уже при обычных условиях, достаточно энергично реагирует с большим количеством сложных веществ:
2Ag + O3 = Ag2O + O2.
40
