
Ко 2 сессии / Малашонок Неорганическая химия
.pdfУчреждение образования «БЕЛОРУССКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНОЛОГИЧЕСКИЙ УНИВЕРСИТЕТ»
И. Е. Малашонок
НЕОРГАНИЧЕСКАЯ
ХИМИЯ
Тексты лекций для студентов специальностей 1-48 01 02 «Химическая технология органических веществ, материалов и изделий» 1-48 02 02 «Технология лекарственных препаратов»
Минск 2013
УДК 546(075.8) ББК 24.12я73
М 18
Рассмотрены и рекомендованы редакционно-издательским советом университета
Рецензенты:
кандидат технических наук, доцент кафедры химии Белорусского национального технического университета А.А.Меженцев; кандидат химических наук, доцент кафедры общей химии и методики преподавания химии Белорусского государственного университета
В.Н.Хвалюк
Малашонок, И. Е.
М18 Неорганическая химия: тексты лекций для студентов специальностей 1-48 01 02 «Химическая технология органических веществ, материалов и изделий»; 1-48 02 02 «Технология лекарственных препаратов»/ И. Е. Малашонок. – Минск: БГТУ, 2013. –
283 с.
Тексты лекций по дисциплине «Неорганическая химия» предназначены для самостоятельной работы студентов 1-го курса химикотехнологических специальностей при подготовке к практическим, лабораторным занятиям и к экзамену. Достаточно подробно рассмотрены строение, способы получения, физические, химические свойства, биогенная роль простых веществ и их соединений, приведены области их применения. Теоретический материал текстов лекций иллюстрирован примерами, схемами, рисунками.
УДК 54(042.4) ББК 24.12я73-2
©УО «Белорусский государственный технологический университет», 2013
©Малашонок И. Е., 2013
2
ВВЕДЕНИЕ
Тексты лекций предназначены для студентов химикотехнологических специальностей БГТУ и составлены в соответствии с типовой программой по дисциплине «Неорганическая химия». Норганическую химию студенты изучают во втором семестре после дисциплины «Теоретические основы химии». Объем, содержание, уровень изложения материала при составлении предлагаемых текстов лекций определялись тем, что студенты должны знать основные законы и понятия химии, закономерности протекания химических процессов, уметь проводить термодинамические расчеты, расчеты по уравнениям реакций, иметь представление о свойствах химических элементов и их соединений.
В текстах лекций рассматриваются способы получения, особенности строения, физические и химические свойства s-, p- и d-элементов периодической системы Д.И. Менделеева и их соединений. В современной литературе достаточно много учебников по неорганической химии, однако среди них студентам-первокурсникам трудно найти необходимую информацию по тем или иным вопросам. Тексты лекций помогут лучше разобраться в материале, выделить наиболее важную для них информацию.
Студенты специальности 1-48 01 02 «Химическая технология органических веществ, материалов и изделий» должны быть хорошо знакомы с химией элементов, поскольку разнообразные неорганические соединения используются в органическом синтезе и в качестве реагентов, и в качестве катализаторов. Для студентов специальности 1-48 02 02 «Технология лекарственных препаратов» важное значение в их будущей профессиональной деятельности имеют сведения о биогенной роли химических элементов и их соединений. В издании этим вопросам уделено большое внимание. Рассматриваются также вопросы относительно опасности некоторых химических веществ и процессов для организма и окружающей среды.
Тексты лекций по неорганической химии содержат много схем, рисунков, таблиц, которые делают теоретический материал более наглядным, а также призваны помочь студентам понять механизмы протекания процессов, выявить закономерности изменения свойств веществ.
3
ОГЛАВЛЕНИЕ |
|
|
|
|
|
|
Введение.……………………………………………… |
|
|
…… |
……… |
. |
4 |
Тема 1. р - Элементы VII А группы (галогены)……… |
……........... |
5 |
||||
Тема 2. р - Элементы VI А группы (халькогены)............................. |
|
|
|
34 |
||
Тема 3. . р - Элементы V А группы …… |
……… |
.......................... |
|
|
|
70 |
Тема 4. р - Элементы IV А группы …… |
………… |
|
.......…….…... |
|
121 |
|
Тема 5. р - Элементы III А группы …….…………… |
|
|
…….…… |
|
.. |
176 |
Тема 6. s - Элементы II А группы .……………………………… |
|
|
|
|
200 |
|
Тема 7. s - Элементы I А группы. Щелочные металлы………… |
|
|
211 |
|||
Тема 8. Водород ……..…………………………………………… |
|
|
|
|
|
223 |
Тема 9. Общая характеристика d - элементов…………..……… |
|
. |
229 |
|||
Тема 10. d - Элементы VI В группы……………………………... |
236 |
|
|
|
||
Тема 11. d - Элементы VII В группы ………………… |
|
………….... |
|
248 |
||
Тема 12. d - Элементы VIII В группы. Семейство железа……… |
|
257 |
||||
Тема 13. d - Элементы I В группы ………………… |
|
|
……….……. |
270 |
|
|
Литература…..…………………………………………………… |
|
|
|
|
… |
283 |
4
Тема 1. р - ЭЛЕМЕНТЫ VII А ГРУППЫ (ГАЛОГЕНЫ)
Общая характеристика элементов
VIIA группа: F (фтор), Cl (хлор), Br (бром), I (иод) и At (астат - радиоактивный элемент). Групповое название - галогены.
Полные электронные формулы атомов элементов VIIA группа (подчеркнуты валентные электроны):
9F: 1s22s22р5;
17Cl: 1s22s22р63s23р5;
35Br: 1s22s22р63s23р64s24р5;
53I: 1s22s22р63s23р63d104s24р64d105s25р5.
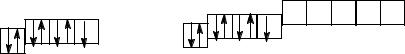
Сокращенная электронная конфигурация … ns2np5. Электронно-графические схемы валентных электронов фтора и хлора
в основном (невозбужденном) состоянии:
F |
|
Cl |
3d |
2s |
2p |
|
3p |
|
|
3s |
На внешнем электронном уровне атомов 7 электронов: три электронные пары и один неспаренный электрон.
У фтора, элемента 2-го периода, нет d-подуровня. Поэтому отсутствует возможность распаривания электронных пар, находящихся на втором уровне. Характерная валентность для фтора = I. Ковалентные связи могут быть образованы как с помощью одноэлектронной орбитали атома, так и с помощью электронных пар. Ковалентность атомов фтора теоретически равна числу электронных орбиталей, который данный атом использует для образования ковалентных связей. Известно молекулярное соединение бора с фтором B ≡ F, в котором ковалентность фтора =3.
Так как фтор – самый электроотрицательный элемент, его степень окисления в соединениях c другими элементами может быть только -1.
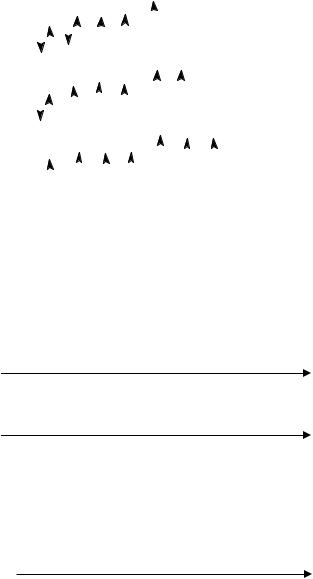
У хлора и других галогенов возможно возбуждение электронов и переход их на d-подуровни соответствующих энергетических уровней. Характерны нечетные валентности: I (в невозбужденном состоянии), III, V, VII (при распаривании электронных пар):
5
|
|
|
|
Cl* |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Валентность III |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3d |
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
3p |
|
|
|
|||||||||||||||||||||||||||
|
|
3s |
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
* |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Валентность V |
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3d |
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
3p |
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
* |
|
|
3s |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Валентность VII |
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3d |
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
3p |
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
3s |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Основные характеристики галогенов представлены в таблицах 1.1, 1.2. |
|||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 1.1 |
||
|
|
Основные характеристики атомов галогенов |
|
|
|
||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
Характеристика |
|
|
F |
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
Br |
|
|
I |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
Ковалентный радиус, нм |
|
0,071 |
|
|
0,099 |
|
|
|
|
|
0,114 |
|
|
0,133 |
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
увеличивается |
|
|
|
|||||||||||||||||
Ионный радиус Э– , нм |
|
0,133 |
|
|
0,181 |
|
|
|
|
|
0,196 |
|
|
0,220 |
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
увеличивается |
|
|
|
|||||||||||||||||
Энергия |
ионизации |
I1, |
1681,05 |
|
|
|
1251,19 |
|
|
|
|
1139,86 |
|
1008,40 |
|||||||||||||||||||||||||||
кДж/моль |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
Сродство к электрону Ее_, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
кДж/моль |
|
|
|
328,166 |
|
348,575 |
|
|
|
|
324,538 |
|
295,149 |
||||||||||||||||||||||||||||
Электроотрицательность |
χ |
4,0 |
|
|
|
3,1 |
|
|
|
|
|
|
|
2,9 |
|
|
2,6 |
||||||||||||||||||||||||
(по шкале Полинга) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
уменьшается |
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
Характерные |
степени |
|
|
|
|
|
|
|
|
|
|
|
–1 , +1, +3, +4, |
|
–1 , +1, +3, |
|
–1 , +1, +3, |
||||||||||||||||||||||||
окисления в соединениях |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
–1 |
|
|
|
+5, +6, +7 |
|
|
+5, +7 |
|
|
+5, +7 |
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
При переходе от фтора к иоду значения радиусов увеличиваются, т.к.
с увеличением числа электронных слоев увеличивается расстояние между электронами внешнего слоя и ядром атома.
Атомы галогенов расположены в периодической системе в конце каждого периода, являются самыми активными неметаллами в периоде, поэтому имеют большие значения энергии ионизации (I1), сродства к электрону (Ее_) и электроотрицательности (χ). Первая энергия сродства к электрону равна значению изменения внутренней энергии при присоединении одного электрона газообразным атомом, взятому с
6
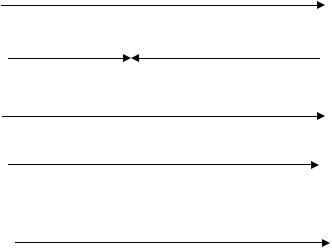
обратным знаком. Положительное значение Ее_ соответствует экзотермическому процессу. Для фтора сродство к электрону меньше, чем для хлора. Это объясняется меньшими размерами атома фтора и большим межэлектронным расталкиванием в нем. При переходе сверху вниз неметаллические свойства галогенов ослабляются.
Наиболее резко увеличивается радиус и уменьшается энергия ионизации при переходе от фтора к хлору. Это связано с появлением на третьем энергетическом уровне d-подуровня.
Все галогены реагируют с металлами непосредственно, образуя соли, ионный характер которых зависит и от галогена, и от металла. Так, фториды металлов, особенно металлов подгрупп IA и IIA, являются ионными соединениями. Степень ионности связи убывает с увеличением атомной массы галогена и уменьшением реакционной способности металла. С неметаллами галогены образуют соединения с ковалентной связью, например галогениды углерода, фосфора, серы.
Наиболее характерная степень окисления галогенов –1, с более электроотрицательными элементами они могут иметь и положительные степени окисления вплоть до высшей +7 (кроме F).
|
|
|
|
|
|
|
Таблица 1.2 |
|
Сравнительная характеристика простых веществ |
|
|||||||
|
|
|
|
|
|
|
|
|
Характеристика |
F2 |
|
|
Cl2 |
|
Br2 |
I2 |
|
Тип связи |
|
|
ковалентная неполярная |
|
||||
Тип кристаллической решетки |
|
|
|
молекулярная |
|
|||
|
|
|
|
|
|
|||
Длина связи в Г2, нм |
0,141 |
|
|
0,199 |
|
0,228 |
0,267 |
|
увеличивается, т.к. увеличивается радиус галогена |
||||||||
|
||||||||
|
|
|
|
|
|
|||
Энергия связи в Г2, кДж/моль |
158,78 |
|
|
242,58 |
|
192,81 |
151,09 |
|
увеличивается от фтора к хлору и от иода к хлору |
||||||||
|
||||||||
|
|
|
|
|
|
|
|
|
Температура плавления, O С |
–219,66 |
|
|
–101,5 |
|
–7,2 |
113,7 |
|
|
|
|
увеличивается |
|
||||
|
|
|
|
|
||||
O |
–188,12 |
|
|
–34,04 |
|
58,8 |
184,4 |
|
Температура кипения, С |
|
|
|
|||||
|
|
|
увеличивается |
|
||||
|
|
|
|
|
||||
Агрегатное состояние |
|
газы |
|
жидкость |
твердое |
|||
|
|
|
||||||
Ео, В (Э2 + 2е– = 2Э– ) |
2,866 |
|
1,358 |
1,066 |
0,536 |
|||
|
окислительные свойства ослабляются |
|||||||
7
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Свойства простых веществ. Галогены – про- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
F |
|
|
|
|
|
|
|
|
|
|
|
|
стые вещества – состоят из двухатомных молекул |
|
|
|
|
|
|
|
2p |
(Г2). В невозбужденном состоянии на внешнем |
|||||||
|
|
|
|
|
|
|
|
|||||||
|
|
2s |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
электронном уровне атомов присутствует по одно- |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
F |
|
|
|
|
|
|
|
|
|
|
|
|
|
му неспаренному электрону. В молекуле фтора оба |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
атома фтора предоставляют для образования кова- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
лентной связи по одному неспаренному электрону |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(обменный механизм образования связи), и эти |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
электроны становятся общими для двух атомов. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Электронная пара, связывающая в молекуле два |
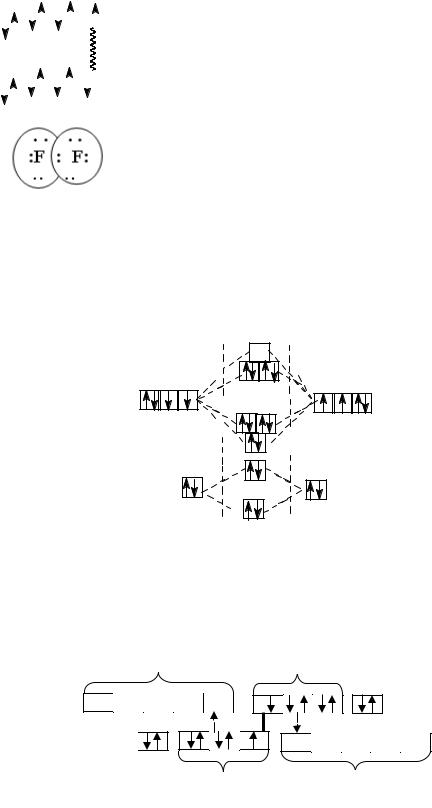
одинаковых атома, в равной мере принадлежит обоим атомам. В молекуле фтора образуется одна ковалентная неполярная связь. В соответствии с методом МО в молекуле фтора порядок связи также =1 (рис. 1.1):
|
МО ( F |
2 |
) |
АО( F ) |
|
АО( F ) |
|
разр. |
|||
|
σ2p |
|
|
|
|
|
|
|
|
|
|
|
πразр2p . |
2p |
π 2свp. |
2p |
|
|
σсв2p. |
2s |
σразр2S . |
2s |
|
|
св. |
Рис. 1.1. Строение молекулы F2 по методу МО
В молекулах Cl2 , Br2 , I2 образуется дополнительная дативная связь, за счёт спаренных p-электронов одного атома и вакантных d- орбиталей другого:
3d |
3p |
|
|
|
3s |
|
Cl |
Cl |
|
3s |
|
3p |
3d |
8
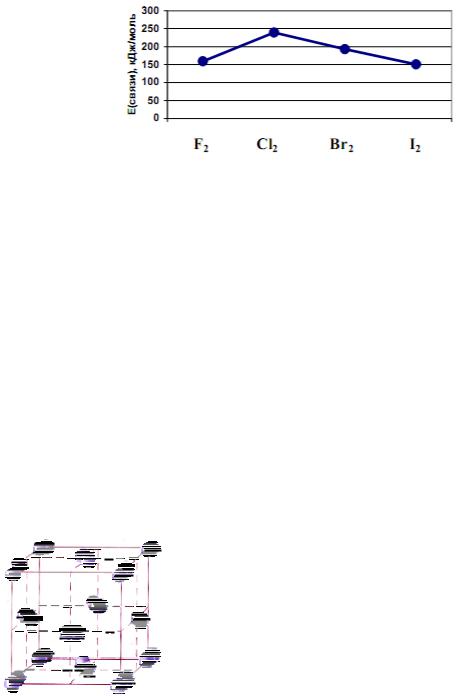
Самой прочной молекулой является молекула Cl2. Уменьшение энергии связи от Cl2 к I2 объясняется увеличением длины связи (рис. 1.2):
Рис. 1.2. Изменение энергии связи в молекулах Г2
Между молекулами галогенов в конденсированном состоянии осуществляется слабое ван-дер-ваальсово взаимодействие, поэтому у простых веществ низкие температуры плавления и кипения. Внешние электронные оболочки атомов фтора и хлора находятся на более коротком расстоянии от ядра, чем внешние электронные оболочки атомов брома и иода. Чем ближе к ядру находится внешняя электронная оболочка, тем она более жесткая и менее склонна к деформации. Молекулы более тяжелых галогенов имеют более рыхлые электронные оболочки, которые в меньшей степени взаимодействуют с ядром. По этой причине между молекулами брома и иода межмолекулярное взаимодействие более сильное, чем между молекулами фтора и хлора. С увеличением размеров атомов возрастает поляризуемость молекул и усиливается способность к межмолекулярному взаимодействию, что приводит к повышению температур плавления и кипения. Для твердого состояния галогенов характерна молекулярная кристаллическая решетка. Например, в узлах кристаллической решетки иода находятся молекулы I2 (рис.1.3):
При обычных условиях F2 – зеленовато-
жёлтый, трудно сжижаемый газ с резким за-
пахом. Фтор крайне токсичен, при попада-
нии в организм человека вызывает отёк лёг-
ких, разрушение зубов, ногтей, ломкость
кровеносных сосудов, повышает хрупкость
костей. Cl2 – газ желто-зеленого цвета, легко
сжижается. Br2 – красно-коричневая густая жидкость со зловонным запахом, ядовит (единственный жидкий при обычных усло-
виях неметалл). I2 – фиолетовые кристаллы. Для человека смертельная доза 2–3 г йода, но в форме иодид-ионов относительно безвреден.
9
Особые свойства фтора. Из всех галогенов у фтора наименьший радиус. Это самый электроотрицательный элемент, во всех соединениях имеет степень окисления –1. Исключительная химическая активность фтора обусловлена с одной стороны большой прочностью образуемых им связей, так, например, энергия связи H - F равна 566 кДж/моль, с другой стороны - низкой энергией связи в молекуле F2 (159 кДж/моль). Большая энергия связей Э – F является следствием значительной электроотрицательности фтора и малого размера его атома.
Низкое значение энергии связи в молекуле F2, объясняется сильным отталкиванием электронных пар, находящихся на р-орбиталях, обусловленным малой длиной связи F – F. Благодаря малой энергии связи молекулы F2 легко диссоциируют на атомы, и энергия активации реакций с участием фтора обычно невелика, поэтому реакции протекают с большой скоростью.
Нахождение в природе. Вследствие высокой химической активности в природе галогены встречаются в виде соединений.
F: CaF2 – плавиковый шпат; Na3[AlF6] – криолит; Ca5(PO4)3F – фто-
рапатит.
Cl: NaCl – поваренная (каменная) соль; KCl·NaCl – сильвинит; KCl·MgCl2·6H2O – карналлит.
Br: в нефтяных скважинах, в морской воде, в виде бромидов (NaBr, KBr, MgBr2) в отложениях хлоридов.
I: в подземных буровых водах, в морских водорослях, KIO3 – в залежах селитры.
Способы получения галогенов
Галогены получают окислением галогенид-ионов, в виде которых они преимущественно находятся в природных соединениях. Фтор характеризуется самым высоким стандартным электродным потенциалом (2,866 В), поэтому окислителем по отношению к иону F– может быть только электрический ток.
В промышленности фтор получают электролизом расплава гидрофторида калия КНF2 или фторида калия в безводной плавиковой кислоте. Фактически электролизу подвергается НF, наличие фторида калия обеспечивает электропроводность расплава. В процессе электролиза температура плавления расплава постепенно повышается из-за увеличения содержания в нем KF. Для восстановления состава электролита его периодически насыщают НF:
10
