
- •Бугрім с.П.
- •§ 1.1. Закони збереження матерії, сталості сполук, Авогадро 8
- •Стехіометричні закони хімії
- •§1.1. Закони збереження матерії, сталості сполук, авогадро, кратних співвідношень, об’ємних відносин
- •1. В одному молі речовини міститься 6, 02 ∙10 23 молекул. Значення 6, 02 ∙ 10 23 моль –1 називають числом Авогадро (na).
- •2. Один моль будь-якого газу за нормальних умов (н.У.) (00с чи 273 k), 1,03 105 Па) займає об’єм 22,4 л.
- •§1.2. Еквівалент. Закон еквівалентних відносин
- •§ 2.1. Теорії з будови атома
- •§ 2.2. Квантові числа
- •§ 2.3. Принципи заповнення атомних орбіталей
- •§ 3.1. Періодичний закон д.І.Менделєєва
- •§ 3.2. Закономірності періодичної системи
- •§ 4.1. Основні поняття хімічної термодинаміки
- •§ 4.2. Перший закон термодинаміки
- •§ 4.3. Закон гесса
- •§ 4.4. Другий закон термодинаміки. Енергія гіббса
- •§ 5.1. Визначення швидкості хімічної реакції
- •§ 5.2. Фактори, що впливають на швидкість хімічної реакції
- •1. Залежність швидкості хімічної реакції від природи реагуючих речовин.
- •4. Залежність швидкості хімічної реакції від температури
- •5. Залежність швидкості хімічної реакції від каталізатору
- •§ 5.3. Хімічна рівновага. Принцип лє-шательє
- •§ 6.1. Характеристика розчинів та способи вираження їхнього складу
- •§6.2.Властивості розбавлених розчинів неелектролітів
- •§ 6.3. Загальні уявлення з теорії електролітичної дисоціації
- •Електроліти (за зарядом йону)
- •§ 6.4. Електролітична дисоціація води. РН розчинів
- •§ 6.5. Гідроліз
- •§ 7.1. Будова комплексних сполук
- •Внутрішня сфера зовнішня сфера
- •Залежність кч від заряду ца
- •1. Кс, що містять ліганди молекулярного типу
- •2. Кс, що містять ліганди йонного типу
- •4. Змішані комплекси
- •§ 7.2. Властивості комплексних сполук
- •§ 8.1. Перебіг окисно-відновних реакцій
- •§ 8.2. Електродний потенціал
- •§ 8.3. Рівняння нернста
- •§ 9.1. Робота гальваничного елементу
- •§ 9.2. Акумулятори. Паливні елементи
- •§ 10.1. Класифікація корозійних процесів
- •§ 10.2. Хімічна та електрохімічна корозія
- •§ 10.3. Захист металів від корозії
- •§ 11.1. Електродні процеси при електролізі
- •§ 11.2. Закони фарадея
- •Методика рішення типових задач з теми “Еквівалент. Закон еквівалентів”
- •Алгоритм розв’язання задач
- •Приклад роз’язання задачі.
- •Методика рішення типових задач з теми: «Хімічна термодинаміка»
- •Алгоритм розв’язання.
- •Приклад розв’язання задачі.
- •Згідно алгоритму:
- •Методика рішення задач з теми «Розчини. Способи визначення концентрації»
- •Алгоритм розв’язання
- •Алгоритм розв’язання задач
- •Приклад розв’язання задачі за алгоритмом
- •Методика рішення задач з теми «Гальванічні елементи»
- •Алгоритм розв’язання задач
- •Приклад розв’язання задачі за алгоритмом
- •Методика рішення задач з теми «Електрохімічна корозія металів»
- •Алгоритм розв’язання задачі
- •Приклад розв’язання задачі
- •Контрольні завдання еквіваленти й еквівалентні маси простих і складних речовин. Закон еквівалентів
- •Будова атому
- •Енергетика хімічних процесів Стандартні теплоти (ентальпії) утворення деяких речовин
- •Хімічна спорідненість Стандартна енергія Гіббса утворення деяких речовин
- •Стандартні абсолютні ентропії деяких речовин
- •Хімічна кінетика та рівновага
- •Способи вираження концентрації розчину
- •Властивості розчинів
- •Іонно-молекулярні (іонні) реакції обміну
- •Окисно-відновні реакції
- •Електродні потенціали й електрорушійні сили Стандартні електродні потенціали (е°) деяких металів (ряд напруг м. М. Бєкєтова)
- •Електроліз
- •Корозія металів
§ 4.1. Основні поняття хімічної термодинаміки
Термодинаміка як наука виникла на початку XIX сторічча у зв'язку із завданням удосконалення теплових машин. У перекладі з грецького «термос» означає тепло, а «динамос» – силу і міць. Класична термодинаміка займається дослідженням енергії і роботи в макроскопічних системах. Цим пояснюється її значення для таких наук, як фізика, хімія, біологія, геологія, для численних галузей техніки, тому що будь-які процеси, що відбуваються в природі, супроводжуються змінами енергії.
Хімічна термодинаміка– це розділ хімії, що вивчає переходи енергії з однієї форми в іншу при хімічних процесах і встановлює напрямок і межі їх самовільного перебігу за даних умов.
Термодинамічна хімічна система– комплекс взаємодіючих між собою речовин, уявно відособлений від навколишнього середовища. Наприклад, системою може бути хімічна склянка, що містить певну кількість води, або теплообмінник, використовуваний на хімічному підприємстві, тощо.
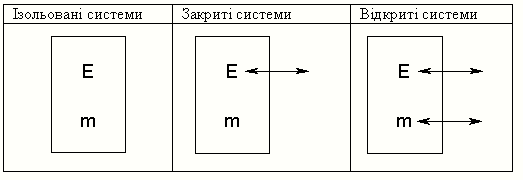
Розрізняють три типи термодинамічних систем (табл.14).
Ізольовані системине можуть обмінюватися з навколишнім середовищем ні енергією, ні масою. Наприклад, ізольований термостат, Всесвіт у цілому.
Закриті системиможуть обмінюватися з навколишнім середовищем тільки енергією, але не масою. Наприклад, сукупність молекул розчиненої речовини можна розглядати як закриту систему, а як зовнішнє середовище може бути все інше (можливо розчинник, якщо він не бере участь у реакції). Тому в хімічній термодинаміці найбільш часто розглядають саме закриті системи.
Відкриті системи– це системи, що можуть обмінюватися з навколишнім середовищем і енергією, і масою. Наприклад, живі об'єкти тваринного чи рослинного світу.
Таблиця 14
Яку б систему ми не розглядали, вона може бути в різних станах. А щоб описати той чи інший стан, використовують термодинамічні характеристики (Рис. 4). Термодинамічні характеристики, котрі визначають стан речовини можна розглядати як основні. Їх називають параметрами стану.Звичайно це температура (Т), тиск (Р) і кількість речовини (n).
Інші термодинамічні характеристики залежать від цих трьох параметрів (Т, Р, n), а значить. у цілому і від стану системи. Тому їх називаютьфункціями стану.
Термодинамічні
характеристики
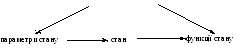
Рис. 4
Термодинамічний процес – це зміна параметрів стану (тобто перехід системи з одного стану в інший). Процеси бувають:
- ізохорними (V=const);
- ізобарними (P=const);
- ізотермічними (T=const);
- адіабатними (немає обміну енергією системи з навколишнім середовищем);
- ізобарно-ізотермічними (P і Т=const);
- ізохорно-ізотермічними (V і T=const).
§ 4.2. Перший закон термодинаміки
Перший закон термодинамікисформульовано Джоулем у середині ХIX сторіччя. За своєю суттю це закон збереження енергії в застосуванні до термодинамічних систем: тепло, передане системі (Q), йде на зміну її внутрішньої енергії (U) і на здійснення роботи (А):Q=U+A
Внутрішня енергія системи, (U) – це сума енергії теплового руху молекул, внутрішньо молекулярної енергії й енергії міжмолекулярної взаємодії. Абсолютне значення цієї величини невідоме, тому оперують лише величинамиU– змінами внутрішньої енергії в процесах. U не залежить від способу переходу системи з одного стану в інший. Внутрішня енергія є функцією стану системи.
Що стосується теплоти (Q) і роботи (А), то це дві єдині форми передачі енергії від системи до зовнішнього середовища і назад. Знаки теплоти і роботи визначаються схемою (Рис.5).
1. Q>0; А>0– якщо система одержує теплоту чи над нею відбувається робота.
2. Q <0; А<0 –якщо система віддає теплоту або сама виробляє роботу.
Відповідний знак ( плюс чи мінус) ставиться не перед буквами Qі А, а перед цифровим значенням відповідної величини, наприклад: Q=-300 кДж;А=+50 кДж.

Рис. 5
У загальному випадку ні робота, ні теплота не є функціями стану.
Перший закон термодинаміки у системі ідеального газу. Ізотермічні процеси йдуть при постійній температурі (T=const).
Для їх здійснення, тобто розширення чи стиснення газу, треба сполучити систему з підведенням чи забиранням теплоти так, щоб температура газу залишалася постійною. Відповідно до вираження енергії для ідеального газу: U=3/2nRT, внутрішня енергія ідеального газу залежить тільки від температури. Тому при постійній температуріU=0, і перший закон термодинаміки набуде такого виду:QT = AT.
Таким чином, при ізотермічному розширенні газу уся теплота, що підводиться ззовні, трансформується в роботу газу, а при його стисненні, теплота що відводиться, дорівнює роботі, чиненої над газом.
Адіабатні процеси– це процеси, за яких виключений теплообмін системи з навколишнім середовищем(Q=0), звідкиA= U. У цих випадках робота стає функцією стану.
Ізохорні процеси (V=const)
Наприклад, нагрівання газу під фіксованим поршнем. Природно, що робота при цьому не відбувається (А=0), звідкиQV = U.
1. Теплота при ізохорних процесах (QV) є функцією стану системи, оскільки такою є рівна їй величинаU.
2. QV =U– це перше математичне вираження закону Гесса (див. далі).
Ізобарні процеси (P=const)
Наприклад, нагрітий газ робить роботу розширення проти постійного зовнішнього тиску. Робота розширення (АР) визначається як добуток тиску (Р) на зміну об’єму(V). АР=РV,звідки:QP=U + PV.
1. Теплота ізобарного процесу (QP) є функцією стану системи, тому що робота проти постійного зовнішнього тиску не залежить від способу здійснення процесу, вона визначається тільки початковим і кінцевим станом системиV. Отже, теплота є функцією стану, якщо в ході ізобарного процесу не відбувається ніякої іншої роботи, як проти постійного зовнішнього тиску.
Позначимо суму (U2 + PV2) через величинуН2, а(U1 + PV1) = H1, тодіQP= H2- H1= H. Таким чином, у термодинаміку введена нова величинаН- ентальпія. Особливість ентальпії полягає в тому, що вона є функцією стану. Отже,H= H2 - H1, у всіх процесах (як іU) залежить тільки від початкового (Н1) і кінцевого (Н2) станів.
2. Вираження QP = H– це друге математичне вираження закону Гесса (див. далі).
QP = U2 – U1 + P (V2 – V1) = (U2 +PV2) – (U1 + PV1) = Н2 – Н1 =H.
За умов V=О,що найбільш характерно для хімічних реакцій. Для екзотермічних реакцій QР 0система віддає тепло в навколишнє середовище, виходить, її внутрішня енергія зменшуєтьсяН 0.Для ендотермічних реакцій QР 0 H 0.
Термохімія – це розділ термодинаміки, що вивчає теплові ефекти хімічних реакцій.
