
- •Бугрім с.П.
- •§ 1.1. Закони збереження матерії, сталості сполук, Авогадро 8
- •Стехіометричні закони хімії
- •§1.1. Закони збереження матерії, сталості сполук, авогадро, кратних співвідношень, об’ємних відносин
- •1. В одному молі речовини міститься 6, 02 ∙10 23 молекул. Значення 6, 02 ∙ 10 23 моль –1 називають числом Авогадро (na).
- •2. Один моль будь-якого газу за нормальних умов (н.У.) (00с чи 273 k), 1,03 105 Па) займає об’єм 22,4 л.
- •§1.2. Еквівалент. Закон еквівалентних відносин
- •§ 2.1. Теорії з будови атома
- •§ 2.2. Квантові числа
- •§ 2.3. Принципи заповнення атомних орбіталей
- •§ 3.1. Періодичний закон д.І.Менделєєва
- •§ 3.2. Закономірності періодичної системи
- •§ 4.1. Основні поняття хімічної термодинаміки
- •§ 4.2. Перший закон термодинаміки
- •§ 4.3. Закон гесса
- •§ 4.4. Другий закон термодинаміки. Енергія гіббса
- •§ 5.1. Визначення швидкості хімічної реакції
- •§ 5.2. Фактори, що впливають на швидкість хімічної реакції
- •1. Залежність швидкості хімічної реакції від природи реагуючих речовин.
- •4. Залежність швидкості хімічної реакції від температури
- •5. Залежність швидкості хімічної реакції від каталізатору
- •§ 5.3. Хімічна рівновага. Принцип лє-шательє
- •§ 6.1. Характеристика розчинів та способи вираження їхнього складу
- •§6.2.Властивості розбавлених розчинів неелектролітів
- •§ 6.3. Загальні уявлення з теорії електролітичної дисоціації
- •Електроліти (за зарядом йону)
- •§ 6.4. Електролітична дисоціація води. РН розчинів
- •§ 6.5. Гідроліз
- •§ 7.1. Будова комплексних сполук
- •Внутрішня сфера зовнішня сфера
- •Залежність кч від заряду ца
- •1. Кс, що містять ліганди молекулярного типу
- •2. Кс, що містять ліганди йонного типу
- •4. Змішані комплекси
- •§ 7.2. Властивості комплексних сполук
- •§ 8.1. Перебіг окисно-відновних реакцій
- •§ 8.2. Електродний потенціал
- •§ 8.3. Рівняння нернста
- •§ 9.1. Робота гальваничного елементу
- •§ 9.2. Акумулятори. Паливні елементи
- •§ 10.1. Класифікація корозійних процесів
- •§ 10.2. Хімічна та електрохімічна корозія
- •§ 10.3. Захист металів від корозії
- •§ 11.1. Електродні процеси при електролізі
- •§ 11.2. Закони фарадея
- •Методика рішення типових задач з теми “Еквівалент. Закон еквівалентів”
- •Алгоритм розв’язання задач
- •Приклад роз’язання задачі.
- •Методика рішення типових задач з теми: «Хімічна термодинаміка»
- •Алгоритм розв’язання.
- •Приклад розв’язання задачі.
- •Згідно алгоритму:
- •Методика рішення задач з теми «Розчини. Способи визначення концентрації»
- •Алгоритм розв’язання
- •Алгоритм розв’язання задач
- •Приклад розв’язання задачі за алгоритмом
- •Методика рішення задач з теми «Гальванічні елементи»
- •Алгоритм розв’язання задач
- •Приклад розв’язання задачі за алгоритмом
- •Методика рішення задач з теми «Електрохімічна корозія металів»
- •Алгоритм розв’язання задачі
- •Приклад розв’язання задачі
- •Контрольні завдання еквіваленти й еквівалентні маси простих і складних речовин. Закон еквівалентів
- •Будова атому
- •Енергетика хімічних процесів Стандартні теплоти (ентальпії) утворення деяких речовин
- •Хімічна спорідненість Стандартна енергія Гіббса утворення деяких речовин
- •Стандартні абсолютні ентропії деяких речовин
- •Хімічна кінетика та рівновага
- •Способи вираження концентрації розчину
- •Властивості розчинів
- •Іонно-молекулярні (іонні) реакції обміну
- •Окисно-відновні реакції
- •Електродні потенціали й електрорушійні сили Стандартні електродні потенціали (е°) деяких металів (ряд напруг м. М. Бєкєтова)
- •Електроліз
- •Корозія металів
§ 2.1. Теорії з будови атома
Наукові основи атомно-молекулярного вчення були закладені в роботах російського вченого М.В.Ломоносова, французьких хіміків Лавуазьє і Пруста, англійського хіміка Дальтона і т.д. Однак до початку двадцятого століття атом вважався єдиним і неподільним. Лише тільки серія відкриттів 1896 – 1898 р. природної радіоактивності Анрі Беккерелем (1896 р. – радіоактивність урану), Марією Склодовською-Кюрі і Пьєром Кюрі дозволила змінити уявлення про неподільність атома.
Атом– це
електронейтральна мікросистема, що
складається з позитивно зарядженого
ядра і негативно заряджених електронів.
Ядра атомів складаються з нуклонів:
(протонів (![]() ) і нейтронів (
) і нейтронів (![]() )),
основні характеристики яких подано в
табл.1.
)),
основні характеристики яких подано в
табл.1.
Маса ядра менша за суму мас протонів і нейтронів. Ця різниця називається дефектом маси. Він характеризує стійкість атомних ядер і енергію зв'язку нуклонів у ядрі (7.106еВ), що у мільйони разів перевищує енергію зв'язку атомів у молекулі (5 еВ). Тому за хімічних реакцій ядра атомів не змінюються.
Таблиця 1
|
|
Система СІ |
Система атомних одиниць | |||
|
Найменування частинки |
Абсолютна маса, кг |
Електричний заряд, Кл |
Відносна маса, а.о.м. |
Відносний заряд, а.о.з. | |
|
Електрон
|
9,109•10-31 |
1,602•10-19 |
0,0005486 |
-1 | |
|
Нук- Лони |
Протон
|
1,673•10-27 |
1,602•10-19 |
1,007277 |
+1 |
|
Нейтрон
|
1,673•10-27 |
0 |
1,008695 |
0 | |
Сукупність атомів з однаковим зарядом ядра, з певною атомною масою, називається хімічним елементом.
Кожен хімічний елемент має кілька ізотопів.
Атоми з однаковим зарядом ядра, але різними масовими числами називають ізотопами.
Крім ізотопів існують ізотони й ізобари.
Ізотони– це
атоми з однаковим числом нейтронів![]() ,
але різною
,
але різною
кількістю
![]() (тобто з різним зарядом ядра).
(тобто з різним зарядом ядра).
![]() (
(![]() =140).
=140).
Таблиця 2
|
Ізотопи гідрогену |
Назва ізотопу |
|
|
Масове число (А) |
|
|
1
1
1 |
0
1
2 |
1
2
3 | |
|
Ізотопи карбону |
|
6
6
6 |
6
7
8 |
12
13
14 |
Ізобари– це атоми з однаковими масовими числами, але різними атомними номерами, наприклад:
![]() .
.
У період відкриття
перших трьох фундаментальних частинок
(е;
![]() ;
;
![]() )
був висунутий цілий ряд моделей будови
атома.
)
був висунутий цілий ряд моделей будови
атома.
1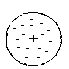 .
1903 р. Модель Д.Томсона, В. Томсона (модель
«пудінгу з родзинками»), відповідно до
якої в позитивно заряджену сферу атома
вкраплені електрони:
.
1903 р. Модель Д.Томсона, В. Томсона (модель
«пудінгу з родзинками»), відповідно до
якої в позитивно заряджену сферу атома
вкраплені електрони:
Рис. 1
2. 1911 р. Е. Резерфорд у результаті знаменитих експериментів з розсіювання золотою фольгою α - частинок установив, що атом:
- має досить масивне позитивно заряджене ядро з дуже малими розмірами, оточене електронами;
- атом електронейтральний, тобто позитивний заряд ядра чисельно дорівнює негативному сумарному заряду електронів, що оточують це ядро;
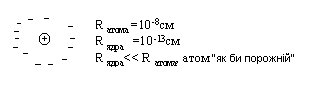
Рис. 2
Відповідно до законів класичної механіки і електродинаміки, імовірність знаходження електрона навколо ядра повинна супроводжуватися електромагнітним випромінюванням з безупинним спектром, що суперечило відомим з 1880 р. лінійчатим спектрам газів і пару елементів. Протиріччя розв’язав учень Резерфорда Нільс Бор.
3. У 1913 р. Н. Бор розробив планетарну модель атома Гідрогена, що використовується і у наш час. Подібно Резерфорду, Бор уявляв собі атом у вигляді позитивно зарядженого ядра, оточеного електронами. Він розрахував радіуси можливих орбіт для атома Гідрогена (R1=53пм,R2=212пм,R3=477пм,R4=848пм). Цим орбітам відповідають різні енергії. Переходячи з однієї орбіти на іншу, електрони можуть здобувати або втрачати енергію. Н. Бору вдалося пояснити і розрахувати теоретично лінійчаті спектри випромінювання атомів гідрогену, а також серії ліній у рентгенівських спектрах елементів.
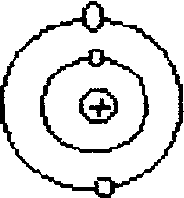
Рис. 3
4. У 1924 р. Луі де Бройль показав, що елементарна частинка, яка рухається з визначеною швидкістю, може розглядатися не тільки як частинка, що володіє масою спокою, але і як хвиля з визначеною частотою коливань (), задовольняючи умові рівності енергій:
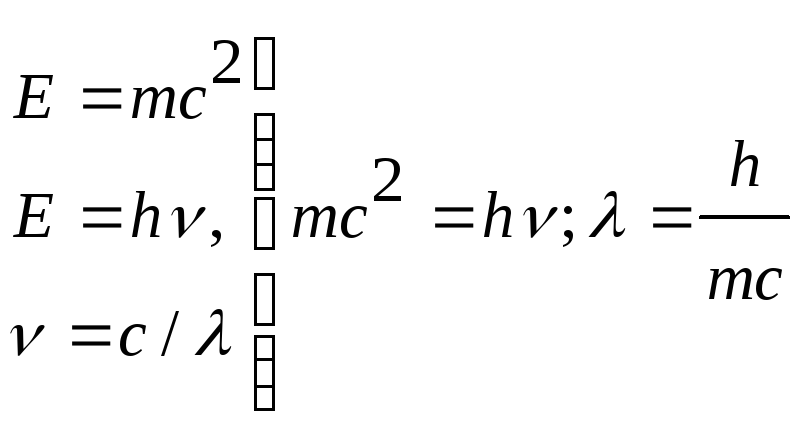 ,
,
де h=6,626 . 10 –34 Дж. с (постійна Планка);
с=3.10 8 м/с (швидкість світла);
λ=h/mc (взаємозв'язок довжини хвилі (λ) і маси частинки (m)).
Результатом робіт де Бройля, Дірака, Гейзенберга, Шредінгера та інших було створення нової фізичної теорії – КВАНТОВОЇ МЕХАНІКИ, яка заявила про корпускулярно-хвильовий дуалізм мікрочастинок (наприклад, електрон має масу спокою 9,109• 10-31кг., виявляючи властивості частинки, а в досвідах по дифракції він виявляє властивості хвилі). У квантовій механіці класичне поняття «траєкторія» заміняється поняттям «хвильова функціяψ» чи «атомна орбіталь (АО)».
