
- •Бугрім с.П.
- •§ 1.1. Закони збереження матерії, сталості сполук, Авогадро 8
- •Стехіометричні закони хімії
- •§1.1. Закони збереження матерії, сталості сполук, авогадро, кратних співвідношень, об’ємних відносин
- •1. В одному молі речовини міститься 6, 02 ∙10 23 молекул. Значення 6, 02 ∙ 10 23 моль –1 називають числом Авогадро (na).
- •2. Один моль будь-якого газу за нормальних умов (н.У.) (00с чи 273 k), 1,03 105 Па) займає об’єм 22,4 л.
- •§1.2. Еквівалент. Закон еквівалентних відносин
- •§ 2.1. Теорії з будови атома
- •§ 2.2. Квантові числа
- •§ 2.3. Принципи заповнення атомних орбіталей
- •§ 3.1. Періодичний закон д.І.Менделєєва
- •§ 3.2. Закономірності періодичної системи
- •§ 4.1. Основні поняття хімічної термодинаміки
- •§ 4.2. Перший закон термодинаміки
- •§ 4.3. Закон гесса
- •§ 4.4. Другий закон термодинаміки. Енергія гіббса
- •§ 5.1. Визначення швидкості хімічної реакції
- •§ 5.2. Фактори, що впливають на швидкість хімічної реакції
- •1. Залежність швидкості хімічної реакції від природи реагуючих речовин.
- •4. Залежність швидкості хімічної реакції від температури
- •5. Залежність швидкості хімічної реакції від каталізатору
- •§ 5.3. Хімічна рівновага. Принцип лє-шательє
- •§ 6.1. Характеристика розчинів та способи вираження їхнього складу
- •§6.2.Властивості розбавлених розчинів неелектролітів
- •§ 6.3. Загальні уявлення з теорії електролітичної дисоціації
- •Електроліти (за зарядом йону)
- •§ 6.4. Електролітична дисоціація води. РН розчинів
- •§ 6.5. Гідроліз
- •§ 7.1. Будова комплексних сполук
- •Внутрішня сфера зовнішня сфера
- •Залежність кч від заряду ца
- •1. Кс, що містять ліганди молекулярного типу
- •2. Кс, що містять ліганди йонного типу
- •4. Змішані комплекси
- •§ 7.2. Властивості комплексних сполук
- •§ 8.1. Перебіг окисно-відновних реакцій
- •§ 8.2. Електродний потенціал
- •§ 8.3. Рівняння нернста
- •§ 9.1. Робота гальваничного елементу
- •§ 9.2. Акумулятори. Паливні елементи
- •§ 10.1. Класифікація корозійних процесів
- •§ 10.2. Хімічна та електрохімічна корозія
- •§ 10.3. Захист металів від корозії
- •§ 11.1. Електродні процеси при електролізі
- •§ 11.2. Закони фарадея
- •Методика рішення типових задач з теми “Еквівалент. Закон еквівалентів”
- •Алгоритм розв’язання задач
- •Приклад роз’язання задачі.
- •Методика рішення типових задач з теми: «Хімічна термодинаміка»
- •Алгоритм розв’язання.
- •Приклад розв’язання задачі.
- •Згідно алгоритму:
- •Методика рішення задач з теми «Розчини. Способи визначення концентрації»
- •Алгоритм розв’язання
- •Алгоритм розв’язання задач
- •Приклад розв’язання задачі за алгоритмом
- •Методика рішення задач з теми «Гальванічні елементи»
- •Алгоритм розв’язання задач
- •Приклад розв’язання задачі за алгоритмом
- •Методика рішення задач з теми «Електрохімічна корозія металів»
- •Алгоритм розв’язання задачі
- •Приклад розв’язання задачі
- •Контрольні завдання еквіваленти й еквівалентні маси простих і складних речовин. Закон еквівалентів
- •Будова атому
- •Енергетика хімічних процесів Стандартні теплоти (ентальпії) утворення деяких речовин
- •Хімічна спорідненість Стандартна енергія Гіббса утворення деяких речовин
- •Стандартні абсолютні ентропії деяких речовин
- •Хімічна кінетика та рівновага
- •Способи вираження концентрації розчину
- •Властивості розчинів
- •Іонно-молекулярні (іонні) реакції обміну
- •Окисно-відновні реакції
- •Електродні потенціали й електрорушійні сили Стандартні електродні потенціали (е°) деяких металів (ряд напруг м. М. Бєкєтова)
- •Електроліз
- •Корозія металів
1. В одному молі речовини міститься 6, 02 ∙10 23 молекул. Значення 6, 02 ∙ 10 23 моль –1 називають числом Авогадро (na).
2. Один моль будь-якого газу за нормальних умов (н.У.) (00с чи 273 k), 1,03 105 Па) займає об’єм 22,4 л.
Наприклад,1 мольО2(Мr(О2)=32г/моль) містить 6,02•1023 молекул кисню, він займає об’єм 22,4 л. Один мольН2(Мr(Н2)=2г/моль) містить 6,02• 1023молекул водню, він займає об’єм 22,4 л.
Задача. Який об’єм водню виділиться при травленні 3,25 г Zn хлоридною кислотою?
Розв’язок.
Для розв’язання задачі записуємо рівняння реакції:
Zn + 2HCl → ZnCl2 + H2
65 22,4,
де 65г/моль – молярна маса Цинку;
22,4л – молярний об’єм водню.
При травленні 65 г Цинку виділиться 22,4 л водню, а при травленні 32,5 г Цинку виділиться Хл водню. Знайдемо об’єм водню, що виділився за н.у.
![]() )
= X
=
)
= X
=
![]() .
.
Закон кратних співвідношень (Дж. Дальтон, 1803):
якщо два елементи утворюють один з одним кілька сполук молекулярної будови, то на одну й ту саму кількість одного з них припадають такі кількості іншого, які відносяться між собою як невеликі цілі числа.
Наприклад, у сполуках Нітрогену N2O, NO, N2O3, NO2, N2O5співвідношення між масовими частками Оксигену, які припадають на одну масову частку Нітрогену відносяться між собою як числа 0,57: 1,14: 1,71: 2,29: 2,85, тобто як невеликі цілі числа 1:2:3:4:5.
Проте цей закон не є загальним. Він має свої обмеження. Для сполук з молекулярною структурою він взагалі витримується, а для сполук з немолекулярною структурою масові кількості елементів в сполуці можуть відноситись як дробові числа. Сполуки із сталим складом називаються дальтонідами ( на честь Дж. Дальтона), а із змінним складом – бертолідами (на честь К. Бертолле).
Закон об’ємних відносин (Ж. Гей-Люсак, 1805):
за однакових фізичних умов (Р, Т) об’єми газуватих речовин, вступаючих у реакцію, відносяться між собою, а також к об’ємам газуватих продуктів реакції, як невеликі цілі числа (коефіцієнти хімічного рівнення).
2Н2(Г) + О2(Г) → 2Н2О(Г)
З двома об’ємами Н2реагує один об’ємО2і утворюється два об’єма водяного пару.
§1.2. Еквівалент. Закон еквівалентних відносин
У результаті робіт німецького хіміка Ріхтера, англійських вчених Дальтона і Волластона (1792 – 1800 рр.) були встановлені так звані “сполучені ваги” або еквіваленти реагуючих речовин.
Хімічним еквівалентом речовини називається така її кількість, яка взаємодіє без залишку з одним молем атомів Гідрогену або заміщує таку ж кількість атомів Гідрогену в хімічних реакціях.
Наприклад, у сполуках НС1, H2О, NH3еквіваленти Хлору, Оксигену, Нітрогену відповідно дорівнюють: 1 моль, 1/2 моль, 1/3 моль. За одиницю еквівалента прийнятий еквівалент водню (Е(Н)=1 моль атомів Гідрогену). Еквівалент виражають у молях. Крім поняття „еквівалент” користуються поняттям „молярна маса еквівалента”.
Молярна маса еквівалента – це маса одного хімічного еквівалента речовини, яка виражається у г/моль. МЕ (Н) = 1 г/моль; МЕ (N) = 14∙ 1/3 = 4,67 г/моль; МЕ (Cl) = 35,45 г/моль; МЕ (S) = 32∙ 1/2 = 16 г/моль.
Молярна маса еквівалента елемента дорівнює співвідношенню молярної маси елемента (М) до його валентності (В).
![]() (1)
(1)
Наприклад,
S+4O2 , валентність Сульфуру дорівнює IV; MЕ (S+4) = M(S)/B = 32/4 = 8 г/моль;
S+6O3, валентність сульфуру дорівнює VI; MЕ (S+6) = M(S)/B = 32/6 = 5,3 г/моль.
Для газуватих речовин зручно користуватися молярним об’ємом еквівалента.
Молярний об’єм еквівалента (VЕ)– це об’єм, займаний одним хімічним еквівалентом газуватої речовини за нормальних умов. Молярна маса еквівалента водню складає 1/2 його моля (M(H2)=2г/моль). Молярний об’єм водню дорівнює 22,4 л (н.у.), тоді молярний об’єм еквіваленту водню дорівнює 11,2л/моль. Молярна маса еквівалента кисню складає 1/4 його моля, (M(О2)= 32г/моль). Молярний об’єм кисню складає 22,4л/моль(н.у.), тоді молярний об’єм еквіваленту кисню дорівнює 5,6л/моль.
Молярні маси еквівалентів складних речовин можна визначати.
Для оксиду:
1-й
засіб:МЕ(Al2O3)=![]() ,
(2)
,
(2)
де n– число атомів елемента в молекулі;
В– його валентність.МЕ (Al2O3)=102/2∙ 3 = 17 г/моль.
2-й
засіб:МЕ(Al2O3)=МЕ(O![]() )
+ МЕ(Al+3)=16/2 +
27/3 =17г/моль (3)
)
+ МЕ(Al+3)=16/2 +
27/3 =17г/моль (3)
Для основи:
1-й
засіб:МЕ (Са(ОН)2
)=![]() (4)
(4)
де
кислотність основи – це число (ОН![]() )-груп
у молекулі основи, що вступили в реакцію.
)-груп
у молекулі основи, що вступили в реакцію.
2-й
засіб:МЕ(Са(ОН)2)=МЕ(Са2+)+МЕ(ОН![]() )=40/2+17=
37г/моль (5)
)=40/2+17=
37г/моль (5)
Для кислоти:
1-й
засіб:МЕ (H3PO4)
=![]() (6)
(6)
де основність
кислоти – це число катіонів Н+у молекулі кислоти, що вступили в
реакцію.![]()
2-й засіб:
МЕ
(Н3РО4)
= МЕ
(Н+)
+ МЕ
(РО4![]() )
= 1+ 95/3 = 1+ 31,6 = 32,6 г/моль.
(7)
)
= 1+ 95/3 = 1+ 31,6 = 32,6 г/моль.
(7)
Для солі:
1 засіб:
МЕ (Са3(РО4)2
)=![]() (8)
(8)
МЕ
(Nа
HCO3)
=![]()
МЕ
(A1
(OH)C12)
=
![]() ,
,
де В – валентність металу або заряд катіона для основної солі.
n – число атомів металу в молекулі солі.
2-й засіб:
МЕ
(Са3(РО4)2
)
= МЕ
(Са+2)
+ МЕ
(РО4![]() )
= 40/2 + 95/3 = 51,7 г/моль; (9)
)
= 40/2 + 95/3 = 51,7 г/моль; (9)
МЕ(NaHCO3)
= МЕ
(Na+)
+ МЕ
(HCO3![]() )
= 23 + 61 = 84 г/моль;
)
= 23 + 61 = 84 г/моль;
МЕ
(А1ОНС12)
= МЕ
(А1ОН2+)
+ МЕ
(С1![]() )
= 44/2 + 35,5 = 57,5г/моль.
)
= 44/2 + 35,5 = 57,5г/моль.
Визначення молярної маси еквівалентів складних речовин за рівняннями хімічних реакцій.
Для кислот:
а) H3PO4 + 2NaOH = Na2HPO4 + 2H2O;
б) H3PO4 + 3NaOH = Na3PO4 + 3H2O.
У реакції «а» заміщено два йони гідрогену кислоти, а в реакції «б» – три. Отже, основність кислоти в першому випадку дорівнює двом, а в другому випадку – трьом:
а) МЕ
(Н3РО4)
=
![]() ;
;
б) МЕ
(Н3РО4)
=
![]() .
.
Для основ:
а) А1 (ОН)3 + НС1 → А1(ОН)2С1 + Н2О, кислотність основи дорівнює 1;
б) А1(ОН)3 + 2НС1 → А1ОНС12 + 2Н2О, кислотність основи дорівнює 2;
а)
МЕ
(А1(ОН)3)
=
![]() ;
;
б) МЕ
(А1(ОН)3)
=
![]() =78/2
= 39 г/моль.
=78/2
= 39 г/моль.
Визначення молярної маси еквівалентів речовин за рівняннями окисно-відновних реакцій:
2KMnО4 + 5SnCl2 + 16HCl = 5SnCl4 + 2MnCl2 + 2KCl + 8H2O
в
 ідновникSn+2
- 2ē → Sn+4 5 окиснюється
ідновникSn+2
- 2ē → Sn+4 5 окиснюється
10
окисник Mn+7 + 5ē → Mn+2 2 відновлюється.
Молярна маса еквівалента окисника дорівнює співвідношенню молярної маси окисника (M(KMnО4))до кількості прийнятих електронів.
МЕ(KMnО4)
=
![]() .
(10)
.
(10)
Молярна маса еквівалента відновника дорівнює співвідношенню молярної маси відновника (M(SnCl2))до кількості відданих електронів.
МЕ
(SnCl2)
=
![]() .
(11)
.
(11)
Закон еквівалентних співвідносин:
маси реагуючих речовин: m(A)іm(B)співвідносяться між собою як молярні маси їх еквівалентів:МЕ (А)іМЕ (В).
Математичні вирази цього закону:
![]()
Розглянемо приклади розв’язання задач
Задача 1.Враховуючи молярну масу еквівалента металу в оксиді, що містить 52% металу. Назвіть цей метал (Ме), якщо його валентність становить шість у даному оксиді. Складіть формулу оксиду.
Розв’язок:100 – 52 = 48% Оксигену в оксиді, а молярна маса еквіваленту Оксигену дорівнює 8г/моль.
За законом еквівалентних відносин (за формулою (12)) записуємо вираз:
![]() ;
;
За формулою (1) М (Me) = MЕ (Ме)∙ В = 8,66∙ 6 = 52 г/моль.
Шестивалентним металом з атомною масою 52 а.о.м. є Хром. Його оксид – CrО3.
Задача 2.На відновлення 7,09 г оксиду металу потрібно 2,24 л водню (н.у.). Знайти молярну масу еквівалента металу і його оксиду.
Розв’язок: на підставі закону еквівалентних відносин записуємо вираз:
![]()
За формулою (3) MЕ (Ме xОy) = MЕ (Ме) +MЕ (О); (МЕ (О)=8 г/моль), тоді MЕ (Ме) = 35,45 – 8 = 27,45 г/моль.
Задача 3.З 3,85 г нітрату металу Me(NO3)xотримано 1,60 г його гідроксидуMe(OH)x. Знайти еквівалентну масу металу.
Розв’язок:на підставі закону еквівалентних відносин (за формулою (12)) записуємо вираз.

![]()
![]()
Задача 4.При взаємодії 3,24 г тривалентного металу з кислотою виділяється 4,03 лН2 (н.у.). Обчисліть молярну масу еквівалента і молярну масу металу. Назвіть метал.
Розв’язок: використовуючи закон еквівалентних відносин (за формулою (12)), запишемо вираз:
![]() .
.
За формулою (1)
![]() .
.
Метал – Aлюміній.
Знання закону еквівалентних відносин необхідне для:
1. Хімічних розрахунків та ідентифікації речовин.
2. Визначення молярної концентрації еквівалентів речовини в розчині і використання отриманих розрахунків в об'ємному аналізі.
Молярна концентрація еквівалентів речовини (нормальність) показує, скільки молярних мас еквівалентів речовини міститься в 1 л розчину.
СН
= N =
![]() моль/л
(н).
моль/л
(н).
Наприклад:
1 н розчин НС1→ у 1 л розчину містить 1 молярну масу еквівалентаМЕ(HCl) = 36,5г/моль, тобто 36,5 г.
0,1 н розчин НС1→ у 1 л розчину містить 0,1 молярної маси еквівалентаHCl- 3,65г/моль.
0,01 н розчин НС1→ у 1 л розчину містить 0,01 молярної маси еквівалентаHCl - 0,365 г/моль.
Задача 5.Визначити нормальність розчинуNaOH,якщо на титрування 10 моль його витрачається 8,2 моль 0,1 н розчинуНС1.
Розв’язок:Використовуючи математичний вираз закону еквівалентних відносин в об'ємному аналізі:N1∙V1 = N2∙V2,записуємо вираз:
N(NaOH) ∙V(NaOH)= N(HCl)∙ V(HCl)
N(NaOH)=![]() .
.
Відповідь: розчин NaOH 0,082 – нормальний, тобто містить 0,082 молярної маси еквівалентаNaOHна один літр розчину (моль/л).
3.Визначення твердості води.
Твердість води Т(Н2О)показує кількість міліеквівалентів (ме) розчинних солей кальцію і магнію, що містяться в одному літрі води (ме/л).
![]()
Задача 6.Чому дорівнює твердість води, у 100 л якої міститься 14,63 гMg (HCO3)2?
Розв’язок: для рішення задачі використовуємо формулу для визначення твердісті води:
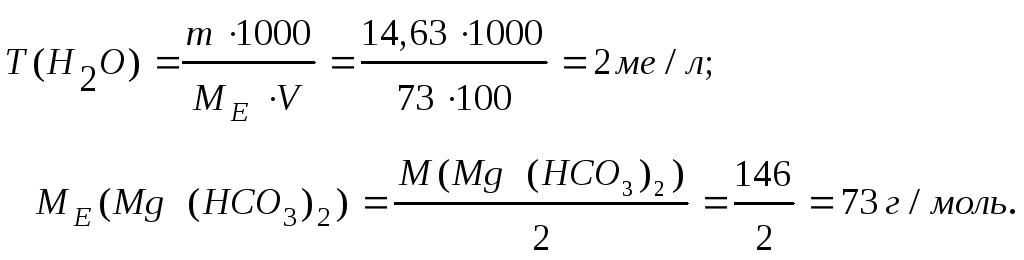
4. Для розрахунків в електрохімії:
![]()
де m – маса речовини (г),
V – об’єм речовини (л);
I – сила струму, А;
t– час, с.
F = 96500 Кл/моль (F = 26,8 А∙ год./моль) (Кл = Кулон) ;
Q – кількість електрики (А. с; А. год.).
Питання для самоконтролю
1.Що є сталим в хімічних реакціях та які закони це відображують?
2.Сформулюйте закон Авогадро. Які висновки із закону Авогадро?
3. Що таке еквівалент?
4.Які існують форми математичного виразу закону еквівалентних відносин?
5. Де застосовують закон еквівалентних відносин?
Р о з д і л 2
КВАНТОВОМЕХАНІЧНЕ УЯВЛЕННЯ ПРО БУДОВУ АТОМА. ПРАВИЛА І ПОРЯДОК ЗАПОВНЕННЯ АТОМНИХ ОРБІТАЛЕЙ
