
- •Бугрім с.П.
- •§ 1.1. Закони збереження матерії, сталості сполук, Авогадро 8
- •Стехіометричні закони хімії
- •§1.1. Закони збереження матерії, сталості сполук, авогадро, кратних співвідношень, об’ємних відносин
- •1. В одному молі речовини міститься 6, 02 ∙10 23 молекул. Значення 6, 02 ∙ 10 23 моль –1 називають числом Авогадро (na).
- •2. Один моль будь-якого газу за нормальних умов (н.У.) (00с чи 273 k), 1,03 105 Па) займає об’єм 22,4 л.
- •§1.2. Еквівалент. Закон еквівалентних відносин
- •§ 2.1. Теорії з будови атома
- •§ 2.2. Квантові числа
- •§ 2.3. Принципи заповнення атомних орбіталей
- •§ 3.1. Періодичний закон д.І.Менделєєва
- •§ 3.2. Закономірності періодичної системи
- •§ 4.1. Основні поняття хімічної термодинаміки
- •§ 4.2. Перший закон термодинаміки
- •§ 4.3. Закон гесса
- •§ 4.4. Другий закон термодинаміки. Енергія гіббса
- •§ 5.1. Визначення швидкості хімічної реакції
- •§ 5.2. Фактори, що впливають на швидкість хімічної реакції
- •1. Залежність швидкості хімічної реакції від природи реагуючих речовин.
- •4. Залежність швидкості хімічної реакції від температури
- •5. Залежність швидкості хімічної реакції від каталізатору
- •§ 5.3. Хімічна рівновага. Принцип лє-шательє
- •§ 6.1. Характеристика розчинів та способи вираження їхнього складу
- •§6.2.Властивості розбавлених розчинів неелектролітів
- •§ 6.3. Загальні уявлення з теорії електролітичної дисоціації
- •Електроліти (за зарядом йону)
- •§ 6.4. Електролітична дисоціація води. РН розчинів
- •§ 6.5. Гідроліз
- •§ 7.1. Будова комплексних сполук
- •Внутрішня сфера зовнішня сфера
- •Залежність кч від заряду ца
- •1. Кс, що містять ліганди молекулярного типу
- •2. Кс, що містять ліганди йонного типу
- •4. Змішані комплекси
- •§ 7.2. Властивості комплексних сполук
- •§ 8.1. Перебіг окисно-відновних реакцій
- •§ 8.2. Електродний потенціал
- •§ 8.3. Рівняння нернста
- •§ 9.1. Робота гальваничного елементу
- •§ 9.2. Акумулятори. Паливні елементи
- •§ 10.1. Класифікація корозійних процесів
- •§ 10.2. Хімічна та електрохімічна корозія
- •§ 10.3. Захист металів від корозії
- •§ 11.1. Електродні процеси при електролізі
- •§ 11.2. Закони фарадея
- •Методика рішення типових задач з теми “Еквівалент. Закон еквівалентів”
- •Алгоритм розв’язання задач
- •Приклад роз’язання задачі.
- •Методика рішення типових задач з теми: «Хімічна термодинаміка»
- •Алгоритм розв’язання.
- •Приклад розв’язання задачі.
- •Згідно алгоритму:
- •Методика рішення задач з теми «Розчини. Способи визначення концентрації»
- •Алгоритм розв’язання
- •Алгоритм розв’язання задач
- •Приклад розв’язання задачі за алгоритмом
- •Методика рішення задач з теми «Гальванічні елементи»
- •Алгоритм розв’язання задач
- •Приклад розв’язання задачі за алгоритмом
- •Методика рішення задач з теми «Електрохімічна корозія металів»
- •Алгоритм розв’язання задачі
- •Приклад розв’язання задачі
- •Контрольні завдання еквіваленти й еквівалентні маси простих і складних речовин. Закон еквівалентів
- •Будова атому
- •Енергетика хімічних процесів Стандартні теплоти (ентальпії) утворення деяких речовин
- •Хімічна спорідненість Стандартна енергія Гіббса утворення деяких речовин
- •Стандартні абсолютні ентропії деяких речовин
- •Хімічна кінетика та рівновага
- •Способи вираження концентрації розчину
- •Властивості розчинів
- •Іонно-молекулярні (іонні) реакції обміну
- •Окисно-відновні реакції
- •Електродні потенціали й електрорушійні сили Стандартні електродні потенціали (е°) деяких металів (ряд напруг м. М. Бєкєтова)
- •Електроліз
- •Корозія металів
§ 8.3. Рівняння нернста
У нестандартних умовах (та також за стандартної температури 298К) електродний потенціал розраховують за рівнянням Нернста:
![]()
![]()
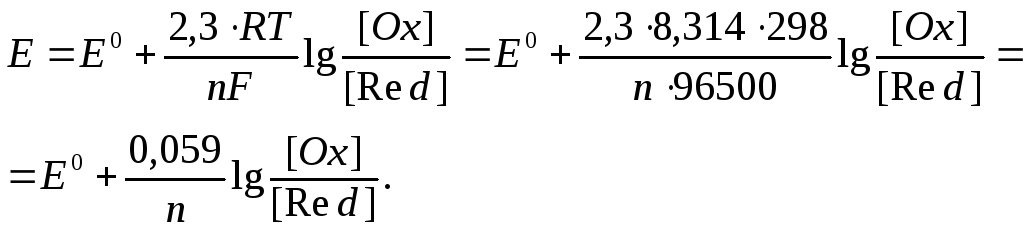
Для металевих електродів при стандартній температурі 298К рівняння Нернста має вигляд:
![]()
![]()
![]()
![]()
![]()
![]() ,
,
де [Oх] – концентрація окисленої форми(окисника),(моль/л);
[Red] – концентрація відновленої форми ( відновника)(моль/л);
R=8.314 Дж/К.моль – (універсальна газова постійна);
Е0 – відносний стандартний електродний потенціал (табличні дані); виміряється у вольтах (В);
Т – абсолютна температура (якщо стандартна, тоді Т =298К);
F – число Фарадея, що дорівнює 96500 (Кл/моль);
n – число електронів, що беруть участь у процесі;
СМеn+ – молярна концентрація катіонів металу (моль/л).
Е=Е0+0.059/n.lgCMen+, якщо CМe n+=1 моль/л, тоді Е = Е0.
Задача. Обчислити електродний потенціал золотої пластини, зануреної в розчин солі з концентрацією [Au3+], рівною 0.1 моль/л.
Розв’язок.
Оскільки умови, наведені в задачі, відрізняються від стандартних, тобто СAu3+1 моль/л, а складає 0,1 моль/л, отже, для розрахунку електродного потенціалу необхідно використовувати рівняння Нернста:
ЕAu3+/Au=1.5+(0.059/3).lg10-1=1.48 (В).
Поняття «стандартний електродний потенціал» уведене для того, щоб можна було порівняти окислювально-відновні властивості різних систем. У відповідності зі значеннями стандартного електродного потенціалу був складений електрохімічний ряд напруг металів.
K Ca Mg Al Zn Fe Pb H+ Cu Ag Au
-3.0 -2.9 -2.4 -1.7 -0.76 -0.44 -0.13 0 +0.34 +0.8 +1.5
1. Усі метали, що знаходяться ліворуч водню , мають негативні значення стандартних електродних потенціалів, праворуч –позитивні. Угоду про знаки потенціалів було прийнято в 1953 р. на конгресі Міжнародного союзу теоретичної і прикладної хімії (ІЮПАК) . Умовилися приписувати потенціалу той знак , що має електрод у парі зі стандартним водневим електродом .
2. Негативні значення
свідчать, що дані метали є відновниками
стосовно водню, тобто витісняють
(відновлюють його) з розчинів мінеральних
кислот з концентрацією катіонів водню
СН+=1 моль/л, аніони яких не
виявляють окисних властивостей (HCl,H![]() SO
SO![]() (
розв )):
(
розв )):
Zn+2HCl→ZnCl![]() +H
+H![]() ↑;
↑;![]() E0
Zn+2
/Zn=
-0.763 B.
E0
Zn+2
/Zn=
-0.763 B.
3. Чим більш негативне значення електродного потенціалу, тим вище здатність металу віддавати свої йони в розчин, тобто тим сильніше виражена відновна здатність його відновленої форми (здатність віддавати електрони) і нижче окисна здатність його окисленої форми (здатність приймати електрони).
4. Позитивне значення потенціалу означає, що дані йони металів є окисниками стосовно водню, тобто не витискують його з розчинів, у яких концентрація катіонів водню СН+=1моль/л. Навпаки, водень витискує метали з розчинів їх солей.
5. Серед металів з позитивним значенням стандартного електродного
потенціалу кожен попередній метал витискує всі наступні з розчинів їх солей. Наприклад: Cu+HgCl2→CuCl2+Hg.
Питання для самоконтролю
1.Які реакції відносяться до окислювально-відновних (ОВР)? Як їх класифікують?
2.Як можна визначити напрямок перебігу ОВР?
3. Електродний потенціал:
3.1.Що таке подвійний електричний шар; рівноважний електродний потенціал?
3.2.Як визначають стандартний електродний потенціал?
3.3.Які величини поєднує рівняння Нернста?
3.4.Як порівняти активність металів за рядом напруг металів?
Р о з д і л 9
ХІМІЧНІ ДЖЕРЕЛА СТРУМУ
