
- •Бугрім с.П.
- •§ 1.1. Закони збереження матерії, сталості сполук, Авогадро 8
- •Стехіометричні закони хімії
- •§1.1. Закони збереження матерії, сталості сполук, авогадро, кратних співвідношень, об’ємних відносин
- •1. В одному молі речовини міститься 6, 02 ∙10 23 молекул. Значення 6, 02 ∙ 10 23 моль –1 називають числом Авогадро (na).
- •2. Один моль будь-якого газу за нормальних умов (н.У.) (00с чи 273 k), 1,03 105 Па) займає об’єм 22,4 л.
- •§1.2. Еквівалент. Закон еквівалентних відносин
- •§ 2.1. Теорії з будови атома
- •§ 2.2. Квантові числа
- •§ 2.3. Принципи заповнення атомних орбіталей
- •§ 3.1. Періодичний закон д.І.Менделєєва
- •§ 3.2. Закономірності періодичної системи
- •§ 4.1. Основні поняття хімічної термодинаміки
- •§ 4.2. Перший закон термодинаміки
- •§ 4.3. Закон гесса
- •§ 4.4. Другий закон термодинаміки. Енергія гіббса
- •§ 5.1. Визначення швидкості хімічної реакції
- •§ 5.2. Фактори, що впливають на швидкість хімічної реакції
- •1. Залежність швидкості хімічної реакції від природи реагуючих речовин.
- •4. Залежність швидкості хімічної реакції від температури
- •5. Залежність швидкості хімічної реакції від каталізатору
- •§ 5.3. Хімічна рівновага. Принцип лє-шательє
- •§ 6.1. Характеристика розчинів та способи вираження їхнього складу
- •§6.2.Властивості розбавлених розчинів неелектролітів
- •§ 6.3. Загальні уявлення з теорії електролітичної дисоціації
- •Електроліти (за зарядом йону)
- •§ 6.4. Електролітична дисоціація води. РН розчинів
- •§ 6.5. Гідроліз
- •§ 7.1. Будова комплексних сполук
- •Внутрішня сфера зовнішня сфера
- •Залежність кч від заряду ца
- •1. Кс, що містять ліганди молекулярного типу
- •2. Кс, що містять ліганди йонного типу
- •4. Змішані комплекси
- •§ 7.2. Властивості комплексних сполук
- •§ 8.1. Перебіг окисно-відновних реакцій
- •§ 8.2. Електродний потенціал
- •§ 8.3. Рівняння нернста
- •§ 9.1. Робота гальваничного елементу
- •§ 9.2. Акумулятори. Паливні елементи
- •§ 10.1. Класифікація корозійних процесів
- •§ 10.2. Хімічна та електрохімічна корозія
- •§ 10.3. Захист металів від корозії
- •§ 11.1. Електродні процеси при електролізі
- •§ 11.2. Закони фарадея
- •Методика рішення типових задач з теми “Еквівалент. Закон еквівалентів”
- •Алгоритм розв’язання задач
- •Приклад роз’язання задачі.
- •Методика рішення типових задач з теми: «Хімічна термодинаміка»
- •Алгоритм розв’язання.
- •Приклад розв’язання задачі.
- •Згідно алгоритму:
- •Методика рішення задач з теми «Розчини. Способи визначення концентрації»
- •Алгоритм розв’язання
- •Алгоритм розв’язання задач
- •Приклад розв’язання задачі за алгоритмом
- •Методика рішення задач з теми «Гальванічні елементи»
- •Алгоритм розв’язання задач
- •Приклад розв’язання задачі за алгоритмом
- •Методика рішення задач з теми «Електрохімічна корозія металів»
- •Алгоритм розв’язання задачі
- •Приклад розв’язання задачі
- •Контрольні завдання еквіваленти й еквівалентні маси простих і складних речовин. Закон еквівалентів
- •Будова атому
- •Енергетика хімічних процесів Стандартні теплоти (ентальпії) утворення деяких речовин
- •Хімічна спорідненість Стандартна енергія Гіббса утворення деяких речовин
- •Стандартні абсолютні ентропії деяких речовин
- •Хімічна кінетика та рівновага
- •Способи вираження концентрації розчину
- •Властивості розчинів
- •Іонно-молекулярні (іонні) реакції обміну
- •Окисно-відновні реакції
- •Електродні потенціали й електрорушійні сили Стандартні електродні потенціали (е°) деяких металів (ряд напруг м. М. Бєкєтова)
- •Електроліз
- •Корозія металів
§ 11.2. Закони фарадея
1-й закон:
маси речовин, що виділилися на електродах, прямо пропорційні кількості електрики (Q), що пройшла кріз розчин чи розплав електроліту.
m =k . Q; Q=I· ;
де Q – кількість електрики, А. с ;А. год;
I – сила струму, А;
– час ,с; год;
k – електрохімічний еквівалент , г/Кл.
Маса речовини, що виділилась при проходженні через електроліт одного кулона електрики, називається електрохімічним еквівалентом(k)
![]() ;
; ![]()
де m – маса речовини, г;
V – об’єм речовини, л;
![]() –еквівалента
молярна маса, г/моль;
–еквівалента
молярна маса, г/моль;
![]() -
еквівалентний об’єм, л/моль;
-
еквівалентний об’єм, л/моль;
F – число Фарадея , 96500 Кл/моль; 26,8 А·год/моль.
II-й закон:
при проходженні через різні електроліти однакової кількості електрики на електродах виділяються маси речовин пропорційно молярним масам їх еквівалентів (хімічні еквіваленти пропорційні електрохімічними):
![]() .
.
Внаслідок перебігу побічних процесів на електродах утворюється реально менша кількість речовини, ніж теоретично розраховано за вищевказаною формулою. Для характеристики практичної кількості речовини, що виділяється на електродах користуються поняттям вихід по струму ().
![]() .
.
Задача.Скласти схему електролізу розчину натрію сульфату. Написати рівняння катодного й анодного процесів, розрахувати кількість речовин, що утворилися при електролізі (для газоподібних – об’єм), якщо вихід по струму 70%, а через розчин пропускали струм силою 2А терміном 10 хвилин.
Розв’язок.
Натрій сульфат в розчині дисоціює;
Na2SO4
↔ 2Na+
+ SO4![]() ;
H2O
;
H2O
На катоді йде відновлення тих часток, стандартний окисно-відновний електродний потенціал для яких більший,
![]()
тому на катоді буде відновлюватися вода за схемою:
К![]() : 2НОН
+ 2ē → Н2↑
+ 2ОН
: 2НОН
+ 2ē → Н2↑
+ 2ОН![]() ,
,
до
анода направляються йони SO4![]() і
молекули H2O.
і
молекули H2O.
На анодіокиснюються ті частки,стандартний окисно-відновний електродний потенціал для яких має менше значення
![]() ,
тому буде йти окиснення води за схемою:
,
тому буде йти окиснення води за схемою:
А+: 2Н2О - 4ē → О2 + 4Н+.
Сумарне рівняння електролізу Na2SO4:
2Na2SO4
+ 6H2O
![]() 2H2
+ 4NaOH + O2
+ 2H2SO4
2H2
+ 4NaOH + O2
+ 2H2SO4
на катоді у катода на аноді у анода
За законом Фарадея розрахуємо об’єми V(Н2), V(О2) і маси
m(NaOH),
m(H2SO4),
знаючи, що вихід по струму
![]() (ή)
складає 70%=0,7.
(ή)
складає 70%=0,7.
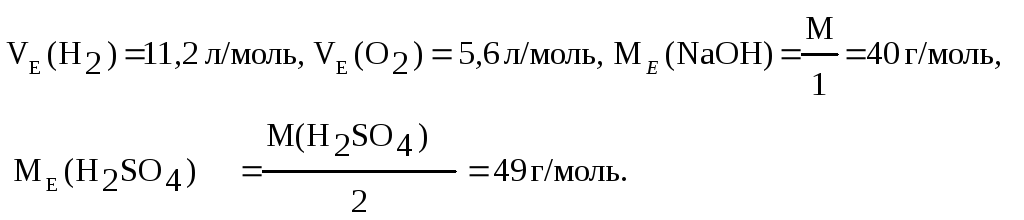
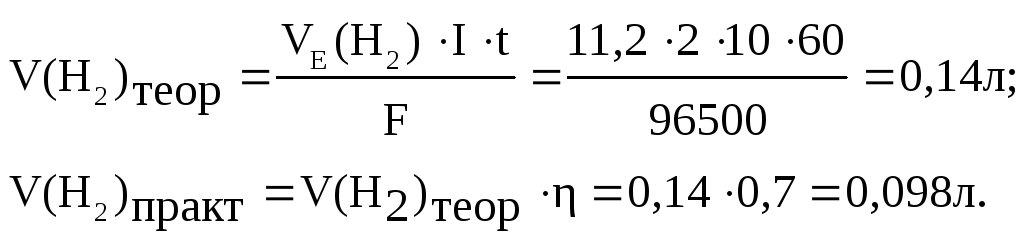
![]() визначаємо
за другим законом Фарадея:
визначаємо
за другим законом Фарадея:

Основне застосування електроліззнаходить у металургійній, хімічній промисловості і гальванотехніці. У металургійній промисловості електролізом розплавів одержуютьAl, Mg, Na, Li, Be, Ca. Електролітичне виділення металу з розчину називається електроекстракцією. Руда чи концентрат певними реагентами переводиться в розчин, який після очищення направляють на електроліз. Так одержуютьZn, Cu, Cd.
Електролітичне рафінування.З металу виготовляють розчинні аноди, домішки, що містяться в чорновому металі анода, випадають у виді анодного шламу (Cu, Ni, Sn, Pb, Ag, Au) при електролізі, а чистий метал виділяється на катоді.
До гальванотехніки відносять гальваностегіюігальванопластику.
Гальваностегія– це нанесення шляхом електролізу на поверхню металевих виробів шарів інших металів з метою захисту від корозії, для додання твердості поверхні, у декоративних цілях. Наприклад, хромування, цинкування , нікелювання.
Гальванопластика– це процес одержання точних металевих копій з рельєфних предметів електроосадом металу (на алюмінієву форму наносять електролізом шар міді потрібної товщини, потім алюміній розчиняють у соляній кислоті чи лузі). Так одержують матриці для пресування різних виробів: ґудзиків, пластинок для тиснення шкіри і паперу, радіотехнічних схем, типографських кліше. До гальванопластики відносять також такий вид електрохімічної обробки металів, як електрополіровкуAl, Mgдля зміцнення оксидної плівки і підвищення корозійної стійкості.
У хімічній промисловості електролізом одержують фтор, хлор, луги, водень, багато окисників, гідрогену пероксид.
Питання для самоконтролю
1. Яка сутність процесів, що проходять при електролізі.
2. Види електролізу:
2.1.Що відбувається при електролізі розплавів?
2.2. Що відбувається при електролізі водних розчинів?
3. Яка послідовність розрядки йонів на електродах?
4. Що таке перенапруга.?
5. Наведіть закони електролізу.
6. Де застосовують електроліз?
Д о д а т о к 1
МЕТОДИКА РІШЕННЯ ЗАДАЧ З ЗАСТОСУВАННЯМ АЛГОРИТМІВ
