
- •Бугрім с.П.
- •§ 1.1. Закони збереження матерії, сталості сполук, Авогадро 8
- •Стехіометричні закони хімії
- •§1.1. Закони збереження матерії, сталості сполук, авогадро, кратних співвідношень, об’ємних відносин
- •1. В одному молі речовини міститься 6, 02 ∙10 23 молекул. Значення 6, 02 ∙ 10 23 моль –1 називають числом Авогадро (na).
- •2. Один моль будь-якого газу за нормальних умов (н.У.) (00с чи 273 k), 1,03 105 Па) займає об’єм 22,4 л.
- •§1.2. Еквівалент. Закон еквівалентних відносин
- •§ 2.1. Теорії з будови атома
- •§ 2.2. Квантові числа
- •§ 2.3. Принципи заповнення атомних орбіталей
- •§ 3.1. Періодичний закон д.І.Менделєєва
- •§ 3.2. Закономірності періодичної системи
- •§ 4.1. Основні поняття хімічної термодинаміки
- •§ 4.2. Перший закон термодинаміки
- •§ 4.3. Закон гесса
- •§ 4.4. Другий закон термодинаміки. Енергія гіббса
- •§ 5.1. Визначення швидкості хімічної реакції
- •§ 5.2. Фактори, що впливають на швидкість хімічної реакції
- •1. Залежність швидкості хімічної реакції від природи реагуючих речовин.
- •4. Залежність швидкості хімічної реакції від температури
- •5. Залежність швидкості хімічної реакції від каталізатору
- •§ 5.3. Хімічна рівновага. Принцип лє-шательє
- •§ 6.1. Характеристика розчинів та способи вираження їхнього складу
- •§6.2.Властивості розбавлених розчинів неелектролітів
- •§ 6.3. Загальні уявлення з теорії електролітичної дисоціації
- •Електроліти (за зарядом йону)
- •§ 6.4. Електролітична дисоціація води. РН розчинів
- •§ 6.5. Гідроліз
- •§ 7.1. Будова комплексних сполук
- •Внутрішня сфера зовнішня сфера
- •Залежність кч від заряду ца
- •1. Кс, що містять ліганди молекулярного типу
- •2. Кс, що містять ліганди йонного типу
- •4. Змішані комплекси
- •§ 7.2. Властивості комплексних сполук
- •§ 8.1. Перебіг окисно-відновних реакцій
- •§ 8.2. Електродний потенціал
- •§ 8.3. Рівняння нернста
- •§ 9.1. Робота гальваничного елементу
- •§ 9.2. Акумулятори. Паливні елементи
- •§ 10.1. Класифікація корозійних процесів
- •§ 10.2. Хімічна та електрохімічна корозія
- •§ 10.3. Захист металів від корозії
- •§ 11.1. Електродні процеси при електролізі
- •§ 11.2. Закони фарадея
- •Методика рішення типових задач з теми “Еквівалент. Закон еквівалентів”
- •Алгоритм розв’язання задач
- •Приклад роз’язання задачі.
- •Методика рішення типових задач з теми: «Хімічна термодинаміка»
- •Алгоритм розв’язання.
- •Приклад розв’язання задачі.
- •Згідно алгоритму:
- •Методика рішення задач з теми «Розчини. Способи визначення концентрації»
- •Алгоритм розв’язання
- •Алгоритм розв’язання задач
- •Приклад розв’язання задачі за алгоритмом
- •Методика рішення задач з теми «Гальванічні елементи»
- •Алгоритм розв’язання задач
- •Приклад розв’язання задачі за алгоритмом
- •Методика рішення задач з теми «Електрохімічна корозія металів»
- •Алгоритм розв’язання задачі
- •Приклад розв’язання задачі
- •Контрольні завдання еквіваленти й еквівалентні маси простих і складних речовин. Закон еквівалентів
- •Будова атому
- •Енергетика хімічних процесів Стандартні теплоти (ентальпії) утворення деяких речовин
- •Хімічна спорідненість Стандартна енергія Гіббса утворення деяких речовин
- •Стандартні абсолютні ентропії деяких речовин
- •Хімічна кінетика та рівновага
- •Способи вираження концентрації розчину
- •Властивості розчинів
- •Іонно-молекулярні (іонні) реакції обміну
- •Окисно-відновні реакції
- •Електродні потенціали й електрорушійні сили Стандартні електродні потенціали (е°) деяких металів (ряд напруг м. М. Бєкєтова)
- •Електроліз
- •Корозія металів
§ 10.1. Класифікація корозійних процесів
Метали внаслідок своєї високої міцності, пластичності, зносостійкості, тепло- і електропровідності є найбільш важливими конструкційними матеріалами. У процесі експлуатації в результаті впливу навколишнього середовища відбувається їх руйнування, так звана корозія.
Втрати від корозії у провідних індустріальних країнах становлять близько 3-5% валового національного продукту, а витрати на відшкодування корозійних затрат в усьому світі обчислюються сотнями мільярдів доларів, тому розділ «Корозія металів і методи захисту їх від корозії» є одним з найважливіших у курсі хімії для інженерних спеціальностей.
Звичайно кородують метали, що зустрічаються у природі не в самородному стані, як Au, Pt, а у вигляді різних руд. На добування цих металів із природних сполук витрачається значна кількість енергії(Меn+ + nē → Me0; ΔG>0), що накопичується в металах, роблячи їх термодинамічно нестійкими, хімічно активними речовинами (Ме0 - nē → Men+; ΔG<0). У результаті такого самовільного перебігу метали віддають навколишньому середовищу накопичену енергію, а самі руйнуються, тобто кородують і перетворюються в оксиди, гідроксиди, карбонати, сульфіди та інші сполуки і губляться безповоротно.
Отже, корозію можна визначити як самовільний перебіг окисно-відновного процесу (ΔG<0) руйнування металу під впливом навколишнього середовища, що відбувається з виділенням енергії (ΔН<0) і розсіюванням речовини (ΔS>0).
Механічне руйнування металів, що відбувається з фізичних причин, називають не корозією, а ерозією, стиранням, зносом.
Захарактером руйнування поверхні корозію підрозділяютьнасуцільну і місцеву.Суцільна корозіяпідрозділяється нарівномірну,якщо процес окиснення відбувається по всій поверхні металу з однаковою швидкістю, інерівномірну– процес окиснення відбувається по всій поверхні з різною швидкістю на різних ділянках металу.
Місцева корозіяпідрозділяється на корозіюплямами, точкову,піттинг(поглиблено-точкову),міжкристалеву (найбільш небезпечна, тому що послабляє зв'язок між зернами структури сплавів), щорозтріскується, селективну(виборчу).
За механізмом перебігрозрізняють такі види корозії:
-хімічна (газова, рідинна);
-електрохімічна (концентраційна, контактна, електрокорозія);
-особливі види (біологічна, радіаційна, ультразвукова).
Захарактером додаткових впливіврозрізняють:
-корозію під впливом механічних напруг;
-корозію при терті;
- кавітаційну корозію (виникає при одночасному корозійному та ударному впливі агресивного середовища, коли лопаються пухирці повітря при роботі лопастей гребного гвинта, роторів насосів).
§ 10.2. Хімічна та електрохімічна корозія
Розглянемо більш докладно види корозії за механізмом перебігу.
Під хімічною корозією розуміють руйнування металів окисненням у навколишньому середовищі без виникнення електричного струму в системі.
Газова корозія відбувається за звичайних умов, але частіше при високих температурах. Спостерігається при розливі розплавлених металів, їх термічній обробці, куванні, прокатці, зварюванні і т.д.
Найпоширеніший випадок газової корозії – взаємодія металу з киснем:
xMe + 1/2yО2 → MexOy
4Fe + 3O2 → 2Fe2O3.
Оксидна плівка, що утворюється при такій корозії, у ряді випадків відіграє захисну функцію. Для цього вона повинна бути суцільною, непористою, мати гарне зчеплення з металом, твердість, зносостійкість і коефіцієнт термічного розширення, близький до цієї величини, для металу. Усі ці якості оксидної плівки можна оцінити за фактором Піллінга-Бедвордса (). Метали (лужні, лужноземельні), у яких1 мають тонкі оксидні плівки з розривами. Суцільні і стійкі оксидні шари утворяться при=1,2 – 1,6 (наприклад,Al2O3, ZnО, NiОі т.д.). При значенняхзначно більше одиниці плівки виходять несуцільними, що легко відокремлюються від поверхні металу (залізна окалина). Корозіонно-активними газами, крім кисню, є: чадний газ, вуглекислий газ, сірчистий ангідрид, азот, його оксиди і галогени. Наприклад, при розливі розплавленого алюмінію відбувається його взаємодія не тільки з киснем, але і з азотом повітря.
4Al + 3O2 → 2Al2O3; 2Al + N2 → 2AlN
Рідинна корозіяпротікає, як правило, у рідких неелектролітах: спиртах, хлороформі, бензолі, бензині, газі та інших нафтопродуктах. Прискорює процес рідинної корозії сірка, кисень, галогени, волога, а також підвищена температура (корозія поршнів у двигунах внутрішнього згоряння),що можна описати рівняннями :
Me(II)+ R1 – S – R2 → MeS + R1 – R2
2Me(I) + 2R – Cl → 2MeCl + R – R ,
де R1 – S – R2 і R – Cl вуглеводи, що містять Сульфур і Хлор.
Електрохімічна корозія – найбільш розповсюджений вид корозії. Це руйнування деталей, машин, конструкцій у ґрунтових, річкових, морських водах, під впливом води (роси), під впливом мастильно-охолодних рідин, що використовуються при механічній обробці металів, атмосферній корозії і т.д.
Електрохімічна корозія – це просторово розділений окисно-відновний процес руйнування металу, що відбувається в середовищі електроліту, з виникненням усередині системи електричного струму, названого корозійним струмом.
Розглянемо хімізм атмосферної корозії сталевого виробу. Сталь – це сплав Феруму з Карбоном, у якому Карбону, наприклад, у вигляді цементиту Fe3C4 , менше 2%. За електрохімічної корозії у вологому повітрі (О2 + 2Н2О) Ферум і цементит утворюють мікрогальванопару, у якій роль анода виконує Ферум, а роль катода – цементит.
Схема процесу:
(![]() А)
Fe │H2O, O2│ Fe3C4(K+)
А)
Fe │H2O, O2│ Fe3C4(K+)
 Анодний процес:
Fe0
- 2ē
→
Fe2+
2
поляризація
Анодний процес:
Fe0
- 2ē
→
Fe2+
2
поляризація
Катодний процес:
2H2O + O2 +
4ē → 4OH![]() 1 деполяризація
1 деполяризація

2Fe + 2H2O + O2 → 2Fe(OH)2 (сумарне рівняння корозійного процесу руйнування сталевого виробу, що знаходиться у вологому повітрі.
Для Феруму більш характерний ступінь окиснення (+3), тому процес окиснення йде далі:
4Fe(OH)2+2H2O+O2→4Fe(OH)3,
Fe(OH)3, що утворюється, при нагріванні може втрачати воду:
Fe
(OH)3
![]() H2O
+ FeOOH
H2O
+ FeOOH
Тобто продуктами корозії заліза (іржа) є суміш різних сполук. Якщо врахувати, що в повітрі присутні вуглекислий газ, сірчистий газ, то можуть утворюватися і солі Феруму.
Ч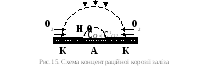 асто
через різну рельєфність металевих
конструкцій, у тому числі і сталевих,
на деяких ділянках накопичується вода,
при цьому відбувається так званаконцентраційна корозія, обумовлена
різною концентрацією деполяризаторакисню (у випадку
атмосферної корозії), йонів водню (у
кислому середовищі) на різних ділянках
металу. Там, де концентрація деполяризатора
більша (край краплі води), формується
катодна ділянка, а де концентрація
деполяризатора менша (центр краплі
води) – анодна ділянка (рис.15).
асто
через різну рельєфність металевих
конструкцій, у тому числі і сталевих,
на деяких ділянках накопичується вода,
при цьому відбувається так званаконцентраційна корозія, обумовлена
різною концентрацією деполяризаторакисню (у випадку
атмосферної корозії), йонів водню (у
кислому середовищі) на різних ділянках
металу. Там, де концентрація деполяризатора
більша (край краплі води), формується
катодна ділянка, а де концентрація
деполяризатора менша (центр краплі
води) – анодна ділянка (рис.15).
Після висихання краплі в її центрі виявляється поглиблення, а іноді навіть і отвір (для пластин товщиною 0,1...0,2 мм). Такі процеси часто спостерігаються за атмосферної і ґрунтової корозії залізних і сталевих виробів (троса, стопки листів і т.д.) – точкова корозія, що переходить у піттинг. Слід зазначити, що хоча кінцевий продукт корозії (іржа) нерозчинний, однак він не перешкоджає процесу подальшої корозії металу, оскільки формується за межами анодної ділянки (на межі зіткнення його з катодами) у вигляді кільця у середині точкі.
На практиці часто зустрічаються випадки, коли метали різної активності знаходяться в контакті один з одним, утворюючи гальванопари. Крім того, технічні метали містять домішки інших металів, сплави містять різні метали. Такий метал чи сплав, знаходячись у середовищі електроліту, дає безліч мікро - і макрогальванопар, у яких анодом є більш активний метал, тобто метал з меншим значенням електродного потенціалу, саме він і піддається корозії.
Розглянемо випадок контактної корозії Цинку і Купруму з водневою деполяризацієюу сірчанокислому середовищі. Цинк і Купрум мають різні значення електродних потенціалів. Більш активним у цій гальванопарі є Цинк (Е0Zn+2/Zn= -0,76 В), він має менше значення електродного потенціалу і буде анодом, тобто саме Цинк буде підвержен корозійному руйнуванню. Менш активним металом є Купрум (Е0Cu+2/Cu= +0,34 В), Купрум буде катодом.
Запишемо схему:
(![]() А)Zn │ H2SO4 │
Cu(K+).
А)Zn │ H2SO4 │
Cu(K+).
Анодний процес: Zn0 - 2ē → Zn2+
Катодний процес: 2Н+ + 2ē → Н2деполяризація

Zn + 2H+ → Zn2+ + H 2 (сумарне іонне рівняння)
Молекулярне рівняння: Zn + H2SO4 → ZnSO4 + H2
Фактори, що впливають на швидкість корозії:
а) напруга і деформація за механічної обробки
металів;
б) перемішування агресивного середовища;
в) диференціальна аерація;
г) температура;
д) кислотність середовища (рН).
Зверніть увагу, що електродні потенціали металів істотно залежать від складу електроліту і рНсередовища. Наявність на металах оксидної плівки істотним чином впливає на їх потенціал, який може відрізнятися від стандартного. Так, експериментально визначено, що у випадку контактної (Al-Zn) корозії в 1М розчиніHCl:
![]()
![]() ,
,
виникає
гальванопара, у якій роль анода виконує
Al,
а катода – Zn.
Схема такого процесу: (![]() А)
Al
│ HCl,С=1моль/л
│ Zn (K+)
А)
Al
│ HCl,С=1моль/л
│ Zn (K+)
У 0,1 М розчині HCl
![]() у цьому випадку більшу активність має
цинк, він буде в гальванопарі анодом,
алюміній – катодом, а схему запишемо
так:
у цьому випадку більшу активність має
цинк, він буде в гальванопарі анодом,
алюміній – катодом, а схему запишемо
так:
(![]() А)
Zn
│ HCl,С=0,1моль/л│ Al
(K+)
А)
Zn
│ HCl,С=0,1моль/л│ Al
(K+)
Електрокорозіяпротікає під дією блукаючих струмів, виникає від постійних його джерел (електротранспорт, трансформатори, лінії електропередач). Розглядаючи корозію під дією блукаючих струмів, треба пам'ятати, що місце виходу струму буде анодною ділянкою, входу струму – катодною, ділянка перебігу струму – нейтральною зоною. Радіус дії блукаючих струмів може досягати декількох десятків кілометрів. Струм силою 1А за рік руйнує до 3 кг Алюмінію, 9 кг Феруму, 11 кг Цинку чи Купруму, 34 кг Плюмбума.
