
- •Бугрім с.П.
- •§ 1.1. Закони збереження матерії, сталості сполук, Авогадро 8
- •Стехіометричні закони хімії
- •§1.1. Закони збереження матерії, сталості сполук, авогадро, кратних співвідношень, об’ємних відносин
- •1. В одному молі речовини міститься 6, 02 ∙10 23 молекул. Значення 6, 02 ∙ 10 23 моль –1 називають числом Авогадро (na).
- •2. Один моль будь-якого газу за нормальних умов (н.У.) (00с чи 273 k), 1,03 105 Па) займає об’єм 22,4 л.
- •§1.2. Еквівалент. Закон еквівалентних відносин
- •§ 2.1. Теорії з будови атома
- •§ 2.2. Квантові числа
- •§ 2.3. Принципи заповнення атомних орбіталей
- •§ 3.1. Періодичний закон д.І.Менделєєва
- •§ 3.2. Закономірності періодичної системи
- •§ 4.1. Основні поняття хімічної термодинаміки
- •§ 4.2. Перший закон термодинаміки
- •§ 4.3. Закон гесса
- •§ 4.4. Другий закон термодинаміки. Енергія гіббса
- •§ 5.1. Визначення швидкості хімічної реакції
- •§ 5.2. Фактори, що впливають на швидкість хімічної реакції
- •1. Залежність швидкості хімічної реакції від природи реагуючих речовин.
- •4. Залежність швидкості хімічної реакції від температури
- •5. Залежність швидкості хімічної реакції від каталізатору
- •§ 5.3. Хімічна рівновага. Принцип лє-шательє
- •§ 6.1. Характеристика розчинів та способи вираження їхнього складу
- •§6.2.Властивості розбавлених розчинів неелектролітів
- •§ 6.3. Загальні уявлення з теорії електролітичної дисоціації
- •Електроліти (за зарядом йону)
- •§ 6.4. Електролітична дисоціація води. РН розчинів
- •§ 6.5. Гідроліз
- •§ 7.1. Будова комплексних сполук
- •Внутрішня сфера зовнішня сфера
- •Залежність кч від заряду ца
- •1. Кс, що містять ліганди молекулярного типу
- •2. Кс, що містять ліганди йонного типу
- •4. Змішані комплекси
- •§ 7.2. Властивості комплексних сполук
- •§ 8.1. Перебіг окисно-відновних реакцій
- •§ 8.2. Електродний потенціал
- •§ 8.3. Рівняння нернста
- •§ 9.1. Робота гальваничного елементу
- •§ 9.2. Акумулятори. Паливні елементи
- •§ 10.1. Класифікація корозійних процесів
- •§ 10.2. Хімічна та електрохімічна корозія
- •§ 10.3. Захист металів від корозії
- •§ 11.1. Електродні процеси при електролізі
- •§ 11.2. Закони фарадея
- •Методика рішення типових задач з теми “Еквівалент. Закон еквівалентів”
- •Алгоритм розв’язання задач
- •Приклад роз’язання задачі.
- •Методика рішення типових задач з теми: «Хімічна термодинаміка»
- •Алгоритм розв’язання.
- •Приклад розв’язання задачі.
- •Згідно алгоритму:
- •Методика рішення задач з теми «Розчини. Способи визначення концентрації»
- •Алгоритм розв’язання
- •Алгоритм розв’язання задач
- •Приклад розв’язання задачі за алгоритмом
- •Методика рішення задач з теми «Гальванічні елементи»
- •Алгоритм розв’язання задач
- •Приклад розв’язання задачі за алгоритмом
- •Методика рішення задач з теми «Електрохімічна корозія металів»
- •Алгоритм розв’язання задачі
- •Приклад розв’язання задачі
- •Контрольні завдання еквіваленти й еквівалентні маси простих і складних речовин. Закон еквівалентів
- •Будова атому
- •Енергетика хімічних процесів Стандартні теплоти (ентальпії) утворення деяких речовин
- •Хімічна спорідненість Стандартна енергія Гіббса утворення деяких речовин
- •Стандартні абсолютні ентропії деяких речовин
- •Хімічна кінетика та рівновага
- •Способи вираження концентрації розчину
- •Властивості розчинів
- •Іонно-молекулярні (іонні) реакції обміну
- •Окисно-відновні реакції
- •Електродні потенціали й електрорушійні сили Стандартні електродні потенціали (е°) деяких металів (ряд напруг м. М. Бєкєтова)
- •Електроліз
- •Корозія металів
1. Кс, що містять ліганди молекулярного типу
- аміакати: [Cu(NH3)4](OH)2; [Pt(NH3)4]Cl2;
- аквакомплекси: [Cr(H2O)6]Cl3; [Cu(H2O)4]SO4;
- карбоніли металів: [Fe(CO)5]; [Ni(CO)4].
2. Кс, що містять ліганди йонного типу
- гідроксокомплекси: Na2[Zn(OH)4]; K3[Al(OH)6];
- ацидокомплекси :K3[Fe(CN)6]; Na3[AlF6] K2[HgI4];
- подвійні солі: CuCl2·KCl; KCl·MgCl2.
3. Циклічні КС (хелатичи клішнеподібні сполуки, в яких виникають координаційні зв’язки полідентатного ліганда з ЦА металу утворюючи цикл.
Наприклад, у реакції
Сu(ОН)2
з амінооцтовою кислотою утворює
нейтральний комплекс – Купруму(II)
гліцінат: ЦА
Купруму зв'язаний з Нітрогеном аміногрупи
за донорно-акцепторним механізмом, а
з Оксигеном карбоксильної групи –
звичайним ковалентним зв'язком.
ЦА
Купруму зв'язаний з Нітрогеном аміногрупи
за донорно-акцепторним механізмом, а
з Оксигеном карбоксильної групи –
звичайним ковалентним зв'язком.
4. Змішані комплекси
[Cr (H2O)5Cl]Cl2 ; [Co (NH3) 3(NO2)3].
Номенклатура комплексних сполук. В даний час єдиний підхід до рішення питання про номенклатуру КС відсутній. Українські вчені пропонують:
1. У назвах КС першим указувати катіон, другим – аніон.
2. У назвах комплексних йонів молекул ліганди перелічувати за абеткою, незалежно від заряду. Аніонним лігандам додавати до їхньої латинської назви закінчення «о»: NO2— - нітро,Cl—- хлоро, ОН—- гідроксо. Нейтральні ліганди називати як відповідні молекули:H2O-аква,NH3-амін. Кількість лігандів позначати грецькими числівниковими приставками: ді -; три -; тетра -; пента -; гекса - і т.д.
3. У назвах комплексних аніонів до латинської назви комплексоутворювача додавати суфікс – «ат».
4. Ступінь окиснення йона-комплексоутворювача (ЦА) вказувати в дужках римськими цифрами. Наприклад:
[Co(NH3)5Cl]Cl2 – пентаамінхлорокобальта (IІІ) хлорид;
K4[Fe(CN)6]– калію гексаціаноферат (II) ;
[Mo6(H2O)6Cl8]Cl4– гексаакваоктахлорогексамолібдена (II) хлорид. У процесі утворення КС по донорно-акцепторному механізму орбіталі ЦА перетерплюють гібридизацію. Тип гібридизації орбіталей комплексоутворювача визначає геометрію комплексного йона (дивись табл.17).
Таблиця 17
|
№ п/п |
Йон Ме |
КЧ |
Вид гібридизації акцепторних орбіта лей |
Геомет-рична конфігу-рація |
Приклад |
|
1 |
Agº(4d¹º5s¹) Ag+(4d105s0) |
2 |
sp-гібридизація NH3 NH3
|
Лінійна |
[Ag(NH3)2]+
діамагнітний |
|
2 |
Zn0(3d104s2)
Zn2+(3d104s0) |
4 |
sp3-гібридизація NH3 NH3 NH3 NH3
|
Тетраедр |
[Zn(NH3)4]² + діамагнітний |
|
3 |
Ni0
(3d84s2)
Ni2+(3d84s0) |
4 |
dsp2-гібридизація CN-CN-CN- CN-
|
Квадрат |
[Ni(CN)4]² ‾ діамагнітний |
|
4 |
Ni0
|
4 |
sp3-гібридизація C1- C1- C1- C1-
|
Тетраедр |
[NiCl4] ² ‾ парамагнітний |
|
5 |
Co0(3d74s2)
Co3+(3d64s0) |
6 |
6NH3
|
Октаедр |
[Co(NH3)6]³ + діамагніт-ний |
|
6 |
Co0
|
|
|
Октаедр |
[CoF6] ³‾ парамаг-нітний |
§ 7.2. Властивості комплексних сполук
Розходження в магнітних властивостях речовин можуть бути пояснені електронною будовою їхніх атомів, йонів і молекул. Діамагнітними (немагнітними) вважаються частки, сумарний магнітний момент яких дорівнює нулю, тобто всі електрони спарені і їхні магнітні моменти взаємно компенсуються. Якщо частинка має один чи кілька неспарених електронів, то сумарний магнітний момент відмінний від нуля, така частинка є парамагнітною.
Властивості КС залежать також від природи L. За силою впливу на валентні електрони ЦА ліганди розташовують у спектрохімічний ряд:
CO > CN- >NO2- >NH3 >CNS- >H2O >OH- >F- >Cl- >Br- >I-
L сильного поля, L поля середньої сили, L слабкого поля
У випадку сильного поля лігандів утворюються спін-спарені КС (табл. 17 ,спол. 3;5),а у випадку слабкого поля – спін-вільні КС (табл. 17, спол. 4;6). Багато КС мають забарвлення . Це з’ясовується можливістю переходу електронів з одного d-енергетичного підрівня на іншій за наявності незаповнених орбіталей. При поглинанні речовинами певної частини спектра сама речовина виявляється забарвлена у додатковий колір. Наприклад, чому сполукиAu(I) незабарвлені, аAu(III) забарвлені? ЙонAu+має електронну конфігурацію 5d10. Усі 5d-орбіталей заповнені, перехід електронів на d-підрівень неможливий. У йонаAu3+5d8-електронів, отже, на d-рівні дві вакансії, перехід електронів у межах d-підрівня можливий і тому сполукиAu3+забарвлені.
Йони зовнішньої
сфери зв'язані з комплексним йоном
силами електростатичної взаємодії,
тому в розчинах КС дисоціюють подібно
сильним електролітам на внутрішню і
зовнішню сфери ( первинна дисоціація).
Наприклад: [Аg (NH3)
2] Cl ↔ [Ag (NH3)
2]+ + Cl![]() або
або
K3[Fe(CN)6]
↔ 3K+ + [Fe(CN)6]3![]() ( додаючи до розчину комплексної
сполуки K3[Fe(CN)6]роданід калію KCNSчервоний колір,
характерний для сполукиFe(CNS)3не з'являється).
( додаючи до розчину комплексної
сполуки K3[Fe(CN)6]роданід калію KCNSчервоний колір,
характерний для сполукиFe(CNS)3не з'являється).
Якщо КС є нейтральною часткою, то їй не притаманна первинна дисоціація.
Комплексний йон дисоціює значно слабше (подібно слабким електролітам) – це вторинна дисоціація, вона може йти ступенево і характеризується КД, що називається константою нестійкості (Кнест).
[Ag(NH3)2]+ ↔ [Ag(NH3)]+ + NH3 I ступінь, Кнест1;
+
[Ag(NH3)]+ ↔ Ag+ + NH3 II ступінь, Кнест2;
[Ag(NH3)2]+ ↔ Ag+ + 2NH3 Кнест = Кнест1 . Кнест2.
Ця величина є мірою
стійкості комплексного йона. Чим менше
значення Кнест, тим стійкіше
комплексний йон. Наприклад, з комплексних
йонів[Fe(CN)6]3![]() (Кнест=1,0.10-44),[Fe(CN)6]4
(Кнест=1,0.10-44),[Fe(CN)6]4![]() (Кнест=1,0 .
10-37) і[Ag(NH3)2]+
(Кнест= 2,8.10-8) – найміцнішим є комплексний
йон гексаціаноферат (III)[Fe(CN)6]3
(Кнест=1,0 .
10-37) і[Ag(NH3)2]+
(Кнест= 2,8.10-8) – найміцнішим є комплексний
йон гексаціаноферат (III)[Fe(CN)6]3![]() .
.
Для одержання КСможна використовувати реакції сполучення, заміщення, подвійного обміну, окислювально-відновні реакції (ОВР).
реакції сполучення:
CuCl2 + 4H2O → [Cu (H2O) 4] Cl2 ;
Cr (OH) 3 + 3NaOH → Na3 [Cr (OH) 6];
3KCN + Fe (CN) 3 → K3 [Fe (CN) 6];
реакції зовнішньосферного обміну:
3FeSO4 + 2K3[Fe(CN) 6] → Fe3 [Fe (CN) 6]2↓ + 3K2SO4;
реакції внутрішньосферного обміну:
[Co (H2O) 4] Cl2 + 4KCNS → K2 [Co (CNS) 4] + 2KCl + 4H2O;
окислювально-відновні реакції:
2K4[Fe(CN) 6] + Cl2 → 2K3[Fe(CN)6] + 2KCl.
Руйнування комплексних сполук можна здійснювати нагріванням, розведенням, зв'язуванням лігандів у більш міцні сполуки.
[Cu
(NH3)
4](OH)
2![]() CuО + H2O
+ 4NH3↑;
CuО + H2O
+ 4NH3↑;
K2 [Co (CNS) 4] + 4H2O → [Co (H2O) 4](CNS) 2 + 2KCNS;
[Ag (NH3) 2] Cl + 2HNO3(конц) → AgCl↓ +2 NH4NO3;
[Cu (NH3) 4](OH) 2 + Na2S →CuS↓ + 4NH3↑ + 2NaOH.
Питання для самоконтролю
1.Яке значення мають комплексні сполуки (КС)?
2.За допомогою якої теорії з’ясовують будову КС? Яка природа зв'язку в КС?
3.За яким принципом класифікують та називають КС?
4. Що таке гібридизація та її вплив на просторову будову КС?
5. Яка величина вказує на стійкість КС?
6. Наведіть реакції отримання і руйнування КС.
Р о з д і л 8
ОКИСНО-ВІДНОВНІ РЕАКЦІЇ

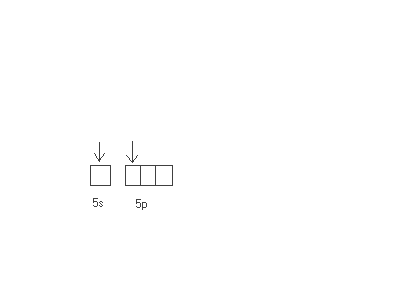
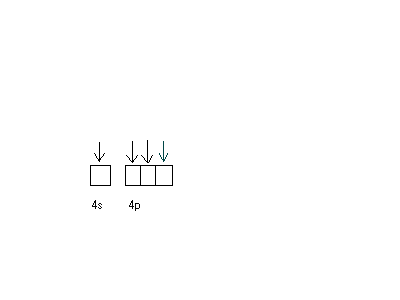

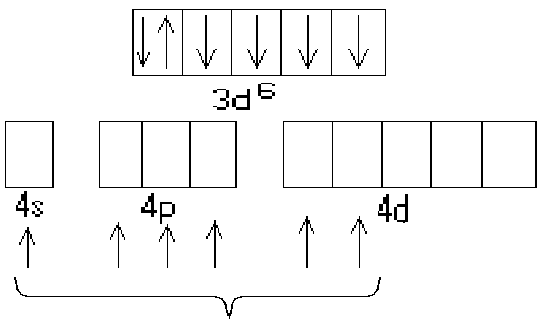 6F‾
6F‾