
- •Бугрім с.П.
- •§ 1.1. Закони збереження матерії, сталості сполук, Авогадро 8
- •Стехіометричні закони хімії
- •§1.1. Закони збереження матерії, сталості сполук, авогадро, кратних співвідношень, об’ємних відносин
- •1. В одному молі речовини міститься 6, 02 ∙10 23 молекул. Значення 6, 02 ∙ 10 23 моль –1 називають числом Авогадро (na).
- •2. Один моль будь-якого газу за нормальних умов (н.У.) (00с чи 273 k), 1,03 105 Па) займає об’єм 22,4 л.
- •§1.2. Еквівалент. Закон еквівалентних відносин
- •§ 2.1. Теорії з будови атома
- •§ 2.2. Квантові числа
- •§ 2.3. Принципи заповнення атомних орбіталей
- •§ 3.1. Періодичний закон д.І.Менделєєва
- •§ 3.2. Закономірності періодичної системи
- •§ 4.1. Основні поняття хімічної термодинаміки
- •§ 4.2. Перший закон термодинаміки
- •§ 4.3. Закон гесса
- •§ 4.4. Другий закон термодинаміки. Енергія гіббса
- •§ 5.1. Визначення швидкості хімічної реакції
- •§ 5.2. Фактори, що впливають на швидкість хімічної реакції
- •1. Залежність швидкості хімічної реакції від природи реагуючих речовин.
- •4. Залежність швидкості хімічної реакції від температури
- •5. Залежність швидкості хімічної реакції від каталізатору
- •§ 5.3. Хімічна рівновага. Принцип лє-шательє
- •§ 6.1. Характеристика розчинів та способи вираження їхнього складу
- •§6.2.Властивості розбавлених розчинів неелектролітів
- •§ 6.3. Загальні уявлення з теорії електролітичної дисоціації
- •Електроліти (за зарядом йону)
- •§ 6.4. Електролітична дисоціація води. РН розчинів
- •§ 6.5. Гідроліз
- •§ 7.1. Будова комплексних сполук
- •Внутрішня сфера зовнішня сфера
- •Залежність кч від заряду ца
- •1. Кс, що містять ліганди молекулярного типу
- •2. Кс, що містять ліганди йонного типу
- •4. Змішані комплекси
- •§ 7.2. Властивості комплексних сполук
- •§ 8.1. Перебіг окисно-відновних реакцій
- •§ 8.2. Електродний потенціал
- •§ 8.3. Рівняння нернста
- •§ 9.1. Робота гальваничного елементу
- •§ 9.2. Акумулятори. Паливні елементи
- •§ 10.1. Класифікація корозійних процесів
- •§ 10.2. Хімічна та електрохімічна корозія
- •§ 10.3. Захист металів від корозії
- •§ 11.1. Електродні процеси при електролізі
- •§ 11.2. Закони фарадея
- •Методика рішення типових задач з теми “Еквівалент. Закон еквівалентів”
- •Алгоритм розв’язання задач
- •Приклад роз’язання задачі.
- •Методика рішення типових задач з теми: «Хімічна термодинаміка»
- •Алгоритм розв’язання.
- •Приклад розв’язання задачі.
- •Згідно алгоритму:
- •Методика рішення задач з теми «Розчини. Способи визначення концентрації»
- •Алгоритм розв’язання
- •Алгоритм розв’язання задач
- •Приклад розв’язання задачі за алгоритмом
- •Методика рішення задач з теми «Гальванічні елементи»
- •Алгоритм розв’язання задач
- •Приклад розв’язання задачі за алгоритмом
- •Методика рішення задач з теми «Електрохімічна корозія металів»
- •Алгоритм розв’язання задачі
- •Приклад розв’язання задачі
- •Контрольні завдання еквіваленти й еквівалентні маси простих і складних речовин. Закон еквівалентів
- •Будова атому
- •Енергетика хімічних процесів Стандартні теплоти (ентальпії) утворення деяких речовин
- •Хімічна спорідненість Стандартна енергія Гіббса утворення деяких речовин
- •Стандартні абсолютні ентропії деяких речовин
- •Хімічна кінетика та рівновага
- •Способи вираження концентрації розчину
- •Властивості розчинів
- •Іонно-молекулярні (іонні) реакції обміну
- •Окисно-відновні реакції
- •Електродні потенціали й електрорушійні сили Стандартні електродні потенціали (е°) деяких металів (ряд напруг м. М. Бєкєтова)
- •Електроліз
- •Корозія металів
§ 3.1. Періодичний закон д.І.Менделєєва
Періодичний закон був сформульований 1 березня 1869 року великим російським вченим Дмитром Івановичем Менделєєвим.
Періодичний закон у інтерпретації Д.І.Менделєєва:
властивості простих тіл, а також форми і властивості їх сполук перебувають у періодичній залежності від величини атомної ваги елементів.
Сучасне формулювання періодичного закону:
властивості простих тіл, а також форми і властивості їх сполук перебувають у періодичній залежності від величини зарядів їх атомних ядер.
Періодична система елементів є графічним відображенням періодичного закону. Відомо кілька сотень форм періодичної системи, однак в Україні частіше використовується короткоперіодний варіант періодичної системи. Періодична система складається з періодів і груп.
Період– це горизонтальний ряд елементів, розташованих у порядку зростання їх порядкового номера (у порядку зростання зарядів ядер їх атомів).
Кожен період (окрім першого) починається активним лужним металом і закінчується інертним газом, перед яким стоїть активний неметал (галоген), тобто в періодах зліва направо металеві властивості елементів зменшуються, а неметалеві зростають. Це пов’язано з поступовим збільшенням числа електронів на валентному енергетичному рівні та зменшенням радіусів їхніх атомів. Розрізняють: малі (1;2;3) і великі (4;5;6;7) періоди. У періодах відбувається заповнення електронами зовнішньої (n) електронної оболонки атомів, а також незаповнених передзовнішних (n-1) і (n-2) оболонок. Номер періоду в періодичній системі Д.І.Менделєєва співпадає з числом енергетичних рівнів у атомі і збігається зі значенням головного квантового числа (n) зовнішнього енергетичного рівня.
Групи– це вертикальний ряд елементів, що володіють однотиповою електронною будовою. Відповідно до максимального числа електронів на зовнішньому електронному шарі незбуджених атомів елементи періодичної системи підрозділяються на вісім груп. У групі виділяютьголовну(А) (до неї входять s- і р - елементи малих і великих періодів) іпобічну(В ) підгрупи(до неї входятьd- ,f- елементи тільки великих періодів).
Номер групи вказує на кількість валентних електронів і відповідає вищій валентності елемента.
§ 3.2. Закономірності періодичної системи
У періодичній системі кожен елемент має строго певний порядковий номер і займає строго певне місце.
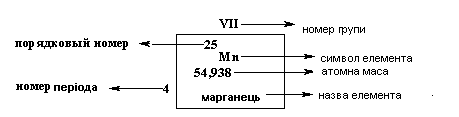
Порядковий номерелемента відповідає позитивному
заряду ядра атома (кількості протонів
- ∑![]() ) і загальній кількості електронів (
) і загальній кількості електронів (![]() ) на його орбіталях.
) на його орбіталях.
Валентні електрони мають найбільший запас енергії, вони визначають хімічні властивості атомів. Атоми, вступаючи в хімічні реакції, можуть віддавати валентні електрони, приймати їх чи утворювати загальні електронні пари.
Під валентністю хімічного елемента (В)мається на увазі йогоздатність до утворення хімічних зв'язків. В уявленні методу валентних зв'язківчисельне значення валентності відповідає кількості неспарених електронів. Крім валентності у хімії користуються ще одним поняттям «ступінь окиснення».
Ступінь окиснення(z) –це умовний заряд атома елемента в сполуках, розрахований, виходячи з припущення, що всі утворені цим атомом зв'язки, мають йонний характер.Відмінності понять валентності та ступеня окиснення особливо наочно простежуються на прикладі великої кількості органічних сполук. Карбон в органічних сполуках має валентність (IV), тоді як ступінь окиснення може набувати значень від -4 до +4 залежно від типу сполук. Валентність не має знака, тому що не враховується полярність хімічних зв’язків.
Здатність атомів віддавати чи приймати електрони визначається радіусом атома (Rат).Радіусом атома (Rат) будемо вважати половину між’ядерного простору. Хоча ця величина фізична, у ній укладено глибокий хімічний зміст. Чим більшеRат, тим легше атом утрачає свої валентні електрони.
У періодіRат зменшується зліва направо, оскільки зі збільшенням порядкового номера елемента кількість енергетичних шарів чи оболонок не змінюється, а кількість електронів на них і заряд ядра атома збільшуються. Це приводить до стиснення електронної густини і, як наслідок, до зменшенняRат.
У групіRат збільшується зверху донизу, оскільки зі збільшенням порядкового номера елемента збільшується кількість оболонок, і сили, які зв'язують електрони з позитивно зарядженим ядром атома, слабшають. Атоми, щовіддають електрони, виявляютьвідновні властивості. Кількісною характеристикою відновних властивостей елементів є енергія йонізації(I,кДж/моль, еВ/атом).
Енергія йонізації
(I) – це кількість енергії, необхідної
для відриву електрона від незбудженого
атома (А0) з перетворенням
останнього в позитивно заряджений йон
(катіон). Перша енергія йонізації
характеризує здатність атома віддавати
один електрон:А0 + I![]() А+ + ē.
А+ + ē.
Для багато електронних атомів енергії йонізації I1;I2; I3... відповідають відриву першого, другого і т.д. електронів. При цьомуI1 I2 I3..., тому що збільшення числа відірваних електронів приводить до зростання позитивного заряду йона, який утворюється.
Співвідношення енергії іонізації до заряду електрона називається потенціалом йонізації(виміряється в електрон-вольтах, (еВ)). Потенціал йонізації чисельно дорівнює енергії йонізації.
У періоді значення енергії йонізації від лужних металів до інертних газів збільшується, тому щоRат зменшується, а заряд ядра атома збільшується, у результаті чого відбувається стиснення електронної густини, тому необхідно витрачати більшу кількість енергії для відриву електрона від нейтрального атома.
У групахза
рахунок збільшення радіуса атома зверху
донизуенергія йонізації зменшується.
Найменша енергія йонізації у франція![]() .
.
Атоми, що приймають електрони, виявляють окислювальні властивості. Кількісною характеристикою окислювальних властивостей елемента є енергія спорідненості до електрона (Есп; еВ/атом).
Енергія
спорідненості до електрона (Есп)
– це енергія, що виділяється при
приєднанні електрона до нейтрального
атома(А0), вона характеризує
здатність атома до утворення негативно
заряджених йонів:А0 + ē
![]() А- + Есп.
А- + Есп.
Найбільша спорідненість до електрона в атома F. Енергія спорідненості до електрона значно менше енергії іонізації тих же атомів.
Обидві ці величини (I і Есп) залежать від заряду ядра і розмірів атома: зі збільшенням заряду ядра вони повинні рости, а зі збільшенням радіуса атома – зменшуватися.
Для порівняльної
оцінки IіЕв 1932 році американським
вченим Полінгом введена особлива
характеристика –електронегативність
(![]() ),
що визначається, за Маллікеном, як
здатність атомів у молекулі притягувати
електронну густину.
),
що визначається, за Маллікеном, як
здатність атомів у молекулі притягувати
електронну густину.
![]() =
1/2(I + Есп).
=
1/2(I + Есп).
Чим більше величина
![]() ,тим сильніше виражені неметалічні
властивості елемента. Чим менше величина
,тим сильніше виражені неметалічні
властивості елемента. Чим менше величина
![]() ,
тим сильніше виражені металеві властивості
елемента. Ця величина не має строго
фізичного змісту, але зручна для оцінки
реального стану хімічного зв'язку в
молекулах. За одиницю
,
тим сильніше виражені металеві властивості
елемента. Ця величина не має строго
фізичного змісту, але зручна для оцінки
реального стану хімічного зв'язку в
молекулах. За одиницю
![]() прийнята
прийнята
![]() Літію. Самим електронегативним елементом
є Флуор.
Літію. Самим електронегативним елементом
є Флуор.
З погляду будови атома всі елементи можна розділити на чотири типи:
s - елементи(заповнюється s- підрівень АО зовнішньої оболонки): ...ns1- ns2;
p - елементи(заповнюється p підрівень АО зовнішньої оболонки) ... np1- np6.
d - елементи(заповнюється d-підрівень АО незаповненої передзовнішньої оболонки) ... (n-1)d1ns2– (n-1)d10ns2;
f - елементи(заповнюється f-підрівень АО незаповненої третьої зовні оболонки)... (n-2)f1ns2 - (n-2)f14ns2.
Оскільки на s -
підрівні може бути (1-2)
![]() ,
тоs-елементирозташовуються
в IА і IIА групах, головних підгруп. Ці
типові метали мають подібні хімічні
властивості, тому що є електронними
аналогами.
,
тоs-елементирозташовуються
в IА і IIА групах, головних підгруп. Ці
типові метали мають подібні хімічні
властивості, тому що є електронними
аналогами.
Електронні аналоги – це елементи, в яких валентні електрони розташовані на орбіталях, описуваних загальною для всіх електронною формулою.
Наприклад: s-елементи IА групи мають загальну для всіх електронну формулу ns1, тобто вони - електронні аналоги (табл.6)
Таблиця 6
|
Елемент |
Li |
Na |
K |
Rb |
Cs |
Fr |
|
Електронна формула валентних електронів |
2 s1 |
3 s1 |
4 s1 |
5 s1 |
6 s1 |
7 s1 |
s-елементи IIА групи мають загальну для всіх електронну формулу ns2, тобто вони теж є електронні аналоги (табл.7)
Таблиця 7
|
Елемент |
Be |
Mg |
Ca |
Sr |
Ba |
Ra |
|
Електронна формула валентних електронів |
2 s2 |
3 s2 |
4 s2 |
5 s2 |
6 s2 |
7 s2 |
Властивості s-елемента IА групи Натрію 11Na (дивись табл.8).
Таблиця 8
|
Елемент |
Відновник |
Оксид |
Основа |
К-та |
Сіль |
|
11Na (3s1) –метал, Внорм = 1 |
Na0
|
Na2O |
NaOH |
---- |
NaCl
|
Властивості s-елемента IIА групи Барію 56Ba (дивись табл.9).
Таблиця 9
|
Елемент |
Відновник |
Оксид |
Основа |
Кислота |
Сіль |
|
56Ba(6s²)–метал Bнорм=0 B*(зб.ст.)=2 |
Ba0 (окиснюється) |
BaO
|
Ba(OH)2 |
- |
BaSO4 |
На p-підрівніможе бути 1-6 електронів, тому p-елементи розташовуються в IIIA – VIIIA групах, головних підгрупах. Таким чином, головні підгрупи складають тількиs- іpелементи. Серед р-елементів можуть бути метали, але вони найчастіше амфотерні (дивись табл.10).
Таблиця 10
|
Елемент |
Відновник |
Оксид |
Основа |
Кислота |
Сіль |
|
13Al(3s²3р1) –амф.метал Внорм=1 В*=3(найб. стійк.) |
Al0 (окиснюється) |
Al2O3 |
Al(OH)3 |
НАlO2 Н3АlO3 |
AlCl3 NaAlO2 Na3[Al(OH)6] |
p–елементи, у яких (4-8) електронів на останньому енергетичному рівні, є неметалами (дивись табл.11;12).
Таблиця 11
|
Елемент |
Окисник |
Оксид |
Основа |
Кислота |
Сіль |
|
9F(2s²2р5) Внорм=1
|
F0 (відновлюється) |
F2O |
– |
HF |
NaF |
17Cl (виявляє змінну валентність за рахунок появи вакантного 3d-підрівня, на який можуть переходити валентні електрони з 3s- і 3p-підрівнів).
Таблиця 12
|
Елемент |
Окисник |
Оксид |
Кислота |
Сіль |
|
17Cl(3s²3р5) Внорм.=1
В*=1
В*=3
В*=5
В*=7 |
Cl0 (відновлюється) Cl0 (окиснюється) Cl0 (окиснюється) Cl0 (окиснюється) Cl0 (окиснюється) |
−
Cl2O
Cl2O3
Cl2O3
Cl2O7
|
HCl
HClО
HClО2
HClО3
HСlO4 |
CaCl2
NaClО
NaClО2
NaCОl3
NaClО4 |
В інертних газах (HeіNe) p–підрівень цілком заповнений електронами. Теоретично і практично розпарюватися електронам нікуди. Валентність дорівнює нулю.
У 18Arза рахунок появи вакантного 3d підрівня можливі валентності: Внорм=0; В*=2,4,6,8.54Xeгорить у фторі з утворенням:XeF2, XeF4, XeF6, XeF8.
d - елементи– метали, тому що мають на останньому електронному рівні 2 електрони, хоча заповнення вакантних орбіталей у них відбувається на передзовнішньому шарі. Їх називають перехідними за розташуванням в періодичній системі між s і p елементами, вони формують побічні підгрупи (дивись табл.13).
Таблиця 13
|
Елемент |
Відновник |
Оксид |
Основа |
Сіль |
|
21Sс(4s²3d1) Внорм=1 В*=2
В*=3
|
Sc0 (окиснюється) Sc0
(окиснюється) |
ScO
Sc2O3 |
Sc(OH)2
Sc(OH)3 |
ScCl2
ScCl3 |
Закономірності
періодичної системи полягають в тому,
що електронна конфігурація хімічних
елементів періодично змінюється зі
зростанням їхніх порядкових номерів.
Перелічені фізико-хімічні характеристики
або їх можна назвати критеріями
періодичності
(валентність, ступень окиснення,
радіус
атома (Rат),
енергія йонізації (I),
енергія спорідненості до електрона
(Есп),
електронегативність
(![]() ))
також закономірно-періодично, цілком
передбачуванно змінюються в періодах
і групах. Це дозволяє визначати властивості
елементів за їхрозташуванням
у
періодичній системі.
))
також закономірно-періодично, цілком
передбачуванно змінюються в періодах
і групах. Це дозволяє визначати властивості
елементів за їхрозташуванням
у
періодичній системі.
План характеристики властивостей елементів за розташуванням у періодичній системі(ПС).
1. Розташування елемента в ПС (порядковий номер, період, група, підгрупа).
2. Будова атома – число протонів, нейтронів, число електронів в атомі, структура електронної оболонки атома, електронна формула валентних рівнів, валентність в основному і збудженому станах.
3. Тип елемента (s-, p-, d-, f- елемент), (метал, неметал), можливі ступені окиснення, формули оксидів і гідроксидів для кожного валентного стану.
Приклад:дати характеристику натрію. Порядковий номер його в періодичній системі 11, отже, заряд ядра атома дорівнює +11, навколо ядра обертаються 11 електронів. Натрій розташований у третьому періоді, тому його електрони розташовуються на трьох енергетичних рівнях. Натрій розташований у I - ій групі, головній підгрупі, отже, в атомаNaодин валентний електрон на зовнішньому рівні. А якщо в атома на зовнішньому енергетичному рівні знаходиться 1, 2 або 3 електрони, то атоми таких елементів є металами. Отже,Na – метал, його оксидNa2Oмає основний характер. Йому відповідає основаNaOH.
Відкриття періодичного закону Д.І. Менделєєва і створення ним періодичної системи хімічних елементів стали тріумфом у розвитку хімії XIX століття.
Знання, що нагромадились до того часу, про властивості 63 хімічних елементів були приведені Д.І. Менделєєвим у строгий порядок. З відкриттям періодичного закону з'явилася можливість передбачати властивості елементів і їхніх сполук. Д.І. Менделєєв, на основі відкритого ним періодичного закону передбачив властивості тоді ще невідомих елементів: Sc, Ga, Ge, Tc, Re, Po, At, Fr, Ra, Ac, Pa.,виправив атомну вагу уже відомих у той час елементів:Be, Ti, Y, In, La.
Періодична система елементів дуже вплинула на подальший розвиток хімії. Вона була першою природною класифікацією хімічних елементів та показала, що хімічні елементи утворюють струнку систему і знаходяться в тісному зв'язку один з одним. Періодична система елементів стала могутнім знаряддям для подальших досліджень. З часом передбачення Д.І.Менделєєва блискуче підтвердилися. Усі передбачені елементи були відкриті, та їхні властивості з разючою точністю відповідали раніше описаним.
В даний час періодичний закон залишається керівним принципом хімії. Саме на його основі штучно створюють трансуранові елементи. Один з них – елемент №101, вперше отриманий у 1955 р., – на честь великого російського вченого був назван Менделєєвієм.
Питання для самоконтролю
1.Наведіть стару та нову формуліровки періодичного закону Д.І.Менделєєва.
2.Як побудована періодична система Д.І.Менделєєва?
3.Який фізичний зміст величин періодичної системи?
4.Які закономірності періодичної системи?
5.Дайте визначення поняттям енергія іонізації, енергія спорідненості до електрона, електронегативність.
6.З чого складається план характеристики властивостей елементів по їх положенню в періодичній системі?
Р о з д і л 4
ХІМІЧНА ТЕРМОДИНАМІКА. ПЕРШИЙ ТА ДРУГИЙ ЗАКОНИ ТЕРМОДИНАМІКИ
