
- •Бугрім с.П.
- •§ 1.1. Закони збереження матерії, сталості сполук, Авогадро 8
- •Стехіометричні закони хімії
- •§1.1. Закони збереження матерії, сталості сполук, авогадро, кратних співвідношень, об’ємних відносин
- •1. В одному молі речовини міститься 6, 02 ∙10 23 молекул. Значення 6, 02 ∙ 10 23 моль –1 називають числом Авогадро (na).
- •2. Один моль будь-якого газу за нормальних умов (н.У.) (00с чи 273 k), 1,03 105 Па) займає об’єм 22,4 л.
- •§1.2. Еквівалент. Закон еквівалентних відносин
- •§ 2.1. Теорії з будови атома
- •§ 2.2. Квантові числа
- •§ 2.3. Принципи заповнення атомних орбіталей
- •§ 3.1. Періодичний закон д.І.Менделєєва
- •§ 3.2. Закономірності періодичної системи
- •§ 4.1. Основні поняття хімічної термодинаміки
- •§ 4.2. Перший закон термодинаміки
- •§ 4.3. Закон гесса
- •§ 4.4. Другий закон термодинаміки. Енергія гіббса
- •§ 5.1. Визначення швидкості хімічної реакції
- •§ 5.2. Фактори, що впливають на швидкість хімічної реакції
- •1. Залежність швидкості хімічної реакції від природи реагуючих речовин.
- •4. Залежність швидкості хімічної реакції від температури
- •5. Залежність швидкості хімічної реакції від каталізатору
- •§ 5.3. Хімічна рівновага. Принцип лє-шательє
- •§ 6.1. Характеристика розчинів та способи вираження їхнього складу
- •§6.2.Властивості розбавлених розчинів неелектролітів
- •§ 6.3. Загальні уявлення з теорії електролітичної дисоціації
- •Електроліти (за зарядом йону)
- •§ 6.4. Електролітична дисоціація води. РН розчинів
- •§ 6.5. Гідроліз
- •§ 7.1. Будова комплексних сполук
- •Внутрішня сфера зовнішня сфера
- •Залежність кч від заряду ца
- •1. Кс, що містять ліганди молекулярного типу
- •2. Кс, що містять ліганди йонного типу
- •4. Змішані комплекси
- •§ 7.2. Властивості комплексних сполук
- •§ 8.1. Перебіг окисно-відновних реакцій
- •§ 8.2. Електродний потенціал
- •§ 8.3. Рівняння нернста
- •§ 9.1. Робота гальваничного елементу
- •§ 9.2. Акумулятори. Паливні елементи
- •§ 10.1. Класифікація корозійних процесів
- •§ 10.2. Хімічна та електрохімічна корозія
- •§ 10.3. Захист металів від корозії
- •§ 11.1. Електродні процеси при електролізі
- •§ 11.2. Закони фарадея
- •Методика рішення типових задач з теми “Еквівалент. Закон еквівалентів”
- •Алгоритм розв’язання задач
- •Приклад роз’язання задачі.
- •Методика рішення типових задач з теми: «Хімічна термодинаміка»
- •Алгоритм розв’язання.
- •Приклад розв’язання задачі.
- •Згідно алгоритму:
- •Методика рішення задач з теми «Розчини. Способи визначення концентрації»
- •Алгоритм розв’язання
- •Алгоритм розв’язання задач
- •Приклад розв’язання задачі за алгоритмом
- •Методика рішення задач з теми «Гальванічні елементи»
- •Алгоритм розв’язання задач
- •Приклад розв’язання задачі за алгоритмом
- •Методика рішення задач з теми «Електрохімічна корозія металів»
- •Алгоритм розв’язання задачі
- •Приклад розв’язання задачі
- •Контрольні завдання еквіваленти й еквівалентні маси простих і складних речовин. Закон еквівалентів
- •Будова атому
- •Енергетика хімічних процесів Стандартні теплоти (ентальпії) утворення деяких речовин
- •Хімічна спорідненість Стандартна енергія Гіббса утворення деяких речовин
- •Стандартні абсолютні ентропії деяких речовин
- •Хімічна кінетика та рівновага
- •Способи вираження концентрації розчину
- •Властивості розчинів
- •Іонно-молекулярні (іонні) реакції обміну
- •Окисно-відновні реакції
- •Електродні потенціали й електрорушійні сили Стандартні електродні потенціали (е°) деяких металів (ряд напруг м. М. Бєкєтова)
- •Електроліз
- •Корозія металів
Приклад розв’язання задачі.
Визначите тепловий ефект, та зміну ентропії реакції відновлення Fe3O4(k) СО, якщо продуктами реакції є FeO та CO2. Зробіть висновок стосовно теплового ефекту реакції. Користуючись значеннями Н0 та S0 обчисліть G0 реакції. Визначте температуру початку реакції.
Згідно алгоритму:
запишемо термохімічне рівняння реакції
Fe3O4(k)+CO(г)=
3FeO(k)+CO2(г);
![]() -?
-?![]() -?
-?
вихідні речовини продукти реакції
для розрахунків
 ,
,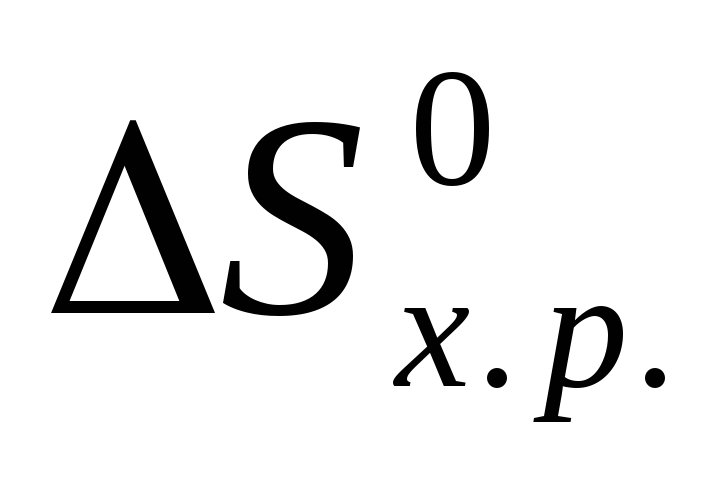 скористуємось формулами (1), (2);
скористуємось формулами (1), (2);численні значення величин беремо в таблицях “Стандартних термодинамічних величин”, та підставляємо в формулу;
зробимо розрахунки:
![]()
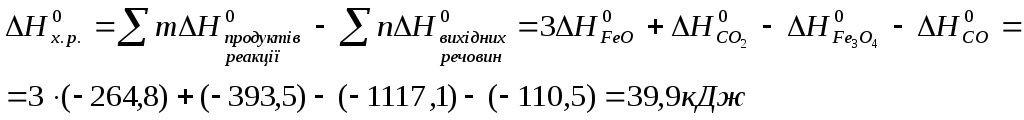
![]() >0,
реакція ендотермічна, йде з поглинанням
теплоти.
>0,
реакція ендотермічна, йде з поглинанням
теплоти.
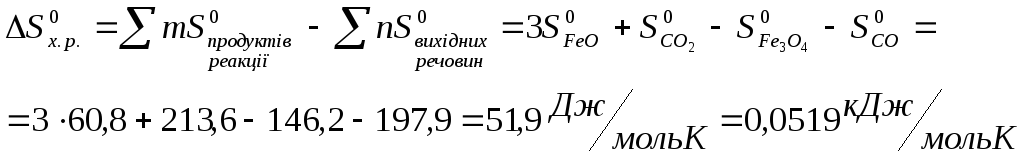
Користуючись
формулою (4) знайдемо
![]() в ст. у. (Т=298 К):
в ст. у. (Т=298 К):
![]() ,
,
![]() ›0,
пряма реакція в ст.у. неможлива.
›0,
пряма реакція в ст.у. неможлива.
Для визначення
температури початку реакції скористуємось
формулою (5) ![]()
Методика рішення задач з теми «Розчини. Способи визначення концентрації»
Щоб розв’язати задачи з цієї теми, треба знати способи визначення концентрації розчинів, що вони визначають, в яких одиницях вимірюються.
Формули, для розрахунків концентрації розчинів:
масова
частка ![]() (долі
одиниці)
(1);
(долі
одиниці)
(1);
мольна
частка ![]() (2);
(2);
відсоткова
![]() (у
відсотках) (3);
(у
відсотках) (3);
молярна
![]() (моль/л),
(моль/л),
![]() ,
якщо V
розчину в мл.
(4);
,
якщо V
розчину в мл.
(4);
молярна
концентрація еквіваленту
![]() (моль∙екв/л),
(моль∙екв/л),
![]() , якщо
V
розчину в мл.
(5);
, якщо
V
розчину в мл.
(5);
моляльна
![]() (моль/кг),
(моль/кг),
![]() якщоmр
в граммах
(6);
якщоmр
в граммах
(6);
тітр
![]() (г/см3),
(7);
(г/см3),
(7);
густина
![]() (8).
(8).
В цих
формулах m1,
M,
me
–відповідно маса (г), молярна маса
(г/моль), молярна маса еквіваленту
(г/моль) речовини, m2
– маса розчину, mр
– маса (г) розчинника, V
– об’єм (л, мл) розчину,
![]() -
густина розчину (г/см3,
або г/мл);
-
густина розчину (г/см3,
або г/мл);![]() -
відповідно кількість молів розчиненої
речовини розчинника.
-
відповідно кількість молів розчиненої
речовини розчинника.
Алгоритм розв’язання
Визначити умови задачі.
Вибрати відповідну з приведених формулу.
Підставити в неї дані задачі і зробити розрахунки.
Приклад розв’язання задачі.
Визначити C%,
CM,
CH,
Cm
фосфатної кислоти, якщо 18 г H3PO4
розчинили у 282 см3
води. Визначити тітр розчину,
якщо
його
![]() =1,031г/см3.
=1,031г/см3.
Умови задачі m1=18г,
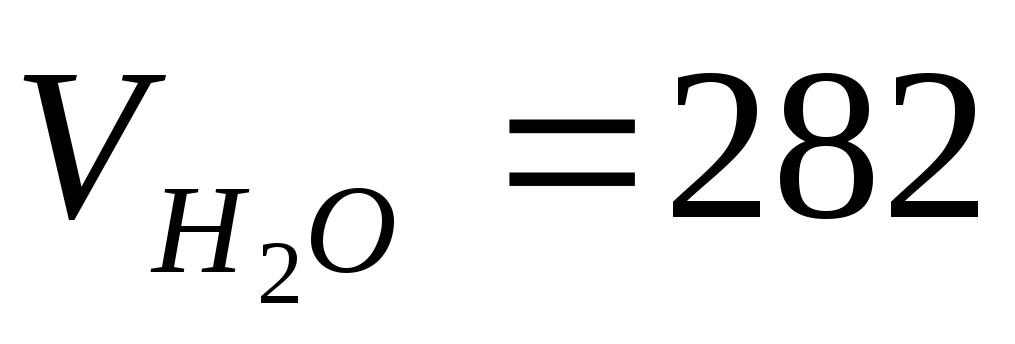 см3,
см3,
 =1,031
г/см3,
якщо
=1,031
г/см3,
якщо
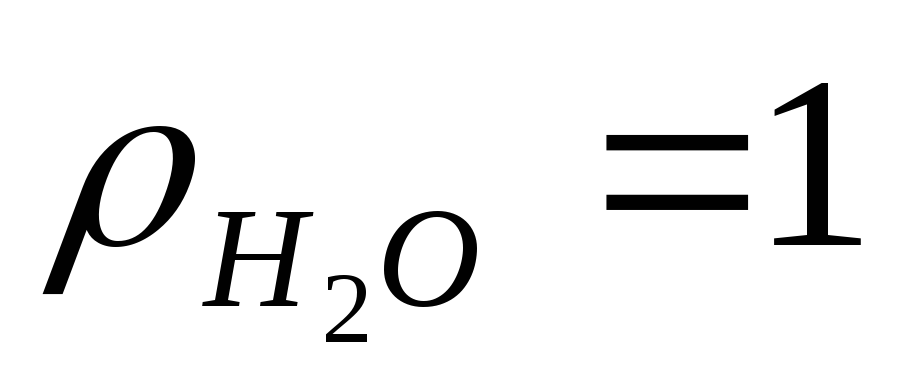 г/см3
г/см3
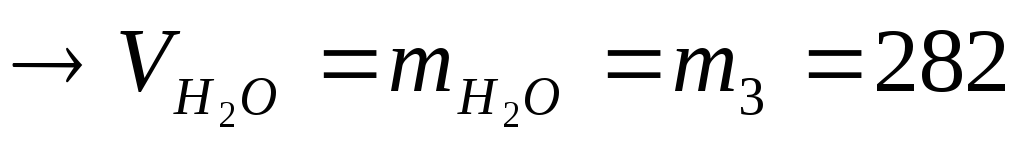 г;m2=m1+m3=18+282=300
г.
г;m2=m1+m3=18+282=300
г.Згідно формул 3,4,5,6,7,8 зробимо розрахунки:
![]()
![]() г/моль,
г/моль,
![]() г/моль
г/моль
З формули (8)
![]() мл
мл
![]() моль/л
моль/л
![]() моль/л
моль/л
![]() моль/кг
моль/кг
![]() г/см3
г/см3
Методика рішення задач з теми «Колігативні властивості розчинів»
Щоб розв’язати задачі з цієї теми, треба знати закони Рауля та їх математичний запис.
Для розчинів неелектролітів: електролітів:
![]() (1),
(1),
![]() (3)
(3)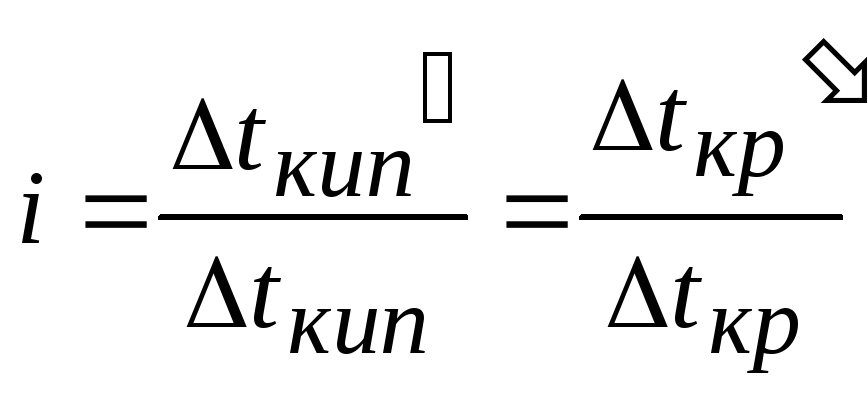
![]() (2);
(2);
![]() (4)
(4)
В цих
формулах
![]() -
зниження температури кристалізації,
-
зниження температури кристалізації,
![]() -
підвищення температури кипіння розчину
відповідно неелектроліту та електроліту
в порівнянні з чистим розчинником,
-
підвищення температури кипіння розчину
відповідно неелектроліту та електроліту
в порівнянні з чистим розчинником,
Ккр, Кеб –відповідно кріоскопічна і ебуліоскопічна константи розчинника,
m1, M – маса та молярна маса речовини, mр – маса розчинника, 1000 – якщо m1 і mр в грамах,
i – ізотонічний коефіцієнт.
Користуючись цими формулами можна знайти M, C%, Kеб, Ккр.
Алгоритм розв’язання задач
Визначити умови задачі.
Вибрати формулу відповідно умови.
Підставити в формулу дані задачі та зробити розрахунки.
Приклад розв’язання задачі.
Визначити
температуру кристалізації (![]() )
та кипіння (
)
та кипіння (![]() )
15% водного розчину пропанолу С3Н7ОН
(М=60 г/моль), якщо
)
15% водного розчину пропанолу С3Н7ОН
(М=60 г/моль), якщо
![]() 0,
0,
![]() 0.
0.
За алгоритмом:
Є 15% розчин С3Н7ОН, також Кеб., Ккр..
Для розв’язання задачі використаємо формули (1) і (2).
Підставимо данні в ці формули:
15% розчин – це означає, що в 100 розчину є m1 - 15 г С3Н7ОН і mр - 85 г Н2О.
![]() ;
;
![]()
![]() ;
;
![]()
Методика рішення задач з теми “Розчини сильних та слабких електролітів. Визначення рН розчинів”.
Щоб розв’язати задачи з цієї теми, треба знати закон Оствальда, та його математичний запис для слабких електролітів:
![]() (1)
(1)
![]() (2)
(2)
![]() та i
зв’язані між собою співвідношенням
та i
зв’язані між собою співвідношенням
![]() ,
(3)
,
(3)
де КД - константа дисоціації,
СМ – молярна концентрація розчину,
![]() - ступінь
дисоціації,
- ступінь
дисоціації,
![]() -
ізотонічний коефіцієнт,
-
ізотонічний коефіцієнт,
n - число іонів, утворених при дисоціації молекул електроліту,
(слабкі електроліти мають α<2%, КД<10-5, сильні електроліти мають α>30%, КД>10-2).
Для розв’язання розрахункових задач з визначення характеру реакції розчину користуються формулами:
[H+]·[H-]=10-14 (5) ;
рН=-lg[H+] (6),
якщо рН<7, [H+]>10-7 моль/л – середовище кисле; pH=7, [H+]10-7 моль/л – нейтральне; pH7, [H+]10-7 моль/л – лужне;
рОН=-lg[OH-] (7);
рН+рОН=14 (8).
