
- •Бугрім с.П.
- •§ 1.1. Закони збереження матерії, сталості сполук, Авогадро 8
- •Стехіометричні закони хімії
- •§1.1. Закони збереження матерії, сталості сполук, авогадро, кратних співвідношень, об’ємних відносин
- •1. В одному молі речовини міститься 6, 02 ∙10 23 молекул. Значення 6, 02 ∙ 10 23 моль –1 називають числом Авогадро (na).
- •2. Один моль будь-якого газу за нормальних умов (н.У.) (00с чи 273 k), 1,03 105 Па) займає об’єм 22,4 л.
- •§1.2. Еквівалент. Закон еквівалентних відносин
- •§ 2.1. Теорії з будови атома
- •§ 2.2. Квантові числа
- •§ 2.3. Принципи заповнення атомних орбіталей
- •§ 3.1. Періодичний закон д.І.Менделєєва
- •§ 3.2. Закономірності періодичної системи
- •§ 4.1. Основні поняття хімічної термодинаміки
- •§ 4.2. Перший закон термодинаміки
- •§ 4.3. Закон гесса
- •§ 4.4. Другий закон термодинаміки. Енергія гіббса
- •§ 5.1. Визначення швидкості хімічної реакції
- •§ 5.2. Фактори, що впливають на швидкість хімічної реакції
- •1. Залежність швидкості хімічної реакції від природи реагуючих речовин.
- •4. Залежність швидкості хімічної реакції від температури
- •5. Залежність швидкості хімічної реакції від каталізатору
- •§ 5.3. Хімічна рівновага. Принцип лє-шательє
- •§ 6.1. Характеристика розчинів та способи вираження їхнього складу
- •§6.2.Властивості розбавлених розчинів неелектролітів
- •§ 6.3. Загальні уявлення з теорії електролітичної дисоціації
- •Електроліти (за зарядом йону)
- •§ 6.4. Електролітична дисоціація води. РН розчинів
- •§ 6.5. Гідроліз
- •§ 7.1. Будова комплексних сполук
- •Внутрішня сфера зовнішня сфера
- •Залежність кч від заряду ца
- •1. Кс, що містять ліганди молекулярного типу
- •2. Кс, що містять ліганди йонного типу
- •4. Змішані комплекси
- •§ 7.2. Властивості комплексних сполук
- •§ 8.1. Перебіг окисно-відновних реакцій
- •§ 8.2. Електродний потенціал
- •§ 8.3. Рівняння нернста
- •§ 9.1. Робота гальваничного елементу
- •§ 9.2. Акумулятори. Паливні елементи
- •§ 10.1. Класифікація корозійних процесів
- •§ 10.2. Хімічна та електрохімічна корозія
- •§ 10.3. Захист металів від корозії
- •§ 11.1. Електродні процеси при електролізі
- •§ 11.2. Закони фарадея
- •Методика рішення типових задач з теми “Еквівалент. Закон еквівалентів”
- •Алгоритм розв’язання задач
- •Приклад роз’язання задачі.
- •Методика рішення типових задач з теми: «Хімічна термодинаміка»
- •Алгоритм розв’язання.
- •Приклад розв’язання задачі.
- •Згідно алгоритму:
- •Методика рішення задач з теми «Розчини. Способи визначення концентрації»
- •Алгоритм розв’язання
- •Алгоритм розв’язання задач
- •Приклад розв’язання задачі за алгоритмом
- •Методика рішення задач з теми «Гальванічні елементи»
- •Алгоритм розв’язання задач
- •Приклад розв’язання задачі за алгоритмом
- •Методика рішення задач з теми «Електрохімічна корозія металів»
- •Алгоритм розв’язання задачі
- •Приклад розв’язання задачі
- •Контрольні завдання еквіваленти й еквівалентні маси простих і складних речовин. Закон еквівалентів
- •Будова атому
- •Енергетика хімічних процесів Стандартні теплоти (ентальпії) утворення деяких речовин
- •Хімічна спорідненість Стандартна енергія Гіббса утворення деяких речовин
- •Стандартні абсолютні ентропії деяких речовин
- •Хімічна кінетика та рівновага
- •Способи вираження концентрації розчину
- •Властивості розчинів
- •Іонно-молекулярні (іонні) реакції обміну
- •Окисно-відновні реакції
- •Електродні потенціали й електрорушійні сили Стандартні електродні потенціали (е°) деяких металів (ряд напруг м. М. Бєкєтова)
- •Електроліз
- •Корозія металів
§ 9.1. Робота гальваничного елементу
Хімічні джерела струму(ХДС) - це гальванічні елементи, акумулятори і паливні елементи (ПЕ). Їх використовують як автономні малогабаритні джерела енергії для транспортних двигунів і машин, радіотехнічних пристроїв, приладів керування, висвітлення і тощо. До достоїнств сучасних ХДС можна віднести відносно високі ККД і питому потужність. Це дозволяє їм конкурувати з іншими видами джерел енергії.
Щоб створювати і правильно використовувати ХДС, необхідно знати закономірності перебігу електрохімічних процесів, в основі яких є реакції ОВР.
Гальванічними елементами (ГЕ) називаються пристрої, що перетворюють енергію ОВР в електричну.Вони звичайно складаються з двох електродів (анода і катода), виготовлених з різних металів чи їхніх сполук, занурених в електроліти (розчини солей, кислот, лугів та струмопровідні пасти).
Анод (А) – це електрод, на якому відбувається процес окиснення – відщеплення електронів.
Катод (К) – це електрод, на якому відбувається процес відновлення – приєднання електронів.
Елемент Даніеля-Якобі є одним з найпростіших і найрозповсюдженіших гальванічних елементів. Він, наприклад, складається з цинкового і мідного електродів, занурених відповідно в розчини сульфату цинку і сульфату міді. Розчини солей, розділені пористою чи напівпроникною перегородкою, з'єднані електролітичним містком:
1-а стадія роботи ГЕ: розчинення (окиснення) електрода, виготовленого з більш активного металу (анода);
Zn0 + nН2O - 2ē → Zn2+·nН2O
Zn0 - 2ē → Zn2+;
2-а стадія роботи
ГЕ– це проходження електричного
струму (спрямований потік ē) по металевому
провіднику. Якщо цинк і мідь з'єднати
провідником, то електрони будуть
переміщуватися від цинкового анода
(А![]() )
до мідного катода ( К+);
)
до мідного катода ( К+);
3-я стадія роботи ГЕ – на поверхні катода відбувається розрядка (відновлення) йонівСu+2:
Cu2+·nH2O + 2ē → Cu0 + nH2O
Cu2++ 2ē → Cu0.
Щоб ГЕ працював,
необхідно, щоб дві ізольовані системи
були з'єднані електролітичним містком
(агар-агар+KCl) чи напівпроникною
перегородкою, по яких від К+до А![]() будуть переміщатися йони SO4
будуть переміщатися йони SO4![]() .
Усі стадії процесів, що проходять у ГЕ,
зв'язані між собою і проходять з однаковою
швидкістю.
.
Усі стадії процесів, що проходять у ГЕ,
зв'язані між собою і проходять з однаковою
швидкістю.
Схема роботи гальванічного елемента:
(![]() А) Zn
│ ZnSO4
││CuSO4
│Cu
(K+)
, якщо[Zn2+]=[Cu2+]=1моль/л.
А) Zn
│ ZnSO4
││CuSO4
│Cu
(K+)
, якщо[Zn2+]=[Cu2+]=1моль/л.
Анодний процес. А: Zn0- 2ē → Zn2+ E0A= -0,76 (B).
Катодний процес. К: Cu2++ 2ē → Cu0E0K= +0,34 (B).
Й онне
рівняння: Zn + Cu+2→ Zn+2+
Cu0.
онне
рівняння: Zn + Cu+2→ Zn+2+
Cu0.
SO42- SO42-
Молекулярне рівняння: Zn + CuSO4→ ZnSO4+ Cu,
ЕРС=Е0 - ЕВ=ЕК-ЕА=0.34-(-0.76)=1.18 (В).
У
гальванічній парі анодом (А![]() )
завжди буде електрод з меншим значенням
електродного потенціалу (Е), а катодом
(К+)
– електрод з більшим значенням Е.
)
завжди буде електрод з меншим значенням
електродного потенціалу (Е), а катодом
(К+)
– електрод з більшим значенням Е.
Робота з переносу електронів у зовнішньому ланцюзі та йонів у внутрішньому ланцюзі в ГЕ дорівнює добутку перенесеного заряду (n.F) на різницю потенціалів (ΔE). Максимальне значення роботи (Амах) досягається, коли ГЕ працює оборотно. У цьому випадкуАмах=n.F. ΔE. Для стандартних умовАмахдля елемента Даніеля-Якобі становить:
Амах=n.F. ΔE=2.96500.1,1=212,46 кДж.
Максимально корисна робота, яку може зробити система при перебігу реакції в умовах постійного тиску і температури, дорівнює збитку енергії Гіббса (більш докладно це питання розглядається в лекції з термодинаміки):
Амах= -ΔG0298
ΔG = -nFΔE,
де n – число електронів, що беруть участь у процесі; F – число Фарадея;
Δ Е = ЕРС.
Це рівняння встановлює зв'язок між хімічною й електричною енергіями. ЕРС ГЕ подібно ΔGможе служити критерієм рівноваги і можливості самовільного перебігу окислювально-відновних реакцій у певному напрямку: за цієї умови самовільний перебіг процесу (ΔG<0) відповідає умовіΔЕ>0. Критерієм рівноваги (ΔG=0) є рівність ЕРС ГЕ нулю.
З урахуванням останнього рівняння Нернста набуває вигляду:
ЕРС=
ΔЕ= (RT/n.F).ln![]() ,
,
де
![]() –
термодинамічна константа рівноваги
струмоутворюючої реакції. Це рівняння
дозволяє розраховувати константу
рівноваги
–
термодинамічна константа рівноваги
струмоутворюючої реакції. Це рівняння
дозволяє розраховувати константу
рівноваги
![]() будь-якої струмоутворюючої ОВР.
будь-якої струмоутворюючої ОВР.
Задача.Чи буде працювати ГЕ, що складається з нікелевого електрода, зануреного в розчинNiSO4 з концентрацією 0,01 моль/л і стандартного залізного електрода? Складіть схему, напишіть рівняння електродних процесів, розрахуйте ЕРС іΔG0298елемента і зробіть висновок про можливість його роботи.
Розв’язок.Визначаємо потенціали електродів. Для
стандартного залізного електрода
потенціал знаходимо в ряді напруг
металів.![]() Для нікелевого електрода обчислюємо
потенціал за рівнянням Нернста.
Для нікелевого електрода обчислюємо
потенціал за рівнянням Нернста.
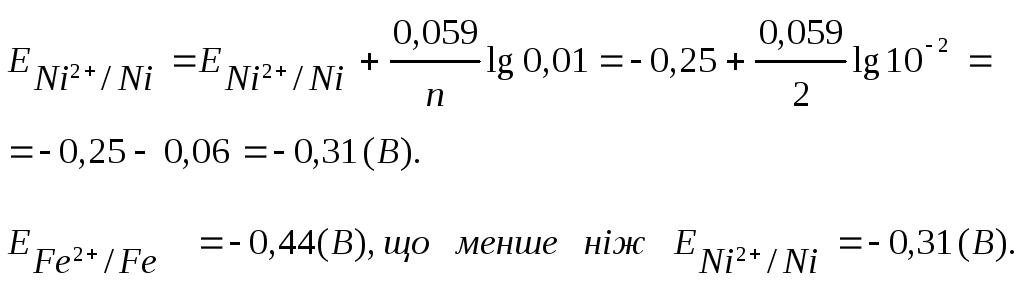
отже, у ГЕ анодом є Ферум, а катодом – Нікол.
Запишемо схему ГЕ:
(![]() А)Fe
│ FeSO4
,С=
1моль/л
││ NiSO4,
С= 10-2
моль/л │ Ni
(K+).
А)Fe
│ FeSO4
,С=
1моль/л
││ NiSO4,
С= 10-2
моль/л │ Ni
(K+).
З апишемо
рівняння електродних процесів:
апишемо
рівняння електродних процесів:
А: Fe0 - 2ē → Fe2+ окислювання ЕА=-0,44 (В)
K: Ni2++ 2ē → Ni0 відновлення ЕК=-0,31 (В)

Fe + Ni2+ → Fe2++ Ni0
SO4![]() SO4
SO4![]()
F e
+ NiSO4
→ FeSO4
+ Ni
e
+ NiSO4
→ FeSO4
+ Ni
ЕРС=Е0 - ЕВ=-0,31+0,44=0,13(В).
Для обчислення зміни енергії Гіббса скористаємося формулою:
ΔG = -nFΔE= -2∙ 96500∙ 0,13 = -25090 Дж = -25,09 КДж, ΔG<0.
Цей ГЕ буде працювати, хоча і має малу ЕРС.
