
- •Бугрім с.П.
- •§ 1.1. Закони збереження матерії, сталості сполук, Авогадро 8
- •Стехіометричні закони хімії
- •§1.1. Закони збереження матерії, сталості сполук, авогадро, кратних співвідношень, об’ємних відносин
- •1. В одному молі речовини міститься 6, 02 ∙10 23 молекул. Значення 6, 02 ∙ 10 23 моль –1 називають числом Авогадро (na).
- •2. Один моль будь-якого газу за нормальних умов (н.У.) (00с чи 273 k), 1,03 105 Па) займає об’єм 22,4 л.
- •§1.2. Еквівалент. Закон еквівалентних відносин
- •§ 2.1. Теорії з будови атома
- •§ 2.2. Квантові числа
- •§ 2.3. Принципи заповнення атомних орбіталей
- •§ 3.1. Періодичний закон д.І.Менделєєва
- •§ 3.2. Закономірності періодичної системи
- •§ 4.1. Основні поняття хімічної термодинаміки
- •§ 4.2. Перший закон термодинаміки
- •§ 4.3. Закон гесса
- •§ 4.4. Другий закон термодинаміки. Енергія гіббса
- •§ 5.1. Визначення швидкості хімічної реакції
- •§ 5.2. Фактори, що впливають на швидкість хімічної реакції
- •1. Залежність швидкості хімічної реакції від природи реагуючих речовин.
- •4. Залежність швидкості хімічної реакції від температури
- •5. Залежність швидкості хімічної реакції від каталізатору
- •§ 5.3. Хімічна рівновага. Принцип лє-шательє
- •§ 6.1. Характеристика розчинів та способи вираження їхнього складу
- •§6.2.Властивості розбавлених розчинів неелектролітів
- •§ 6.3. Загальні уявлення з теорії електролітичної дисоціації
- •Електроліти (за зарядом йону)
- •§ 6.4. Електролітична дисоціація води. РН розчинів
- •§ 6.5. Гідроліз
- •§ 7.1. Будова комплексних сполук
- •Внутрішня сфера зовнішня сфера
- •Залежність кч від заряду ца
- •1. Кс, що містять ліганди молекулярного типу
- •2. Кс, що містять ліганди йонного типу
- •4. Змішані комплекси
- •§ 7.2. Властивості комплексних сполук
- •§ 8.1. Перебіг окисно-відновних реакцій
- •§ 8.2. Електродний потенціал
- •§ 8.3. Рівняння нернста
- •§ 9.1. Робота гальваничного елементу
- •§ 9.2. Акумулятори. Паливні елементи
- •§ 10.1. Класифікація корозійних процесів
- •§ 10.2. Хімічна та електрохімічна корозія
- •§ 10.3. Захист металів від корозії
- •§ 11.1. Електродні процеси при електролізі
- •§ 11.2. Закони фарадея
- •Методика рішення типових задач з теми “Еквівалент. Закон еквівалентів”
- •Алгоритм розв’язання задач
- •Приклад роз’язання задачі.
- •Методика рішення типових задач з теми: «Хімічна термодинаміка»
- •Алгоритм розв’язання.
- •Приклад розв’язання задачі.
- •Згідно алгоритму:
- •Методика рішення задач з теми «Розчини. Способи визначення концентрації»
- •Алгоритм розв’язання
- •Алгоритм розв’язання задач
- •Приклад розв’язання задачі за алгоритмом
- •Методика рішення задач з теми «Гальванічні елементи»
- •Алгоритм розв’язання задач
- •Приклад розв’язання задачі за алгоритмом
- •Методика рішення задач з теми «Електрохімічна корозія металів»
- •Алгоритм розв’язання задачі
- •Приклад розв’язання задачі
- •Контрольні завдання еквіваленти й еквівалентні маси простих і складних речовин. Закон еквівалентів
- •Будова атому
- •Енергетика хімічних процесів Стандартні теплоти (ентальпії) утворення деяких речовин
- •Хімічна спорідненість Стандартна енергія Гіббса утворення деяких речовин
- •Стандартні абсолютні ентропії деяких речовин
- •Хімічна кінетика та рівновага
- •Способи вираження концентрації розчину
- •Властивості розчинів
- •Іонно-молекулярні (іонні) реакції обміну
- •Окисно-відновні реакції
- •Електродні потенціали й електрорушійні сили Стандартні електродні потенціали (е°) деяких металів (ряд напруг м. М. Бєкєтова)
- •Електроліз
- •Корозія металів
§ 6.5. Гідроліз
Гідроліз – це хімічна взаємодія води із солями. Гідроліз солей зводиться до процесу передачі протонів. У результаті його перебігу з'являється деякий надлишок водневих чи гідроксильних йонів, що надають розчину кислотні чи лужні властивості. Таким чином, гідроліз протилежний процесу нейтралізації.
Гідролізу піддаються всі солі, утворені за участю слабких електролітів:
1. Сіль, утворена аніоном слабких кислот і катіоном сильних основ: [CH3COONa, NaClО, KNO2, Na2CO3, Na3PO4]
CH3COONa
+ HOH
CH3COOH
+ NaOH CH3COO![]() + НОН
CH3COOН
+ OH
+ НОН
CH3COOН
+ OH![]() (гідроліз за аніоном), рН
> 7.
(гідроліз за аніоном), рН
> 7.
Аніони слабких
кислот виконують функцію основ стосовно
води – донору протонів, що приводить
до збільшення концентрації ОН![]() ,
тобто підлужуванню середовища. Глибина
перебігу гідролізу визначається:
ступенем гідролізуГ:
,
тобто підлужуванню середовища. Глибина
перебігу гідролізу визначається:
ступенем гідролізуГ:
![]() ,
,
де ![]() –
концентрація солі, як піддалася гідролізу;
–
концентрація солі, як піддалася гідролізу;
![]() – вихідна концентрація солі.
– вихідна концентрація солі.
Ступінь гідролізу
Гневелика, наприклад, для 0,1 моль/л розчинуCH3COONa при 298 К
дорівнює 10![]() .
.
При гідролізі в
системі встановлюється рівновага, що
характеризується
![]() :
:
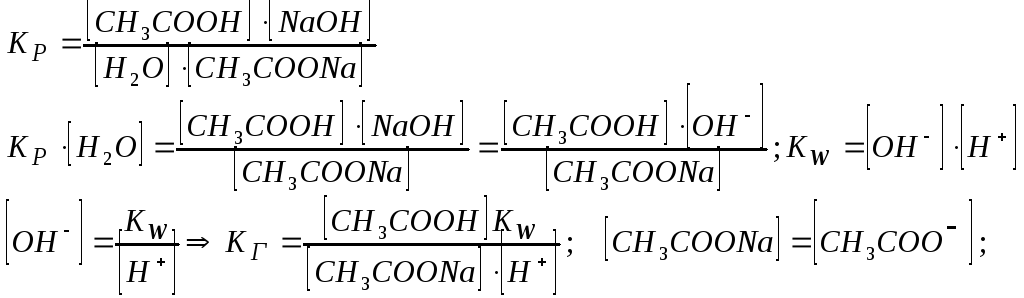
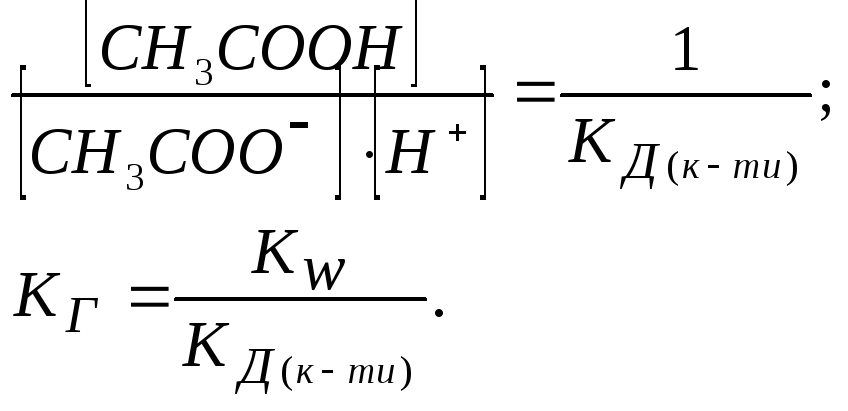 .
.
Отже, чим менша константа дисоціації, тим більша константа гідролізу. Ступінь гідролізу з константою гідролізу зв'язана рівнянням:
![]() .
.
Зі збільшенням розведення, тобто зменшенням С0, ступінь гідролізу збільшується.
2.Сіль, утворена катіоном слабких основ і аніоном сильних кислот: [NH4Cl, AgNO3, ZnCl2, Fe2(SO4)3];
NH4Cl + HOH ↔ NH4OH + НCl;
NH4+ + HOH ↔ NH4OH + H+ (гідроліз за катіоном), pН < 7.
Протолітична рівновага зміщена вліво, катіон слабкої основи NH4+виконує функцію кислоти стосовно води, що приводить до підкислення середовища. Константа гідролізу визначається за рівнянням:
![]() .
.
Рівноважна концентрація йонів водню може бути розрахована: [Н+]рівн = Г С0 (С0 -вихідна концентрація солі),
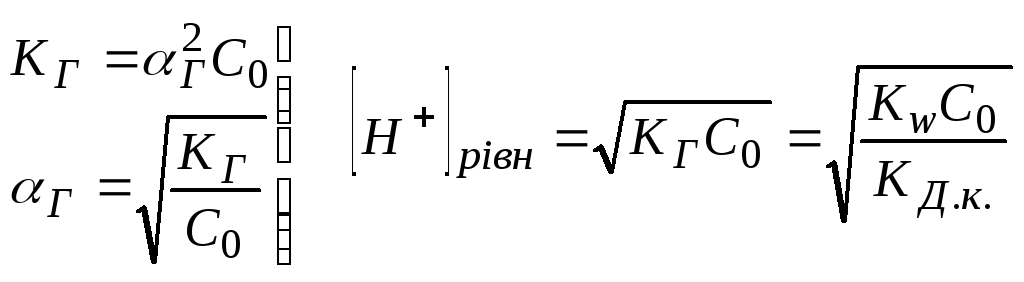 ;
;
![]() .
.
Кислотність середовища залежить від вихідної концентрації солей подібного типу.
3. Сіль, утворена аніоном слабких кислот і катіоном слабких основ. Гідролізується за катіоном і за аніоном: [NH4CN, CH3COONH4, (NH4)2S, (NH4)2CO3, (NH4)3PO4, ZnS, AlPO4, Al(CH3COO)3].
NH4CN
+ HOH
![]() NH4OH
+ HCN
NH4OH
+ HCN
Для визначення рН середовища розчину порівнюють КД,кзКД,осн:
КД,к > КД,осн середовище слабо кисле;
КД,к < КД,осн середовище слабо лужне;
КД,к = КД,осн середовище нейтральне.
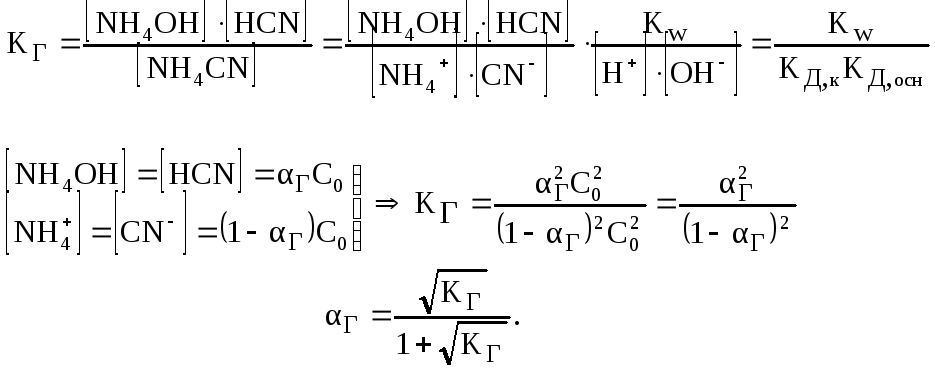
Отже, ступінь гідролізу цього виду солей не залежить від їх концентрації в розчині.
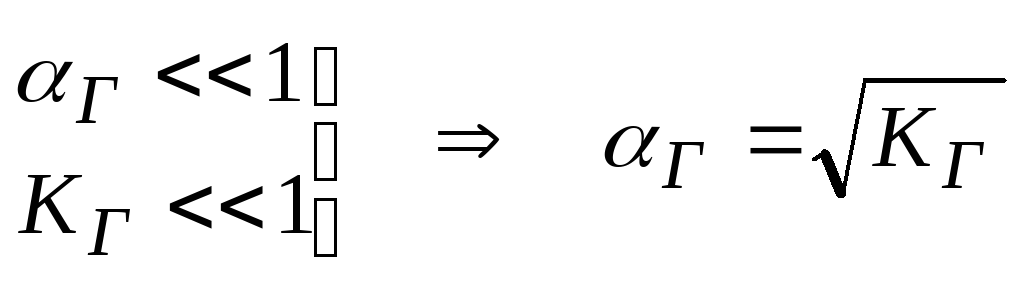 ,
,
оскільки
[H+]
і [ОН![]() ]
визначаються КД,к
і КД,осн,
то
]
визначаються КД,к
і КД,осн,
то
![]() ,
,
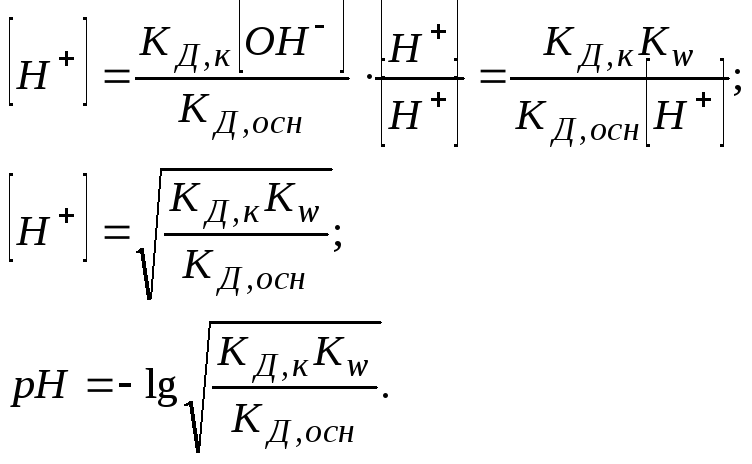
рН розчину також не залежить від концентрації солі в розчині.
Солі, утворені багатозарядним аніоном і однозарядним катіоном, наприклад, сульфіди, карбонати, фосфати амонію, практично цілком гідролізуються за першим ступенем, тобто знаходяться в розчині у виді суміші слабкої основи NH4OH і її соліNH4HS, тобто у виді амонійного буфера.
Для солей, утворених багатозарядним катіоном і однозарядним аніоном (ацетати, форміати Al, Mg, Fe, Cu), гідроліз підсилюється при нагріванні і приводить до утворення основних солей.
Гідроліз нітратів, гіпохлоритів, гіпобромитів Al, Mg, Fe, Cu протікає цілком і необоротно, тобто солі не виділені з розчинів.
Солі: ZnS, AlPO4, FeCO3та ін. у воді малорозчинні, проте частина їх йонів бере участь у процесі гідролізу, це приводить до деякого зростання їх розчинності.
Сульфіди хрому й алюмінію гідролізуються цілком і необоротно з утворенням відповідних гідроксидів.
4. Солі, утворені аніоном сильних кислот і сильних основ, гідролізу не піддаються: [KCl, Na2SO4, Ba(NO3)2].
Найчастіше гідроліз – шкідливе явище, що викликає різні ускладнення. Так, під час синтезу неорганічних речовин з водних розчинів в одержуваній речовині з'являються домішки – продукти її гідролізу. Деякі сполуки взагалі не вдається синтезувати, через те що гідроліз проходить необоротно.
- Якщо гідроліз протікає по аніону, то в розчин додають надлишок лугу;
- Якщо гідроліз протікає по катіону, то в розчин додають надлишок кислоти.
Питання для самоконтролю
1.Які речовини відносяться до електролітів?
2.Загальні уявлення про теорію електролітичної дисоціації.
2.1.Що таке ступінь дисоціації?
2.2.Наведіть вираз константи дисоціації.
2.3.Що поєднує закон Оствальда?
3. Електролітична дисоціація води.
3.1.Який вираз йонного добутка води?
3.2. На що вказує водневий показник (рН)?
3.3.За допомогою яких речовин можна визначити рН розчину?
4. Які властивості мають буферні розчини та чому?
5. Чому розчини різних солей мають неоднакове значення рН?
Р о з д і л 7
КОМПЛЕКСНІ СПОЛУКИ
