
- •Бугрім с.П.
- •§ 1.1. Закони збереження матерії, сталості сполук, Авогадро 8
- •Стехіометричні закони хімії
- •§1.1. Закони збереження матерії, сталості сполук, авогадро, кратних співвідношень, об’ємних відносин
- •1. В одному молі речовини міститься 6, 02 ∙10 23 молекул. Значення 6, 02 ∙ 10 23 моль –1 називають числом Авогадро (na).
- •2. Один моль будь-якого газу за нормальних умов (н.У.) (00с чи 273 k), 1,03 105 Па) займає об’єм 22,4 л.
- •§1.2. Еквівалент. Закон еквівалентних відносин
- •§ 2.1. Теорії з будови атома
- •§ 2.2. Квантові числа
- •§ 2.3. Принципи заповнення атомних орбіталей
- •§ 3.1. Періодичний закон д.І.Менделєєва
- •§ 3.2. Закономірності періодичної системи
- •§ 4.1. Основні поняття хімічної термодинаміки
- •§ 4.2. Перший закон термодинаміки
- •§ 4.3. Закон гесса
- •§ 4.4. Другий закон термодинаміки. Енергія гіббса
- •§ 5.1. Визначення швидкості хімічної реакції
- •§ 5.2. Фактори, що впливають на швидкість хімічної реакції
- •1. Залежність швидкості хімічної реакції від природи реагуючих речовин.
- •4. Залежність швидкості хімічної реакції від температури
- •5. Залежність швидкості хімічної реакції від каталізатору
- •§ 5.3. Хімічна рівновага. Принцип лє-шательє
- •§ 6.1. Характеристика розчинів та способи вираження їхнього складу
- •§6.2.Властивості розбавлених розчинів неелектролітів
- •§ 6.3. Загальні уявлення з теорії електролітичної дисоціації
- •Електроліти (за зарядом йону)
- •§ 6.4. Електролітична дисоціація води. РН розчинів
- •§ 6.5. Гідроліз
- •§ 7.1. Будова комплексних сполук
- •Внутрішня сфера зовнішня сфера
- •Залежність кч від заряду ца
- •1. Кс, що містять ліганди молекулярного типу
- •2. Кс, що містять ліганди йонного типу
- •4. Змішані комплекси
- •§ 7.2. Властивості комплексних сполук
- •§ 8.1. Перебіг окисно-відновних реакцій
- •§ 8.2. Електродний потенціал
- •§ 8.3. Рівняння нернста
- •§ 9.1. Робота гальваничного елементу
- •§ 9.2. Акумулятори. Паливні елементи
- •§ 10.1. Класифікація корозійних процесів
- •§ 10.2. Хімічна та електрохімічна корозія
- •§ 10.3. Захист металів від корозії
- •§ 11.1. Електродні процеси при електролізі
- •§ 11.2. Закони фарадея
- •Методика рішення типових задач з теми “Еквівалент. Закон еквівалентів”
- •Алгоритм розв’язання задач
- •Приклад роз’язання задачі.
- •Методика рішення типових задач з теми: «Хімічна термодинаміка»
- •Алгоритм розв’язання.
- •Приклад розв’язання задачі.
- •Згідно алгоритму:
- •Методика рішення задач з теми «Розчини. Способи визначення концентрації»
- •Алгоритм розв’язання
- •Алгоритм розв’язання задач
- •Приклад розв’язання задачі за алгоритмом
- •Методика рішення задач з теми «Гальванічні елементи»
- •Алгоритм розв’язання задач
- •Приклад розв’язання задачі за алгоритмом
- •Методика рішення задач з теми «Електрохімічна корозія металів»
- •Алгоритм розв’язання задачі
- •Приклад розв’язання задачі
- •Контрольні завдання еквіваленти й еквівалентні маси простих і складних речовин. Закон еквівалентів
- •Будова атому
- •Енергетика хімічних процесів Стандартні теплоти (ентальпії) утворення деяких речовин
- •Хімічна спорідненість Стандартна енергія Гіббса утворення деяких речовин
- •Стандартні абсолютні ентропії деяких речовин
- •Хімічна кінетика та рівновага
- •Способи вираження концентрації розчину
- •Властивості розчинів
- •Іонно-молекулярні (іонні) реакції обміну
- •Окисно-відновні реакції
- •Електродні потенціали й електрорушійні сили Стандартні електродні потенціали (е°) деяких металів (ряд напруг м. М. Бєкєтова)
- •Електроліз
- •Корозія металів
4. Залежність швидкості хімічної реакції від температури
Вплив температури на швидкість хімічної реакції приблизно визначається правилом Вант-Гоффа. При підвищенні температури на 100С швидкість хімічної реакції зростає в 2-4 рази.
Математичний запис
правила Вант-Гоффа:
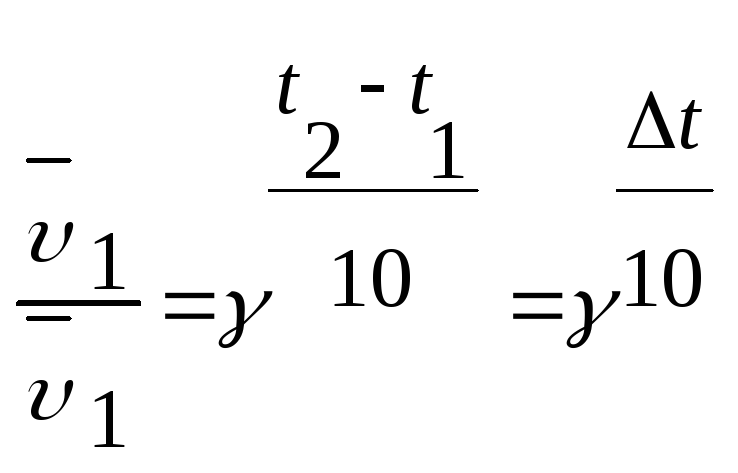 γ- температурний коефіцієнт швидкості
реакції чи коефіцієнт Вант-Гоффа, який
для більшості реакцій лежить у межах
2-4. Він показує, у скільки разів збільшується
швидкість реакції у разі підвищення
температури на кожні 10 градусів.(t=100C).
γ- температурний коефіцієнт швидкості
реакції чи коефіцієнт Вант-Гоффа, який
для більшості реакцій лежить у межах
2-4. Він показує, у скільки разів збільшується
швидкість реакції у разі підвищення
температури на кожні 10 градусів.(t=100C).
Задача. В скільки разів зміниться швидкість хімічної реакції, що протікає в газовій фазі, якщо температура змінилася від 800Сдо 1200С(γ= 3)?
Розв’язок.
Згідно з правилом Вант-Гоффа записуємо:
![]() .
.
Збільшення швидкості
хімічної реакції при підвищенні
температури припускається не тільки
збільшенням кінетичної енергії
взаємодіючих молекул. Наприклад, число
зіткнень молекул росте пропорційно
кореню квадратному з абсолютної
температури![]() . При нагріванні речовин від нуля до ста
градусів за Цельсієм швидкість руху
молекул зростає в 1,2 раза
. При нагріванні речовин від нуля до ста
градусів за Цельсієм швидкість руху
молекул зростає в 1,2 раза![]() , а швидкість хімічної реакції – приблизно
в 59 тисяч разів. Таке різке збільшення
швидкості реакції з ростом температури
з’ясовується часткою активних молекул,
зіткнення яких приводить до хімічної
взаємодії. Відповідно з теорією активних
зіткнень у реакцію вступають тількиактивні молекули,енергія яких
перевищує середню енергію молекул даної
речовини, тобто молекули, що володіють
енергією активації.
, а швидкість хімічної реакції – приблизно
в 59 тисяч разів. Таке різке збільшення
швидкості реакції з ростом температури
з’ясовується часткою активних молекул,
зіткнення яких приводить до хімічної
взаємодії. Відповідно з теорією активних
зіткнень у реакцію вступають тількиактивні молекули,енергія яких
перевищує середню енергію молекул даної
речовини, тобто молекули, що володіють
енергією активації.
Енергія активації (EА)– це той надлишок енергії в порівнянні із середнім запасом, яким повинні володіти молекули для здійснення хімічної реакції. Якщо ЕА< 40 кДж/моль – реакції проходять швидко, якщо ЕА > 120 кДж/моль – реакції не відбуваються за стандартними умовами, якщо ЕА = 40-120 кДж/моль – реакції проходять у звичайних умовах. Підвищення температури збільшує кількість молекул з енергією активації, робить речовини більш реакційноздатними, швидкість взаємодії при цьому збільшується.
Більш точну залежність швидкості хімічної реакції від температури встановив C.Арреніус: константа швидкості реакції пропорційна основі натурального логарифма, зведеного в ступінь (-ЕА/RT).
![]() ,
,
А– предекспоненційний множник, визначає число активних зіткнень;
е – експонента (основа натурального логарифма).
Логарифмуючи
вираження
![]() ,
одержимо рівняння:
,
одержимо рівняння:
![]() .
Рівняння
Арреніуса показує, що швидкість реакції
тим вище, чим менша енергія активації.
Для зниження енергії активації
використовують каталізатори.
.
Рівняння
Арреніуса показує, що швидкість реакції
тим вище, чим менша енергія активації.
Для зниження енергії активації
використовують каталізатори.
5. Залежність швидкості хімічної реакції від каталізатору
Каталізатор– це речовина, що змінює швидкість хімічної реакції, її механізм та енергетику, кількість якої в результаті реакції залишається незмінною. Зміна швидкості хімічної реакції в присутності каталізаторів називаєтьсякаталізом.Реакції, швидкість яких можна змінити за допомогою каталізаторів, називаютьсякаталітичними. Каталізатори, що сповільнюють швидкість хімічної реакції, називаютьсяінгібіторами. Наприклад, тетраетилплюмбумPb(C2H5)4протидіє детонації палива в двигунах внутрішнього згоряння. Речовини, що підсилюють дію каталізатора, називаютьсяпромоторами. Речовини, що придушують дію каталізатора, називаютьсякаталітичними отрутами; біологічні каталізатори називаютьсяферментами.
Механізм дії каталізаторів під час каталітичних реакцій досить складний і може бути різним. Розглянемо лише дещо спрощений та узагальнений варіант механізму. За теорією проміжних сполук каталізатор (К) з одним з реагуючих речовин (А) утворює проміжну сполукуАК( активований комплекс ) з більш низьким значенням енергії активації, здатну до більш ефективної взаємодії з іншою речовиною (В):
А
+ В
![]() АВ;
АВ;
А
+ К
![]() АК;
АК;
АК
+ В
![]() АВ + К.
АВ + К.
Таким чином,
каталізатор розбиває реакцію на проміжні
стадії; при цьому утворюється ряд
нестійких проміжних сполук – активованих
комплексів. Наприклад, самовільний
процес розкладання гідрогену пероксида
йде повільно:Н2О2
![]() Н2О + 1/2О2 ЕА= 75 кДж/моль. Використання каталізатораMnО2збільшує швидкість
реакції (ЕА= 49кДж/моль) за рахунок утворення активованого
комплексуMnО3 :
Н2О + 1/2О2 ЕА= 75 кДж/моль. Використання каталізатораMnО2збільшує швидкість
реакції (ЕА= 49кДж/моль) за рахунок утворення активованого
комплексуMnО3 :
Н2О2
+ MnO2
![]() H2O
+ MnO3
H2O
+ MnO3
M nO3
nO3
![]() MnО2+
1/2O2
MnО2+
1/2O2
H2O2
+ MnO2
![]() H2O
+ MnO2
+ 1/2O2
.
H2O
+ MnO2
+ 1/2O2
.
Каталізатор знижує енергію активації, розбиваючи реакцію на ряд проміжних стадій.
Каталізатор може бути специфічним для однотипних реакцій, наприклад, V2O5прискорює реакції окисненняSO2, NH3і т.д. Він може бути і універсальним, тобто змінювати швидкості різних реакцій, наприклад,
2SO2
+ O2
![]() 2SO3;
CH2 = CH2 + H2
2SO3;
CH2 = CH2 + H2
![]() CH3
– CH3.
CH3
– CH3.
Каталізатор може змінювати не тільки швидкість хімічної реакції, але і її механізм.
