
- •Бугрім с.П.
- •§ 1.1. Закони збереження матерії, сталості сполук, Авогадро 8
- •Стехіометричні закони хімії
- •§1.1. Закони збереження матерії, сталості сполук, авогадро, кратних співвідношень, об’ємних відносин
- •1. В одному молі речовини міститься 6, 02 ∙10 23 молекул. Значення 6, 02 ∙ 10 23 моль –1 називають числом Авогадро (na).
- •2. Один моль будь-якого газу за нормальних умов (н.У.) (00с чи 273 k), 1,03 105 Па) займає об’єм 22,4 л.
- •§1.2. Еквівалент. Закон еквівалентних відносин
- •§ 2.1. Теорії з будови атома
- •§ 2.2. Квантові числа
- •§ 2.3. Принципи заповнення атомних орбіталей
- •§ 3.1. Періодичний закон д.І.Менделєєва
- •§ 3.2. Закономірності періодичної системи
- •§ 4.1. Основні поняття хімічної термодинаміки
- •§ 4.2. Перший закон термодинаміки
- •§ 4.3. Закон гесса
- •§ 4.4. Другий закон термодинаміки. Енергія гіббса
- •§ 5.1. Визначення швидкості хімічної реакції
- •§ 5.2. Фактори, що впливають на швидкість хімічної реакції
- •1. Залежність швидкості хімічної реакції від природи реагуючих речовин.
- •4. Залежність швидкості хімічної реакції від температури
- •5. Залежність швидкості хімічної реакції від каталізатору
- •§ 5.3. Хімічна рівновага. Принцип лє-шательє
- •§ 6.1. Характеристика розчинів та способи вираження їхнього складу
- •§6.2.Властивості розбавлених розчинів неелектролітів
- •§ 6.3. Загальні уявлення з теорії електролітичної дисоціації
- •Електроліти (за зарядом йону)
- •§ 6.4. Електролітична дисоціація води. РН розчинів
- •§ 6.5. Гідроліз
- •§ 7.1. Будова комплексних сполук
- •Внутрішня сфера зовнішня сфера
- •Залежність кч від заряду ца
- •1. Кс, що містять ліганди молекулярного типу
- •2. Кс, що містять ліганди йонного типу
- •4. Змішані комплекси
- •§ 7.2. Властивості комплексних сполук
- •§ 8.1. Перебіг окисно-відновних реакцій
- •§ 8.2. Електродний потенціал
- •§ 8.3. Рівняння нернста
- •§ 9.1. Робота гальваничного елементу
- •§ 9.2. Акумулятори. Паливні елементи
- •§ 10.1. Класифікація корозійних процесів
- •§ 10.2. Хімічна та електрохімічна корозія
- •§ 10.3. Захист металів від корозії
- •§ 11.1. Електродні процеси при електролізі
- •§ 11.2. Закони фарадея
- •Методика рішення типових задач з теми “Еквівалент. Закон еквівалентів”
- •Алгоритм розв’язання задач
- •Приклад роз’язання задачі.
- •Методика рішення типових задач з теми: «Хімічна термодинаміка»
- •Алгоритм розв’язання.
- •Приклад розв’язання задачі.
- •Згідно алгоритму:
- •Методика рішення задач з теми «Розчини. Способи визначення концентрації»
- •Алгоритм розв’язання
- •Алгоритм розв’язання задач
- •Приклад розв’язання задачі за алгоритмом
- •Методика рішення задач з теми «Гальванічні елементи»
- •Алгоритм розв’язання задач
- •Приклад розв’язання задачі за алгоритмом
- •Методика рішення задач з теми «Електрохімічна корозія металів»
- •Алгоритм розв’язання задачі
- •Приклад розв’язання задачі
- •Контрольні завдання еквіваленти й еквівалентні маси простих і складних речовин. Закон еквівалентів
- •Будова атому
- •Енергетика хімічних процесів Стандартні теплоти (ентальпії) утворення деяких речовин
- •Хімічна спорідненість Стандартна енергія Гіббса утворення деяких речовин
- •Стандартні абсолютні ентропії деяких речовин
- •Хімічна кінетика та рівновага
- •Способи вираження концентрації розчину
- •Властивості розчинів
- •Іонно-молекулярні (іонні) реакції обміну
- •Окисно-відновні реакції
- •Електродні потенціали й електрорушійні сили Стандартні електродні потенціали (е°) деяких металів (ряд напруг м. М. Бєкєтова)
- •Електроліз
- •Корозія металів
§ 4.4. Другий закон термодинаміки. Енергія гіббса
Перший закон термодинаміки за своєю суттю є законом збереження. Він дозволяє розраховувати енергетику процесу, однак не вирішує питання про можливість перебігу процесу та його напрямленість . Наприклад, такі нереальні явища, як самочинне стиснення газу чи перехід тепла від холодного тіла до гарячого, не суперечать першому закону термодинаміки.
З досвіду відомо, що самочинно всі процеси проходять з певною спрямованістю, наприклад, самовільно газ поширюється на весь об’єм(Рис. 7).
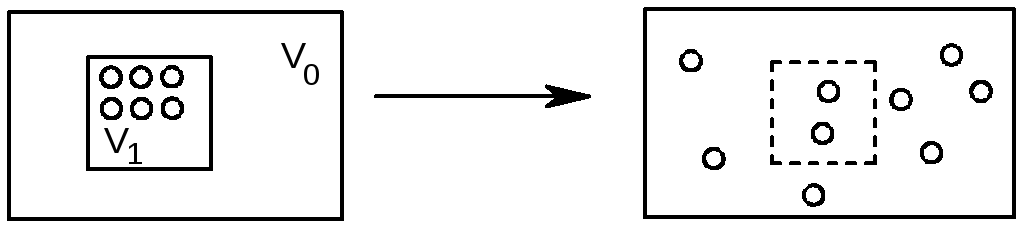
Рис. 7
C амовільно
теплота може переходити від гарячого
тіла (Т2) з більшою енергією
до холодного (Т1) з меншою
енергією до рівноважного стану (Т
амовільно
теплота може переходити від гарячого
тіла (Т2) з більшою енергією
до холодного (Т1) з меншою
енергією до рівноважного стану (Т
1=Т2=Тсер). (Рис. 8).
Рис. 8
Відповідь на питання про можливість перебігу процесу та його напрямок дає другий закон термодинаміки. У підручниках для другого принципу термодинаміки звичайно наводиться безліч формулювань, наприклад:
«Теплота не може самовільно передаватися від більш холодного тіла до більш гарячого» (Клаузіус).
«Теплота найбільш холодного з тіл, що беруть участь у процесі, не може служити джерелом роботи» (Томсон).
«Коефіцієнт корисної дії парової машини завжди менше одиниці» та ін.
Але вони у здебільшого важливі для фізичних процесів. А для хімічних важливо те, що другий принцип термодинаміки дає критерії того, які процеси можуть проходити самовільно, а які не можуть.
Для характеристики більш імовірних процесів у термодинаміці використовують поняття – термодинамічна імовірність, W.
Термодинамічна імовірність W – це кількість мікростанів системи, якими реалізується макростан системи.
Мікростан системи – це таке розташування окремих частинок (молекул) у даний момент часу, що відповідає найбільш стійкому стану системи.
Отже, як критерій можливості перебігу процесу можна використовувати W - термодинамічну імовірність. Вона є функцією стану і максимальна при рівновазі. ОднакWзв'язана з механічними характеристиками системи: швидкістю руху молекул, їх положенням у просторі і т. д. А для хімічної термодинаміки важливо знайти критерій напрямку процесу, обумовлений термодинамічними параметрами:Т, Р, V(температура, тиск, об’єм).
Другий принцип термодинаміки вводить у розгляд новий критерій – ентропію S, що служить мірою енергетичного безладдя в системі.Ентропія зв'язана з термодинамічною імовірністю співвідношенням: S= k.lnW, де k=R/NA 1,381.10-23Дж/град– це константа Больцмана, має розмірність енергії, віднесеної до температури і одній частці. Отже, з її допомогою здійснюється перехід від просто «безладдя» системи до «енергетичного безладдя». У розрахунку на 1 моль часток: S=R.lnW.
Зміна ентропії (S) в процесі визначається зміною числа мікростанів системиS = S2 – S1 = R.ln W2/W1.
Досвід показує, що більшість самовільних процесів проходять з виділенням теплоти (Н0). Але серед них зустрічаються також ендотермічні(Н0). Прикладом є розчинення амонію нітрату у воді:
NH4NO3 (Т) NH4NO3 (Р); Н0х.р. = + 27 кДж/моль.
Виходить, тепловиділення не є вирішальним критерієм можливості самовільного перебігу процесів.
Так само можуть самовільно проходити процеси зі зменшенням ентропії (S0): С(Т) + О2(Г) СО2(Г).Між молекулами карбонуСі киснюО2встановлюється зв'язок, і тому ступінь енергетичного безладдя зменшується.
Який же критерій самовільності – ентальпія(Н)чи ентропія(S)?
Критерієм, що визначає можливість перебігу процесу, є баланс дії ентальпії (Н) і ентропії (S). Тому можливі самовільні процеси з поглинанням теплоти (якщо ріст енергетичного «безладдя» є більш вагомим), і процесиз S0 (якщо це супроводжується більш сильним виділенням теплоти).
Вимірюється зміна ентропії приведеною теплотою оборотногопроцесу, що зв'язує відповідні стани системи:
S = Qобор./Т.
Для необоротнихпроцесів:S Qнеобор./Т(алгебраїчна сума приведених теплот для необоротних процесів:Qнеобор.проц. Qобор .проц.
Математичне формулювання II закону термодинаміки (узагальнена формула) виглядає таким чином:
S Q/T
Для ізольованих систем, де обмін енергією з навколишнім середовищем виключений,Q=0,другий принцип термодинаміки виглядає:S 0.
Таким чином, для ізольованих систем залишається тільки один критерій самовільного перебігу процесів – збільшення ентропії. Самовільними є лише процеси, що ведуть до збільшення загальної ентропії. Отже:
1.Ентропія – це функція стану системи, тому обчислювати зміну ентропії можна аналогічно наслідку із закону Гесса. Ентропія хімічної реакції дорівнює різниці між сумами ентропій продуктів реакції ( Sпрод)і ентропій вихідних речовин ( Sвих.р),з урахуванням стехіометричних коефіцієнтів.
Sх.р. = Sпрод. - Sвих.р., з урахуванням стехіометричних коефіцієнтів.
Задача.Розрахувати зміну ентропії хімічних реакцій(Sх.р.) для процесу:3С2Н2(Г) С6Н6 (Р).
Розв’язок.
Sх.р. = S0 (C6H6 (Р)) – 3 S0 (С2Н2 (Г)).
Sх.р. = 269,2 – 3 . 200,8 = - 333,2 Дж/моль.К.
2.Ентропія виміряється приведеною теплотою.
Задача.Чому дорівнює збільшення ентропії моляFeприТпл=15360С (1809К) при переході з кристалічного в рідкий стан, якщо ентальпіяНпл= 13765Дж/моль.
Розв’язок.
При температурі плавлення Feкр Feр( у рівновазі
T=const = Тпл.).
Sпл = S (Fe (р)) -S (Fe (T)) =Нпл/Тпл= 13765/1809= 7,61 Дж/ моль.К.
S0 процес при Тпл відбувається самовільно.
3. Ентропія є критерієм самовільного перебігу процесів тільки для ізольованих систем. Самовільно проходять в ізольованих системах тільки ті процеси, що йдуть зі збільшенням ентропії.

Рис. 9
4. Sзв'язана з числом можливих мікростанів у системі (тобто з термодинамічною імовірністюW), характеризує міру енергетичного безладдяS= klnWу системі.
5. S – це термодинамічна функція, що на відміну від термодинамічної імовірностіWзв'язана з термодинамічними величинамиQ;T, тобто більш прийнятна для хімічної термодинаміки.
Однак у природних процесах і в техніці частіше зустрічаються системи, що взаємодіють з навколишнім середовищем, тобто неізольовані. Ентропія S мало підходить для характеристики процесів у цих умовах.
Для ізохорно-ізотермічнихумов перший закон термодинаміки має таку математичну форму запису:QV = U (A= РV; V= const A=0).
З II -го закону термодинаміки випливає: S QV /T QV ТS.
Поєднуючи дві математичні форми запису, одержимо: TS U;
U - TS 0.
Позначимо різницю U - TSчерез нову термодинамічну функцію стану –вільну енергію Гельмгольца, U - TS =F.
Отже, II закон термодинаміки стосовно ізохорно-ізотермичних процесівможна записати так: F 0.
Введення даної функції дозволяє користатися лише одним критерієм напрямку процесу (який для ізольованих систем є S). Однак цей чисто формальний прийом не скасовує того факту, що насправді для самовільних процесів залишаються ті ж критерії: НіS.ЧерезFпозначений їхній баланс.
Отже:1. Для ізохорно-ізотермічних умов Fє сумарним критерієм самовільного перебігу процесів
F=U - TS (це вираження об'єднаних I і II законів термодинаміки).
2. Самовільними є такі процеси для ізохорно- ізотермічних умов, у яких енергія Гельмгольца зменшується (F 0).
Стан
рівноваги Закриті
системи за постійних V
і T F
0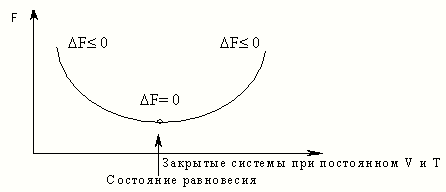
Рис. 10
F0,процеси можуть йти самовільно;
F= 0,процеси займають прикордонне положення, що
характеризується мінімальним значенням F;
F 0, процеси у прямому напрямку самостійно проходити не
можуть.
3.Енергія Гельмгольца є функцією стану системи, тому обчислити зміну енергії Гельмгольца можна також використовуя наслідок із закону Гесса.
Енергія Гельмгольца хімічної реакції дорівнює різниці між сумами енергій Гельмгольца продуктів реакції (F0f,прод) і енергій Гельмгольца вихідних речовин (F0f,вих.р) з урахуванням стехіометричних коефіцієнтів.
Fх.р. = F0f,прод. - F0f,вих.р, з урахуванням стехіометричних коефіцієнтів.
Для ізобарно-ізотермічних умов I-й закон термодинаміки можна записати у вигляді:QP = U + РV; тобто теплота при ізобарно-ізотермічних умовах дорівнює зміні ентальпіїQP = U + pV = H(за умови, що не відбувається ніякої іншої роботи, як проти тиску). ПоєднуючиS QP/T-вираження II закону термодинаміки, одержимо:Н - ТS 0.Якщо вираженняН - ТSпозначити через нову термодинамічну функцію стану –вільну енергію Гіббса, G :
Н - ТS = G,
отже, II -ий принцип термодинаміки, стосовно ізобарно-ізотермічних процесів можна записати так: G 0. G – енергія Гіббса, так само як і енергія Гельмгольца, є лише балансом усіх тих же двох критеріїв самовільного перебігу процесів: виділення теплоти і зростання ентропії. Отже:
1. Для ізобарно-ізотермічних умов Gє сумарним критерієм самовільного перебігу процесівG = Н - ТS( об'єднаний ( I і II ) закон термодинаміки).
2.Процеси, у яких:
G 0, можуть йти самовільно;
G = 0, займають прикордонне (рівноважне) положення;
G 0, самочинний перебіг процесів у прямому напрямку неможлив.
Закриті
системи за постійних Т і Р Стан
рівноваги G
0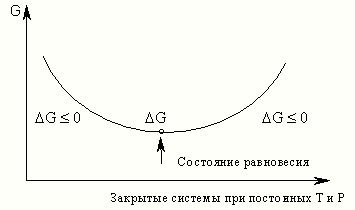
Рис. 11
3. Gє функцією стану системи, тому обчислити зміну енергії Гіббса хімічних реакцій можна аналогічно наслідку із закона Гесса.
Енергія Гіббса хімічних реакцій дорівнює різниці між сумами енергій Гіббса продуктів реакції (G0f,298 прод.) і енергій Гіббса вихідних речовин ( G0f,298 вих.р.) з урахуванням стехіометричних коефіцієнтів.
Gх.р= G0f,298 прод. - G0f,298 вих.р.,з урахуванням стехіометричних коефіцієнтів;
G0f,298(Х)– стандартна енергія Гіббса речовиниХза стандартних умов і у певному агрегатному стані.
Для простих речовин і елементів G0f,298(Х) як і Н0f,298(Х))дорівнюють нулю.
Задача:спиртове шумування відбувається за рівнянням реакції:
С6Н12О6(Р) 2С2Н5(ОН) (Р) + 2СО2(Г)
G0f,298, кДж/моль -915 -174 -394.
Розв’язок.
G0х.р. = 2(-174) + 2(-394) – (-915)= -221 кДж/моль.
Н0х.р. цього процесу становить – 79 кДж/моль. Отже, за рахунок ентропійного внеску здатність шумування робити корисну роботу збільшується майже втроє. Це дуже важливо, тому що подібні процеси є найважливішим джерелом енергії як у багатьох так званих анаеробних організмів, так і у тварин і людини за інтенсивного м'язового навантаження.
4. Функція Gназивається енергією, тому що визначаєпрацездатністьвідповідного процесу. А самеG чисельно дорівнює корисній максимальній роботі, що могла б бути зроблена в ході ізобарно-ізотермічного процесу (дивись с.82).
Питання для самоконтролю
1. Як визначається термодинамічна імовірність?
2. Що за функція стану – ентропія?
3. Сформулюйте II закон термодинаміки.
4. Який має вираз II закон термодинаміки для ізобарних хімічних процесів?
5. Що визначають за зміною енергії Гіббса?
6.За допомогою якого критерію можно стверджувати про можливість
перебігу реакцій в ізольованих системах ?
7.Як можно порахувати зміну ентропії реакції?
8.Як можно порахувати зміну енергії Гіббса реакції?
Р о з д і л 5
ХІМІЧНА КІНЕТИКА
