
Физика для бакалавра Часть 2
..pdf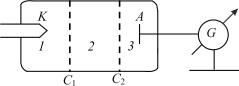
Рис. 28.3
Немецкие физики Д. Франк и Г. Герц, изучая методом задерживающего потенциала столкновения электронов с атомами газов (1913), экспериментально доказали дискретность значений энергии атомов. Принципиальная схема их установки приведена на рис. 28.3. Вакуумная трубка, заполненная парами ртути (давление приблизительно равно 13 Па), содержала катод (K), две сетки (C1 и С2) и анод (А). Электроны, эмитируемые катодом, ускорялись разностью потенциалов, приложенной между катодом и сеткой C1. Между сеткой С2 и анодом приложен небольшой (примерно 0,5 В) задерживающий потенциал. Электроны, ускоренные в области 1, попадают в область 2 между сетками, где испытывают соударения с атомами паров ртути. Электроны, которые после соударений имеют достаточную энергию для преодоления задерживающего потенциала в области 3, достигают анода. При неупругих соударениях электронов с атомами ртути последние могут возбуждаться. Согласно теории Бора, каждый из атомов ртути может получить лишь вполне определенную энергию, переходя при этом в одно из возбужденных состояний. Поэтому если в атомах действительно существуют стационарные состояния, то электроны, сталкиваясь с атомами ртути, должны терять энергию дискретно, определенными порциями, равными разности энергий соответствующих стационарных состояний атома.
Из опыта следует, что при увеличении ускоряющего потенциала вплоть до 4,86 В анодный ток возрастает монотонно, его значение проходит через максимум (4,86 В), затем резко уменьшается и возрастает вновь (рис. 28.4). Дальнейшие максимумы наблюдаются при 2 4,86 и 3 4,86 В.
261
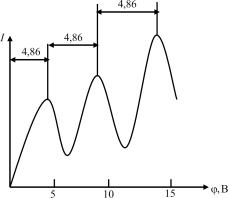
Рис. 28.4
Ближайшим к основному (невозбужденному) состоянию атома ртути является возбужденное состояние, отстоящее от основного по шкале энергий на 4,86 эВ. Пока разность потенциалов между катодом и сеткой меньше 4,86 В, электроны, встречая на своем пути атомы ртути, испытывают с ними только упругие соударения. При eϕ = 4,86 эВ энергия электрона стано-
вится достаточной, чтобы вызвать неупругий удар, при котором электрон отдает атому ртути всю кинетическую энергию, возбуждая переход одного из электронов атома из нормального энергетического состояния на возбужденный энергетический уровень. Электроны, потерявшие свою кинетическую энергию, уже не смогут преодолеть тормозящего поля и достигнуть анода. Этим и объясняется первое резкое падение анодного тока при eϕ = 4,86 эВ. При значениях энергии, кратных 4,86 эВ, элек-
троны могут испытать с атомами ртути 2, 3,... неупругие соударения, потеряв при этом полностью свою энергию, и не достигнуть анода, т.е. должно наблюдаться резкое падение анодного тока. Это действительно наблюдается на опыте (см. рис. 28.4).
Таким образом, опыты Франка и Герца показали, что электроны при столкновении с атомами ртути передают атомам только определенные порции энергии, причем 4,86 эВ – наи-
262

меньшая возможная порция энергии (наименьший квант энергии), которая может быть поглощена атомом ртути в основном энергетическом состоянии. Следовательно, идея Бора о существовании в атомах стационарных состояний блестяще выдержала экспериментальную проверку.
Атомы ртути, получившие при соударении с электронами энергию E, переходят в возбужденное состояние и должны
возвратиться в основное, излучая при этом, согласно второму постулату Бора (см. (28.7)), световой квант с частотой ν = hE .
По известному значению E = 4,86 эВ можно вычислить длину волны излучения: λ ≈ 255 нм. Таким образом, если теория верна, то атомы ртути, бомбардируемые электронами с энергией 4,86 эВ, должны являться источником ультрафиолетового излучения с λ ≈ 255 нм. Опыт действительно обнаруживает одну ультрафиолетовую линию λ ≈ 254 нм. Таким образом, опыты Франка и Герца экспериментально подтвердили не только первый, но и второй постулат Бора. Эти опыты сыграли огромную роль в развитии атомной физики.
28.5. Схема энергетических уровней в атоме водорода
Постулаты, выдвинутые Бором, позволили рассчитать спектр атома водорода и водородоподобных систем – систем, состоящих из ядра с зарядом Ze и одного электрона (например, ионы Не+, Li2+), а также теоретически вычислить постоянную Ридберга.
Следуя Бору, рассмотрим движение электрона в водородоподобной системе, ограничиваясь круговыми стационарными орбитами. Решая совместно уравнение (28.2), предложенное Резерфордом, и уравнение (28.6), получим выражение для радиуса n-й стационарной орбиты:
r |
= n2 |
2 4πε0 |
, |
(28.8) |
|
m Ze2 |
|||||
n |
|
|
|
||
|
|
e |
|
|
|
|
|
|
|
263 |

где n = 1, 2, 3, ... Из выражения (28.8) следует, что радиусы орбит растут пропорционально квадратам целых чисел.
Для атома водорода (Z = l) радиус первой орбиты электрона при n = 1, называемый первым Боровским радиусом (а), рассчи-
тывается по формуле
r |
= a = |
2 4πε0 |
= 0,528 10−10 м = 52,8 пм, |
(28.9) |
|
m e2 |
|||||
n |
|
|
|
||
|
|
e |
|
|
что соответствует расчетам на основании кинетической теории газов. Так как радиусы стационарных орбит измерить невозможно, то для проверки теории необходимо обратиться к таким величинам, которые могут быть измерены экспериментально. Такой величиной является энергия, излучаемая и поглощаемая атомами водорода.
Полная энергия электрона в водородоподобной системе складывается из его кинетической энергии me2v2 и потенциаль-
ной энергии в электростатическом поле ядра −Ze2 :
4πε0r
|
m v2 |
|
Ze2 |
1 Ze2 |
|
E = |
e |
− |
|
= − 2 |
|
2 |
4πε0r |
4πε0r |
|||
|
m v2 |
1 |
|
Ze2 |
|
|
(учли, что |
e |
= 2 |
|
|
|
(см. (28.2)). Учитывая квантован- |
2 |
4πε |
r |
||||
|
|
|
|
0 |
|
|
ные для радиуса n-й стационарной орбиты значения (28.9), получим, что энергия электрона может принимать только следующие дозволенные дискретные значения:
1 |
|
Z 2m e4 |
|
|
|
En = − |
|
|
e |
, |
(28.10) |
n2 |
|
8h2ε02 |
|||
знак минус означает, что электрон находится в связанном состоянии.
264

Из формулы (28.10) следует, что энергетические состояния атома образуют последовательность энергетических уровней, изменяющихся в зависимости от значения п. Целое число п в выражении (28.10), определяющее энергетические уровни, называется главным квантовым числом. Энергетическое состояние с п = 1 является основным (нормальным) состоянием; состояния
п > 1 являются возбужденными. Энергетический уровень, соответствующий основному состоянию атома, называется основным (нормальным) состоянием; все остальные уровни являются возбужденными.
Рис. 28.5
Придавая п различные целочисленные значения, получим для атома водорода (Z = l), согласно формуле (28.10), возможные уровни энергии, схематически представленные на рис. 28.5. Энергия атома водорода с увеличением п возрастает (уменьшается ее отрицательная величина) и энергетические уровни сближаются к границе, соответствующей значению п = ∞. Атом водорода обладает, таким образом, минимальной энергией (Е1 = = –13,55 эВ) при п = 1 и максимальной ( E∞ = 0) при n = ∞ (при
265

удалении электрона из атома). Следовательно, значение E∞ = 0
соответствует ионизации атома (отрыву от него электрона). Согласно второму постулату Бора (см. (28.8)), при переходе
атома водорода (Z = l) из стационарного состояния п с большей энергией в стационарное состояние т с меньшей энергией испускается квант
hν = En − Em
откуда частота излучения
ν = mee4 1
8h3ε02 m2
= − |
mee4 |
|
1 |
|
− |
|
|
1 |
|
|
, |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
2 |
2 |
|
|
|
2 |
|
|
m |
2 |
|
|
||||||||||
|
|
8h |
ε0 |
n |
|
|
|
|
|
|
|
|
|
|
||||||||
|
1 |
|
|
|
|
|
1 |
|
|
|
|
|
1 |
|
|
|
||||||
− |
|
|
|
= R |
|
|
|
|
|
|
− |
|
|
|
|
|
. |
(28.11) |
||||
n |
2 |
|
|
|
|
2 |
|
|
n |
2 |
|
|||||||||||
|
|
|
|
m |
|
|
|
|
|
|
|
|
|
|
||||||||
Воспользовавшись при вычислении R современными значениями универсальных постоянных, получим величину, совпадающую с экспериментальным значением постоянной Ридберга в эмпирических формулах для атома водорода. Это совпадение убедительно доказывает правильность полученной Бором формулы для энергетических уровней водородоподобной системы.
Подставляя, например, в формулу (28.11) т = 1 и п = 2, 3, 4,..., получим группу линий, образующих серию Лаймана и соответствующих переходам электронов с возбужденных (п = 2, 3, 4, ...) на основной (m = 1). Аналогично, при подстановке m = 2, 3, 4,… и соответствующих им значений п получим серии Бальмера, Пашена, Брэкета, Пфунда и Хэмфри (часть из них схематически представлена на рис. 28.5). Следовательно, по теории Бора, количественно объяснившей спектр атома водорода, спектральные серии соответствуют излучению, возникающему в результате перехода атома в данное состояние из возбужденных состояний, расположенных выше данного.
Спектр поглощения атома водорода является линейчатым, но содержит только серию Лаймана. Он также объясняется теорией Бора. Так как свободные атомы водорода обычно находятся в основном состоянии (стационарное состояние с наимень-
266

шей энергией при п = 1), то при сообщении атомам извне определенной энергии могут наблюдаться лишь переходы атомов из основногосостоянияввозбужденные(возникаетсерияЛаймана).
Теория Бора сыграла важную роль в развитии атомной физики и послужила толчком к созданию квантовой механики. Однако эта теория обладает внутренними противоречиями (с одной стороны, применяет законы классической физики, а с другой – основывается на квантовых постулатах). Она рассмотрела спектры атома водорода и водородоподобных систем и вычислила частоты спектральных линий, однако не смогла объяснить их интенсивности и ответить на вопрос: почему совершаются те или иные переходы? Серьезный недостаток теории Бора – невозможность описания с ее помощью спектра атома гелия – одного из простейших атомов, непосредственно следующего за атомом водорода.
В заключение главы приведем основные величины и формулы атомной физики:
Наименование величины, формулы
Частота колебания электрона, выведенного из положения равновесия
Радиус атома
Длина волны серий линий водорода
Частота серий линий водорода
Постоянная Ридберга
Обобщенная формула Бальмера
Условие квантования момента импульса
Соотношения величин |
|||||||||||||||||
|
в скалярной форме |
||||||||||||||||
ω = |
|
|
k |
|
|
= |
|
|
|
e2 |
|
||||||
|
m |
|
|
|
mR3 |
||||||||||||
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
e2 |
|
|
3 |
|
|
|
|
|
|
|
|||||
R = |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|||||
|
mω |
|
|
|
|
|
|
|
|
|
|||||||
λ = λ0 |
|
|
n2 |
|
|
|
|
|
|
|
|||||||
n2 − 4 |
|
|
|
|
|
|
|||||||||||
ω = R |
|
|
1 |
|
− |
|
1 |
||||||||||
|
|
|
|
|
|
|
|
||||||||||
2 |
2 |
n |
2 |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
(n = 3, 4, 5, ...) |
|
|
|
|
|||||||||||||
R = 2,07 1016 с−1 |
|||||||||||||||||
ω = R |
|
|
1 |
|
− |
|
1 |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
2 |
|
|
n |
2 |
|
|||||||||
|
|
|
m |
|
|
|
|
|
|
|
|||||||
mevrn |
= n (n = 1, 2, 3, …) |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
267 |
||

Наименование величины, |
|
Соотношения величин |
||||||||||||||||||||
формулы |
|
|
в скалярной форме |
|||||||||||||||||||
Энергия излучаемого (поглощаемого) фо- |
hν = En − Em |
|
|
|
|
|
|
|
|
|||||||||||||
тона по Бору |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Радиус n-й стационарной орбиты |
r |
= n2 |
2 |
|
|
4πε |
0 |
|
|
|
|
|
||||||||||
|
m Ze2 |
|
|
|
|
|
|
|||||||||||||||
|
n |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
e |
|
|
|
|
|
|
|
|
|
|
|
|
Первый Боровский радиус |
r |
= n2 |
2 |
|
|
4πε |
0 |
|
|
|
|
|
||||||||||
|
m Ze2 |
|
|
|
|
|
|
|||||||||||||||
|
n |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
e |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
Z 2m e4 |
|
|
|||||||||||
Разрешенныедискретныезначенияэнергии |
En = − |
|
|
|
|
|
|
|
|
|
|
|
e |
|
|
|
|
|||||
n2 |
|
|
|
8h2ε02 |
|
|
|
|
||||||||||||||
Частота излучения атома водорода |
|
|
|
mee4 |
|
|
|
1 |
|
|
|
1 |
||||||||||
ν = |
|
|
|
|
|
|
|
|
|
|
− |
|
|
|
= |
|||||||
|
|
3 |
2 |
|
|
|
2 |
|
|
2 |
||||||||||||
|
|
|
|
8h |
ε0 |
m |
|
|
|
|
n |
|
|
|||||||||
|
|
|
|
1 |
|
|
|
|
|
1 |
|
|
|
|
|
|
||||||
|
= |
R |
|
|
|
− |
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
2 |
n |
2 |
|
|
|
|
|
|
|
||||||||||
|
|
|
m |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Вопросы для самоконтроля
1.Почему ядернаямодельатомаоказаласьнесостоятельной?
2.Почему из различных серий спектральных линий атома водорода первой была изучена серия Бальмера?
3.Какой смысл имеют числа т и п в обобщенной формуле Бальмера?
4.Разъясните смысл постулатов Бора. Как с их помощью объясняется линейчатый спектр атома?
5.На каких участках кривой рис. 28.3 наблюдаются упругие
инакаких– неупругиестолкновенияэлектроновсатомами?
6.Какие основные вводы можно сделать на основании опытов Франка и Герца?
7.Пользуясь моделью Бора, укажите спектральные линии, которые могут возникнуть при переходе атома водорода в состояния с п = 3 и п = 4.
8.Почему спектр поглощения атома водорода содержит только серию Лаймана?
268

Проверочные тесты
Вариант 1
1. Какое из нижеприведенных выражений представляет собой один из постулатов Бора?
|
|
|
|
1 |
|
1 |
|
|
|
|
E |
n |
− E |
m |
|
|
|
E |
n |
+ E |
m |
|
|||
1) ν = R |
|
|
|
− |
|
|
|
; |
2) |
ν = |
|
|
; |
3) |
ν = |
|
|
; |
|||||||
|
|
2 |
|
2 |
|
|
h |
|
|
|
h |
|
|||||||||||||
|
|
|
|
1 |
|
|
n1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
1 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
4) ν = R |
|
− |
|
|
; |
5) ε = h ν. |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
n2 |
n2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
1 |
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
2. Известно, что спектральные линии данной серии спектра
|
1 |
1 |
|
|
|
водорода укладываются в формулу ν = R |
|
− |
|
. |
Какие зна- |
n2 |
n2 |
||||
|
1 |
2 |
|
|
|
чения принимает n2, если n1 = 3?
1) n2 = 1, 2, 3, …; 2) n2 = 1, 2, 3; 3) n2 = 4, 5, 6, …; 4) n2 = 4, 6,
8, …; 5) n2 = (n1 + 4), (n1 + 5), (n1 + 6).
3. Обобщенная формула, по которой вычисляются частоты (длины волн), относящиеся к той или иной серии спектра атома
|
1 |
1 |
|
|
|
водорода, выглядит так: ν = R |
|
− |
|
|
. Указать, какие значе- |
n2 |
n2 |
||||
|
1 |
2 |
|
|
|
ния n1 и n2 соответствуют серии Лаймана.
1) n1 = 1, n2 = 1, 2, 3,…; 2) n1 = 1, n2 = 2, 3, 4, …; 3) n1 = 2, n2 = 1, 2, 3,…; 4) n1 = 2, n2 = 3, 4, 5, …; 5) n1 = 3, n2 = 3, 4, 5, …
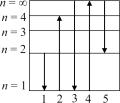
4. Какие из совокупностей переходов, указанных на рисунке, дают линии, принадлежащие той или иной серии спектра испускания?
1) 1, 2; 2) 3, 4; 3) 1, 3; 4) 2, 4; 5) 2, 3.
269
Вариант 2
1.На рисунке изображены энергетические уровни атома водорода по Бору. Какой из переходов соответствует испусканию кванта с наибольшей частотой?
1) 1; 2) 2; 3) 3; 4) 4; 5) 5.
2.Определить длину волны спектраль-
ной линии, соответствующей переходу электрона в атоме водорода с 6-й боровской орбиты на 2-ю.
1) 1, 36 мкм; 2) 0,41 мкм; 3) 0,24 мкм; 4) 0,82 мкм.
3. Обобщенная формула, по которой вычисляются частоты (длины волн), относящиеся к той или иной серии спектра атома
|
1 |
1 |
|
|
|
водорода, выглядит так: ν = R |
|
− |
|
. |
Указать, какие значе- |
n2 |
n2 |
||||
|
1 |
2 |
|
|
|
ния n1 и n2 соответствуют серии Бальмера.
1) n1 = 1, n2 = 1, 2, 3,…; 2) n1 = 1, n2 = 2, 3, 4, …; 3) n1 = 2, n2 = 1, 2, 3,…; 4) n1 = 2, n2 = 3, 4, 5, …; 5) n1 = 3, n2 = 3, 4, 5, …
4. Обобщенная формула, по которой вычисляются частоты (длины волн), относящиеся к той или иной серии спектра атома
|
1 |
1 |
|
|
|
водорода, выглядит так: ν = R |
|
− |
|
. |
Указать, какие значе- |
n2 |
n2 |
||||
|
1 |
2 |
|
|
|
ния n1 и n2 соответствуют серии Пфунда.
1)n1 = 1, n2 = 1, 2, 3,…; 2) n1 = 1, n2 = 2, 3, 4, …; 3) n1 = 2, n2
=1, 2, 3,…; 4) n1 = 2, n2 = 3, 4, 5, …; 5) n1 = 3, n2 = 3, 4, 5, …
270
