
Физика для бакалавра Часть 2
..pdf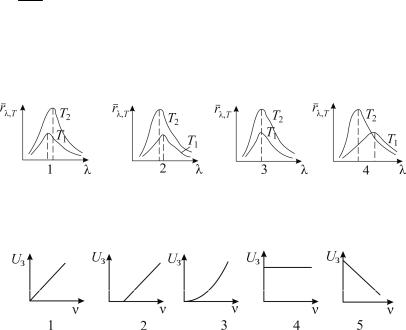
3)энергия, испускаемая со всей поверхности нагретого тела
вединицу времени;
4)энергия электромагнитного излучения с длиной волны от λ до λ + dλ, испускаемая с единицы поверхности нагретого тела
вединицу времени, деленная на интервал длин волн dλ.
2. КакаяизприведенныхформулвыражаетзаконКирхгофа? |
|
||||||||
1) |
rλ,T |
=1; 2) |
aλ,T |
= 1; 3) |
aλ,T |
= 0; 4) |
aλ,T |
= r |
; |
|
|
|
|
||||||
|
aλ,T |
rλ,T |
rλ,T |
|
λ,T |
|
|||
|
rλ,T |
|
|||||||
5)arλ,T = rλ,T .
λ,T
3.Выберите на рисунке правильное изображение двух кри-
вых зависимости rλ,T от λ для абсолютно черного тела при температурах T1 и T2, если T1 < T2.
4.На каком из графиков правильно изображена зависи-
мость задерживающего потенциала Uз от частоты падающего света ν для некоторого металла?
5.От каких величин зависит электропроводность фотосопротивления при освещении его светом?
1) от частоты падающего света;
2) от напряжения, приложенного к фотосопротивлению;
3) от освещенности фотосопротивления;
4) от силы тока в фотосопротивлении.
251
6. При нагревании абсолютно черного тела длина волны, на которую приходится максимум излучательной способности, изменилась от 1,0 до 0,5 нм. Как и во сколько раз изменилась при этом максимальная излучательная способность тела ?
1) увеличилась в 32 раза; 2) уменьшилась в 32 раза; 3) уменьшилась в 2,0 раза; 4) увеличилась в 2,0 раза; 5) увеличилась в 16 раз.
7. Какова энергия электрона, вылетевшего с поверхности серебра, если поверхность освещается ультрафиолетовым светом с длиной волны λ = 115 нм? Работа выхода электрона из серебра равна 4,7 эВ.
1) 0,30 эВ; 2) 1,0 эВ; 3) 6,1 эВ; 4) 42 эВ; 5) 57 эВ.
252
28. ПЛАНЕТАРНАЯ МОДЕЛЬ АТОМА
Рассматриваемые вопросы. Модель атома Томсона. Опы-
ты Резерфорда по рассеянию альфа-частиц. Ядерная модель атома. Эмпирические закономерности в атомных спектрах. Формула Бальмера. Модель атома Бора. Схема энергетических уровней в атоме водорода.
Представление об атомах как неделимых мельчайших частицах вещества («атомос» – неразложимый) возникло еще в античные времена (Демокрит, Эпикур, Лукреций). В средние века, во времена безграничного господства церкви, учение об атомах, будучи материалистическим, естественно, не могло получить признания, а тем более дальнейшего развития. К началу XVIII века атомистическая теория приобретает все большую популярность, так как к этому времени в работах А. Лавуазье, М.В. Ломоносова и Д. Дальтона была доказана реальность существования атомов. Однако в это время вопрос о внутреннем строении атомов даже не возникал, таккакатомыпо-прежнемусчиталисьнеделимыми.
Большую роль в развитии атомистической теории сыграл Д.И. Менделеев, разработавший в 1869 году Периодическую систему элементов, в которой впервые на научной основе был поставлен вопрос о единой природе атомов. Во второй половине XIX века экспериментально было доказано, что электрон является одной из основных составных частей любого вещества. Эти выводы, а также многочисленные экспериментальные данные привели к тому, что в начале XX века возникла необходимость изучения строения атома.
28.1. Модели атома Томсона
Согласно классическим представлениям атом мог бы испускать монохроматическую волну (т.е. спектральную линию) в том случае, когда электрон в излучающем атоме совершает
253

гармонические колебания и, следовательно, удерживается около положения равновесия квазиупругой силой вида F = −kr, где
r – отклонение электрона от положения равновесия.
Первая попытка создания на основе накопленных экспериментальных данных модели атома принадлежит Дж.Дж. Томсону (1903). Согласно этой модели, атом представляет собой непрерывно заряженный положительным зарядом шар, внутри которого около своих положений равновесия колеблются электроны (рис. 28.1).
Суммарный отрицательный заряд электро- Рис. 28.1 нов равен положительному заряду шара,
поэтому атом в целом нейтрален. Напряженность поля внутри равномерно заряженного шара
определяется выражением
E(r) = Re3 r (0 ≤ r ≤ R),
где е – заряд шара; R – его радиус. Следовательно, на электрон, находящийся на расстоянии r от положения равновесия (от центра шара), будет действовать сила
F = (−e)E = − e2 r = −kr.
R3
В таких условиях электрон, выведенный каким-либо образом из положения равновесия, будет совершать колебания с частотой
ω = |
k |
= |
e2 |
, |
(28.1) |
|
m |
mR3 |
|||||
|
|
|
|
где е – заряд электрона; т – масса электрона; R – радиус атома. Этим соотношением можно воспользоваться для оценки размеров атома. Согласно (28.1)
254

1
R = e2 3 .
mω2
Длине волны λ = 6000 Å (видимая область спектра) соответствует ω ≈ 3 1015 c−1. Следовательно, R ≈ 3 10−8 см.
Полученное значение совпадает по порядку величины с газокинетическими размерами атомов, что можно было бы рассматривать как подтверждение модели Томсона. Однако через несколько лет было доказано, что представление о непрерывно распределенном внутри атома положительном заряде ошибочно, в дальнейшем выяснилась несостоятельность этой модели. В настоящее время она имеет лишь исторический интерес как одно из звеньев в цепи развития представлений о строении атомов.
28.2. Опыты Резерфорда по рассеянию альфа-частиц. Ядерная модель атома
Распределение положительных и отрицательных зарядов в атоме можно выяснить, произведя непосредственное опытное «зондирование» внутренних областей атома. Такое зондирование осуществили Резерфорд и его сотрудники с помощью α-час- тиц, наблюдая изменение направления их полета (рассеяние) при прохождении через тонкие слои вещества.
Напомним, что α-частицами называют частицы, испускаемые некоторыми веществами при радиоактивном распаде. Скорости α-частиц бывают порядка 109 см/с. В то время, когда Резерфорд приступал к своим опытам, было известно, что α-частицы имеют положительный заряд, равный удвоенному элементарному заряду, и что при потере этого заряда (при присоединении двух электронов) α-частица превращается в атом гелия.
Опыт осуществлялся следующим образом (рис. 28.2). Выделяемый отверстием узкий пучок α-частиц, испускаемых радиоактивным веществом Р, падал на тонкую металлическую фольгу Ф. При прохождении через фольгу α-частицы отклоня-
255

лись от первоначального направления движения на различные углы θ. Рассеянные α-частицы ударялись об экран Э, покрытый сернистым цинком, и вызываемые ими сцинтилляции наблюдались в микроскоп М. Микроскоп и экран можно было вращать вокруг оси, проходящей через центр рассеивающей фольги, и устанавливать таким образом под любым углом θ. Весь прибор помещался в откачанный кожух, чтобы устранить рассеяние α-частиц за счет столкновений с молекулами воздуха.
Оказалось, что некоторое количество α-частиц рассеивается на очень большие углы (почти до 180°). Проанализировав результаты опыта, Резерфорд пришел к выводу, что столь сильное отклонение α-частиц возможно только в том случае, если внутри атома имеется чрезвычайно силь-
ное электрическое поле, которое создается зарядом, связанным с большой массой и сконцентрированным в очень малом объеме. Основываясь на этом выводе, Резерфорд предложил в 1911 году ядерную модель атома. Согласно Резерфорду атом представляет собой систему зарядов, в центре которой расположено тяжелое положительное ядро с зарядом Ze, имеющее размеры, не превышающие 10–12 см, а вокруг ядра расположены Z электронов, распределенных по всему объему, занимаемому атомом. Почти вся масса атома сосредоточена в ядре. Так как атомы нейтральны, то заряд ядра равен суммарному заряду электронов.
Для простоты предположим, что электрон движется вокруг ядра по круговой орбите радиусом r. При этом кулоновская сила взаимодействия между ядром и электроном сообщает электрону центростремительное ускорение. Второй закон Ньютона для электрона, движущегося по окружности под действием кулоновской силы, имеет вид
256
Zee |
m v2 |
|
|
|
|
= |
e |
, |
(28.2) |
4πε0r2 |
r |
|||
где те и v – масса и скорость электрона на орбите радиуса r; ε0 –
электрическая постоянная.
Уравнение (28.2) содержит два неизвестных – r и v. Следовательно, существует бесчисленное множество значений радиуса и соответствующих ему значений скорости (а значит, и энергии), удовлетворяющих этому уравнению. Поэтому величины r, v (следовательно, и Е) могут меняться непрерывно, т.е. может испускаться любая, а не вполне определенная порция энергии. Тогда спектры атомов должны быть сплошными. В действительности же опыт показывает, что атомы имеют линейчатый
спектр. Из выражения (28.2) следует, что при r ≈ 10−10 |
м скорость |
||||
|
6 |
|
v2 |
22 |
2 |
движения электронов v ≈ 10 |
|
м/с, а ускорение |
r = 10 |
|
м/с . Со- |
гласно законам электродинамики, ускоренно движущиеся электроны должны излучать электромагнитные волны и вследствие этого непрерывно терять энергию. В результате электроны будут приближаться к ядру и в конце концов упадут на него. Таким образом, атом Резерфорда оказывается неустойчивой системой, что опять-таки противоречит действительности.
Попытки построить модель атома в рамках классической физики не привели к успеху: модель Томсона была опровергнута опытами Резерфорда, ядерная же модель оказалась неустойчивой электродинамически и противоречила опытным данным. Преодоление возникших трудностей потребовало создания качественно новой – квантовой – теории атома.
28.3. Эмпирические закономерности в атомных спектрах. Формула Бальмера
Излучение невзаимодействующих друг с другом атомов состоит из отдельных спектральных линий. В соответствии с этим спектр испускания атомов называется линейчатым.
257

Изучение атомных спектров послужило ключом к познанию строения атомов. Прежде всего, было замечено, что линии
вспектрах атомов расположены не беспорядочно, а объединяются в группы (или серии) линий. Отчетливее всего это обнаруживается в спектре простейшего атома – водорода. Очевидно, что линии располагаются в определенном порядке. Расстояние между линиями закономерно убывает по мере перехода от более длинных волн к более коротким.
Швейцарский физик Бальмер (1885) обнаружил, что длины
вэтой серии линий водорода могут быть точно представлены формулой
n2 |
|
λ = λ0 n2 − 4 , |
(28.3) |
где λ0 – константа; n – целое число (3, 4, 5, ... и т.д.). Если перейти в (28.3) от длины волны к частоте, получится формула
|
1 |
|
1 |
(n = 3, 4, 5, ...), |
|
|||
ω = R |
|
|
− |
|
|
|
(28.4) |
|
2 |
2 |
n |
2 |
|||||
|
|
|
|
|
|
|
||
где R – константа, называемая в честь шведского спектроскопи-
ста постоянной Ридберга, R = 2,07 1016 с−1.
Формула (28.4) называется формулой Бальмера, а соответствующая серия спектральных линий водородного атома – серией Бальмера. Дальнейшие исследования показали, что в спектре водорода имеется еще несколько серий. В ультрафиолетовой части спектра находится серия Лаймана. Остальные серии лежат в инфракрасной области. Линии этих серий могут быть представлены в виде формул, аналогичных (28.4):
|
1 |
|
|
|
1 |
(n = 2, 3, 4, 5, ...); |
||||||
серия Лаймана |
ω = R |
|
|
− |
|
|
|
|
|
|||
|
2 |
n |
2 |
|||||||||
|
|
1 |
|
|
|
|
|
|
|
|||
|
1 |
|
|
|
1 |
(n = 4, 5, 6, 7...); |
||||||
серия Пашена |
ω = R |
|
|
− |
|
|
|
|
|
|
||
2 |
|
|
n |
2 |
|
|||||||
|
|
3 |
|
|
|
|
|
|
|
|||
258
|
|
1 |
|
1 |
(n = 5, 6, 7, 8...); |
|||||
серия Брэкета |
ω = R |
|
|
− |
|
|
|
|
||
4 |
2 |
n |
2 |
|
||||||
|
|
|
|
|
|
|
|
|||
|
1 |
|
1 |
(n = 6, 7, 8, 9...). |
||||||
серия Пфунда |
ω = R |
|
|
|
− |
|
|
|
|
|
|
5 |
2 |
n |
2 |
|
|||||
|
|
|
|
|
|
|
|
|||
Частоты всех линий спектра водородного атома можно представить одной формулой:
|
1 |
|
1 |
|
|
|
||
ω = R |
|
|
− |
|
|
|
, |
(28.5) |
|
2 |
n |
2 |
|||||
m |
|
|
|
|
|
|
||
где т имеет значение 1 для серии Лаймана, 2 – для серии Бальмера и т.д.
При заданном т число п принимает все целочисленные значения, начиная с т + 1. Выражение (28.5) называют обоб-
щенной формулой Бальмера.
При возрастании п частота линии в каждой серии стремится кпредельному значениюR/m2, котороеназываетсяграницей серии.
Исследование более сложных спектров – спектров паров щелочных металлов (например, Li, Na, К) – показало, что они представляются набором незакономерно расположенных линий. Ридбергу удалось разделить их на три серии, каждая из которых располагается подобно линиям серии Бальмера.
Приведенные выше сериальные формулы подобраны эмпирически и долгое время не имели теоретического обоснования, хотя и были подтверждены экспериментально с очень большой точностью. Приведенный выше вид сериальных формул, удивительная повторяемость в них целых чисел, универсальность постоянной Ридберга свидетельствуют о глубоком физическом смысле найденных закономерностей, вскрыть который в рамках классической физики оказалось невозможным.
28.4. Модель атома Бора
Первая попытка построить качественно новую – квантовую – теорию атома была предпринята в 1913 году датским физиком Нильсом Бором (1885–1962). Он поставил перед собой цель свя-
259

зать в единое целое эмпирические закономерности линейчатых спектров, ядерную модель атома Резерфорда и квантовый характер излучения и поглощения света. В основу своей теории Бор положил два постулата.
Первый постулат Бора (постулат стационарных состоя-
ний): в атоме существуют стационарные (не изменяющиеся со временем) состояния, в которых он не излучает энергии. Стационарным состояниям атома соответствуют стационарные орбиты, по которым движутся электроны. Движение электронов по стационарным орбитам не сопровождается излучением электромагнитных волн.
В стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь дискретные квантованные значения момента импульса, удовлетворяющие условию
mevrn = n (n = 1, 2, 3, …), |
(28.6) |
гдете – массаэлектрона; v – егоскоростьпоn-йорбитерадиусомrn.
Второй постулат Бора (правило частот): при переходе электрона с одной стационарной орбиты на другую излучается (поглощается) один фотон с энергией
hν = En − Em , |
(28.7) |
равной разности энергий соответствующих стационарных состояний (Еn и Ет – соответственно энергии стационарных состояний атома до и после излучения (поглощения)). При Ет < Еп происходит излучение фотона (переход атома из состояния с большей энергией в состояние с меньшей энергией, т.е. переход электрона с более удаленной от ядра орбиты на более близлежащую), при Ет > Еп – его поглощение (переход атома в состояние с большей энергией, т.е. переход электрона на более удаленную от ядра орбиту). Набор возможных дискретных час-
тот ν = En − Em квантовых переходов и определяет линейчатый h
спектр атома.
260
