
Ч 2
.pdfДругие болезни крови и кроветворных органов (D70–D77):
D70 – агранулоцитоз;
D71 – функциональные нарушения полиморфно-ядерных нейтрофилов;
D72 – другие нарушения белых кровяных клеток;
D73 – болезни селезёнки;
D74 – метгемоглобинемия;
D75 – другие болезни крови и кроветворных органов;
D76 – отдельные болезни, протекающие с вовлечением лимфоретикулярной ткани и ретикулогистиоцитарной системы;
D77 – другие нарушения крови и кроветворных органов при болезнях, классифицированных в других рубриках.
Отдельные нарушения, вовлекающие иммунный механизм (D80–D89):
D80 – иммунодефициты с преимущественной недостаточностью антител;
D81 – комбинированные иммунодефициты;
D82 – иммунодефициты, связанные с другими значительными дефектами; D83 – обычный вариабельный иммунодефицит;
D84 – другие иммунодефициты;
D86 – саркоидоз;
D89 – другие нарушения с вовлечением иммунного механизма, не классифицированные в других рубриках.
Безусловно, к болезням селезёнки и гематологическим заболеваниям (в той или иной мере проявляющимся гематологическими сдвигами или соответствующими клиническими симптомами) можно отнести изменения и патологию, обозначенные в других разделах и рубриках МКБ-10 (класс I – A90–A99, B15– B34; класс II – C00–D48; класс IV – E00–E07; класс VI – G00–G09; класс IX – I00–I02, I05–I09, I30–I52, I70–I79; класс X – J00–J22, J85–J94; класс XI – K00– K93; класс XII – L00–L08, L55–L59; класс XIII – M00–M14, M30–M36; класс XIV – N00–N08; класс XV – O00–O99; класс XVI – P00–P96; класс XVII – Q80– Q89; класс XVIII – R00–R99; класс XIX – S00–T98; класс XX – V01–Y98 и др.).
В клиническом плане все хирургические заболевания селезёнки и болезни крови целесообразно разделить следующим образом:
1.Врождённые аномалии – аплазия, гипоплазия, дольчатая селезёнка, добавочная доля селезёнки, поликистоз селезёнки (с явлениями гиперспленизма
ибез него).
2.Травмы селезёнки (открытые, закрытые).
3.Доброкачественные и злокачественные опухоли селезёнки (первичные
ивторичные).
4.Заболевания крови: анемии, гипокоагуляционные (геморрагические) синдромы, гиперкоагуляционные синдромы, гемобластозы, иммунопатии (первичные и вторичные заболевания, вовлекающие иммунный механизм), другие болезни крови и кроветворных органов.
С эпонимической точки зрения различают следующие проявления хирургических заболеваний селезёнки и патологии крови:
91

проявления анемии; заболевания селезёнки и их проявления;
патологию системы гемостаза, сопровождающуюся геморрагическим синдромом, и её проявления;
патологию системы гемостаза, сопровождающуюся гиперкоагуляционным синдромом, и её проявления;
заболевания, сопровождающиеся снижением иммунорезистентности (иммунопатии), и их проявления.
3.1. Проявления анемии
Анемия (от греч. а – без, haima – кровь, малокровие) – это клинико-лабо- раторный синдром, характеризующийся снижением содержания гемоглобина, эритроцитов (рис. 3.1) и гематокрита в единице объёма крови.
Анемия может возникать на протяжении всей жизни человека, причём не только при различных заболеваниях, но и при некоторых физиологических состояниях (например, при беременности, во время лактации, в период усиленного роста). Её развитие может быть связано с пубертатным и климактерическим периодами, с гормональными нарушениями, характером питания, заболеваниями пищеварительного тракта, печени, почек, нарушением всасывания, аутоиммунными состояниями, оперативным вмешательством и другими факторами. Нередко анемия является самостоятельным или сопутствующим симптомом многих внутренних заболеваний, инфекционных и онкологических болезней.
В классификации анемий наибольшее распространение получили следующие подходы.
Классификация анемий по Алексееву. Автор разделяет все анемии на постгеморрагические (анемии вследствие кровопотери), а- и гипопластические (анемии вследствие нарушения кровеобразования) и гемолитические (анемии вследствие повышенного кроверазрушения).
Предложена в 1970 г. врачом Г. А. Алексеевым.
Рис. 3.1. Уменьшение числа эритроцитов (б) по сравнению с нормой (а) при анемии
92
Классификация анемий по Вейссенбаху. Все анемии разделены автором на три типа: постгеморрагические, гемолитические (согласно автору, «гипергемолитические») и апластические (связанные с «нарушением продукции костным мозгом красных кровяных шариков, вплоть до полного ангематопоэза».
Предложена французским врачом R. J. Е. Weissenbach (1885–1963) в книге “Les syndromes anemiques”; классификация имеет историческое значение.
Классификация анемий по Идельсону. В соответствии с ней различают: I. Постгеморрагические анемии (связанные с кровопотерей): острые, хро-
нические.
II. Анемии, связанные с нарушенным кровеобразованием:
1)анемии, связанные с нарушением образования гемоглобина: железодефицитные (связанные с дефицитом железа), сидероахрестические (связанные
снарушением синтеза или утилизации порфиринов);
2)мегалобластные анемии (связанные с нарушением синтеза ДНК и РНК):
В12-дефицитные (связанные с дефицитом витамина В12), фолиеводефицитные (связанные с дефицитом фолиевой кислоты);
3)дизэритропоэтические анемии (связанные с нарушением процессов деления эритроцитов): наследственные, приобретённые;
4)гипопластические и апластические анемии (связанные с угнетением пролиферации клеток костного мозга): наследственные, приобретённые.
III. Гемолитические анемии (связанные с повышенным кроверазрушением):
1)наследственные:
связанные с нарушением мембраны эритроцитов; связанные с нарушением активности ферментов эритроцитов;
связанные с нарушением структуры или синтеза гемоглобина;
2)приобретённые:
связанные с воздействием антител (изоиммунные, трансиммунные, гетероиммунные, аутоиммунные);
связанные с изменением структуры мембраны, обусловленным соматической мутацией (болезнь Маркиафавы–Микели);
связанные с механическим повреждением оболочки эритроцитов; обусловленные химическим повреждением эритроцитов;
обусловленные недостатком витаминов (Е, В12, фолиевой кислоты); обусловленные разрушением эритроцитов паразитами (плазмодий ма-
лярии).
Предложена в 1979 г. врачом Л. И. Идельсоном.
Классификация анемий по Калиничевой. В соответствии с ней все ане-
мии следует различать:
по этиологии – «дефицитные» анемии, гипо- и апластические анемии, гемолитические анемии, постгеморрагические анемии, вторичные анемии (анемии со сложным патогенезом);
по содержанию гемоглобина и эритроцитов в периферической крови –
лёгкая анемия (гемоглобин от 83 до 110 г/л, эритроциты до 3,5 г/л), средней
93
степени тяжести (гемоглобин от 82 до 66 г/л, эритроциты 2,5–3,4 г/л), тяжёлая (гемоглобин менее 66 г/л, эритроциты менее 2,5 г/л);
по регенераторной способности эритропоэза – гипо- и арегенераторная анемии (ретикулоцитоз не соответствует тяжести анемии или имеется полное отсутствие ретикулоцитов в периферической крови), регенераторная анемия (ретикулоцитоз от 5 до 50 ‰), гиперрегенераторная анемия (ретикулоцитоз превышает 50 ‰);
по величине цветного показателя – гипохромная анемия (менее 0,8), нор-
мохромная анемия (от 0,8 до 1,0), гиперхромная анемия (1,0 и более). Предложена в 1983 г. гематологом В. И. Калиничевой.
Классификация анемий по Митереву. Данная классификация делит ане-
мии по степени тяжести – лёгкая анемия (гемоглобин 90–110 г/л), анемия средней степени тяжести (гемоглобин 70–89 г/л), тяжёлая анемия (гемоглобин менее 70 г/л).
Предложена врачом А. А. Митеревым.
Классификация анемий по Никушкину–Крючковой. Основана на оцен-
ке морфологических характеристик эритроцитов крови – показателя распре-
деления эритроцитов по объёму RDW (read distribution width) и MCV (mean cell volume). Аналогичную функцию выполняет кривая Прайса–Джонса. Величина RDW в норме – 11,5–14,5 %. В соответствии с данными критериями предлагается следующая градация анемий (табл. 3.1).
Таблица. 3.1. Классификация анемий по морфологическим характеристикам
эритроцитов (Никушкина–Крючковой)
Показатель |
MCV меньше нормы |
MCV в норме |
MCV выше нормы |
|
(микроцитарные) |
(нормоцитарные) |
(макроцитарные) |
||
|
||||
|
|
|
|
|
RDW в норме |
р-Талассемия |
Хронические заболевания |
Болезни печени |
|
(гомогенные) |
Хронические |
Острая кровопотеря |
Апластическая анемия |
|
RDW выше нормы |
заболевания |
Гемолитическая анемия вне |
В12- и фолиевый дефицит |
|
(гетерогенные) |
Дефицит железа |
криза |
Гемолитический криз |
|
|
|
Дефицит железа и витамина |
Агглютинация эритроцитов |
|
|
|
Гемоглобинопатии |
Лейкоцитоз свыше 50·109/л |
|
|
|
Миелодиспластический |
|
|
|
|
синдром |
|
|
|
|
Миелофиброз |
|
Предложена в 1998 г. врачами Е. В. Никушкиным и М. И. Крючковой.
Классификация анемий по Паппенгейму. Все анемии разделены авто-
ром на два вида:
геманемия, или Anaemia haematica, первично поражающая кровь (primär hämatisch-hämophtisische Anämie), или гемодегенеративная с относительной недостаточностью костного мозга (hyporegene-rative Myelopathie), обусловленная нарушением регенерации клеток крови (Zellregeneration);
миэланемия(гипопластическаямиэлопатия,илиprimärmedullär–myelophаthi- sische Anämie), обусловленная нарушением пластики клеток крови (Zellplastik).
94
Первая форма (геманемия) разделена на травматически-постгеморрагиче- скую анемию и гемотоксическую анемию (простую вторичную и пернициозную). Автором указано, что «все формы геманемий могут переходить в так называемые апластические, т. е. арегенеративные, стадии.
Предложена немецким врачом А. Pappenheim (1870–1917); классификация имеет историческое значение.
Клинико-патогенетическая классификация анемий Нейтона–Оски.
Всоответствии с ней различают:
I. Анемии, обусловленные острой кровопотерей (постгеморрагические анемии) – острые и хронические.
II. Анемии, возникающие в результате дефицитного эритропоэза:
за счёт нарушения созревания (микросфероцитарные): железодефицитные, обусловленные нарушением транспорта, утилизации или реутилизации железа;
за счёт нарушения дифференцировки эритроцитов: апластические или гипопластические (врождённые, приобретенные), дизэритропоэтические анемии; за счёт нарушения пролиферации клеток – предшественниц эритропоэза
(макросфероцитарные): В12-дефицитные, фолиево-дефицитные.
III. Анемии, развитие которых обусловлено повышенным разрушением (деструкцией) эритроцитов (гемолитические):
вследствие приобретённого гемолиза: аутоиммунные, неиммунные (воздействие ядов, медикаментов и других экзогенных веществ), травматические (при наличии искусственных клапанов сердца, проведении гемодиализа, других экстра- и интракорпоральных методов очищения крови и др.), клональные (ПНГ); вследствие гемолиза, обусловленного аномалиями эритроцитов: мембра-
нопатии, ферментопатии, гемоглобинопатии; вследствие гиперспленизма и внутриклеточного гемолиза (сначала снижа-
ется уровень тромбоцитов, а затем развивается анемия).
IV. Анемии, развивающиеся вследствие сочетанных причин. Предложена в 2003 г. врачами D. Natan и F. Oski.
Критерии анемий ВОЗ. Уровень гемоглобина: для мужчин – менее 130 г/л (гематокрит менее 39 %); для женщин – менее 120 г/л (гематокрит менее 36 %); для беременных женщин – менее 110 г/л (гематокрит менее 36 %).
Предложены в 1998 г. группой экспертов ВОЗ.
Наиболее значимыми этиопатогенетическими формами анемий являются следующие.
Постгеморрагические анемии. Развиваются в результате выхождения значительного количества крови во внешнюю среду или в полости тела. Ведущим патогенетическим звеном данных анемий является уменьшение общего объёма крови (особенно её циркулирующей фракции), что ведёт к гипоксии, сдвигам кислотно-основного состояния, дисбалансу ионов в клетках и вне их.
Острые постгеморрагические анемии развиваются вследствие травмати-
ческого или патологического нарушения целостности кровеносных сосудов,
95
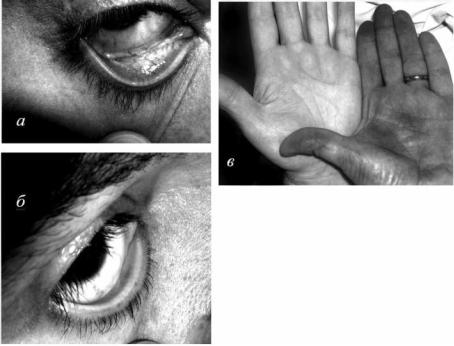
достаточно быстрой эксфузии крови во внешнюю и внутренние среды при травме сосудов и кровотечениях из внутренних органов (чаще при поражении желудочно-кишечного тракта, матки, лёгких, полостей сердца, после острой кровопотери при осложнениях беременности и родов).
Клиническая картина таких анемий характеризуется бледностью кожных покровов и видимых слизистых оболочек (рис. 3.2), слабостью, головокружением, шумом в ушах, холодным липким потом, резким снижением артериального давления, понижением температуры тела, частым пульсом слабого наполнения (нитевидным), возбуждением, сменяющимся обморочным состоянием,аиногдарвотой,цианозомисудорогами.Происходитпотерязначительного количества железа (500 мг и более).
Постановка диагноза обычно не вызывает затруднений (кроме случаев анемии, обусловленной внутренним кровотечением). В периферической крови в первые часы (а иногда и сутки) в организме отмечается эквивалентное снижение общего содержания форменных элементов и плазмы крови (при этом гематокрит, число эритроцитов и уровень гемоглобина в единице объёма крови остаются в норме). Снижен лишь показатель объёма циркулирующих эритроцитов. Через 5–8 ч (реже – через 2–3 дня) после кровопотери отмечается уменьшение уровня гемоглобина, числа эритроцитов в единице объёма крови, а также гематокрита (следствие гемодилюции, вызванной уменьшением количества жидкости, выводимой почками, и снижением поступления в сосуды межтканевой жидкости и лимфы). Цветовой показатель остается нормальным.
Рис. 3.2. Внешние признаки постгеморрагической анемии: а – конъюнктива здорового человека (инъецированная сосудами); б – конъюнктива пациента с анемией (резкая бледность без инъекции капилляров); в – бледность руки пациента с анемией на фоне
руки здорового человека
Приведено по: http://www.primamedica.ru/ present/Anemii/anemii1.ppt#34
96
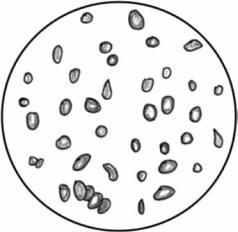
Общее содержание тромбоцитов и лейкоцитов в единице объёма крови обычно снижено: тромбоцитов – в результате их потребления в процессе тромбообразования и гемодилюции, лейкоцитов – в результате кровотечения и гемодилюции соответственно. Через 4–5 дней после кровотечения в крови обнаруживается большое число молодых клеток эритроцитарного ростка гемопоэза – полихроматофильных и оксифильных эритроцитов. Число ретикулоцитов также значительно увеличивается (гипер- и регенераторная анемии). Цветовой показатель ниже 0,85 (гипохромия эритроцитов), поскольку скорость синтеза гемоглобина отстает от темпа пролиферации клеток эритрона. В костном мозге выявляются признаки интенсификации эритропоэза – увеличение количества эритробластов, нормобластов различных форм, а также ретикулоцитов (костномозговая компенсация кровопотери). Клетки костного мозга плоских и эпифизов трубчатых костей пролиферируют, и он приобретает насыщенный яркий цвет.
Хронические постгеморрагические анемии являются частным вариантом железодефицитных анемий (рис. 3.3). Их развитие связано с нарастающим дефицитом железа в организме вследствие длительных, часто повторяющихся кровотечений, при инфильтрации в сосуды опухолевых клеток, венозном застое крови, экстрамедуллярном кроветворении, язвенных процессах в стенке желудка, кишечника, коже, подкожной клетчатке, эндокринопатиях (например, дисгормональной аменорее), расстройствах гемостаза (нарушении его сосудистого, тромбоцитарного, коагуляционного механизмов при геморрагических диатезах). Хронические постгеморрагические анемии приводят к истощению запасов железа в организме, снижению регенераторной способности костного мозга.
Клинически отмечаются слабость, |
|
|
быстрая утомляемость, бледность ко- |
|
|
жи и видимых слизистых оболочек, |
|
|
звон или шум в ушах, головокружение, |
|
|
одышка, сердцебиение (даже при не- |
|
|
значительной физической нагрузке), |
|
|
так называемые анемические шумы, |
|
|
выслушиваемые над областью сердца |
|
|
и яремной веной. Картина крови ха- |
|
|
рактеризуетсягипохромией,микроци- |
|
|
тозом, низким цветовым показателем |
|
|
(0,4–0,6), морфологическими измене- |
|
|
ниями эритроцитов (анизоцитозом, пой- |
|
|
килоцитозом, полихромазией). Кост- |
Рис. 3.3. Гипохромия эритроцитов с микро- |
|
ный мозг плоских костей имеет обыч- |
||
ный вид, а в костном мозге трубчатых |
цитозом в мазке крови при хронической |
|
постгеморрагической анемии |
||
костей наблюдаются выраженные яв- |
||
Приведено по: Г. Е. Ройтберг, А. В. Струтын- |
||
ления регенерации и превращения |
ский (1999) |
97
жирового костного мозга в красный. Нередко отмечаются множественные очаги внекостномозгового кроветворения. Развивается гипоксия тканей и органов, которая обусловливает развитие жировой дистрофии миокарда («тигровое сердце»), печени, почек, дистрофических изменений в клетках головного мозга. Отмечаются множественные точечные кровоизлияния в серозных
ислизистых оболочках, во внутренних органах. По тяжести течения хроническая постгеморрагическая анемия может быть лёгкой (содержание гемоглобина от 90 до 110 г/л), средней тяжести (содержание гемоглобина от 70 до 90 г/л)
итяжёлой (содержание гемоглобина менее 70 г/л). Число лейкоцитов и тромбоцитов в крови при этом варьируется.
Апластические анемии – патологические синдромы, в основе которых ле-
жит панцитопения, сочетающаяся со снижением кроветворения в костном мозге, без признаков гемобластоза. Из этой группы выделяют отдельные нозологические формы, патогенез которых в настоящее время уточнён. В ряде случаев апластические анемии выявляют после приёма некоторых лекарств и химических веществ, обладающих миелотоксическим действием. У большинства пациентов апластическая анемия развивается без воздействия внешних токсических факторов. Случаи такой идиопатической апластической анемии, по всей вероятности, являются проявлением аутоагрессии против антигена клеток костного мозга. К аутоиммунным панцитопениям следует отнести те формы апластической анемии, которые протекают с признаками повышенного гемолиза, спленомегалией, незначительным ретикулоцитозом, раздражением красного ростка костного мозга и выраженным эффектом после применения больших доз глюкокортикоидных гормонов. Лимфоциты костного мозга пациентов с апластической анемией могут нарушать дифференциацию гранулоцитов и пролиферацию клеток костного мозга. Имеется ряд описаний апластической анемии, возникшей после острого гепатита (при этом установлена способность вируса гепатита вызывать хромосомные аномалии). Одной из вероятных причин апластической анемии является уменьшение количества гемопоэтических стволовых клеток.
В большинстве случаев болезнь развивается исподволь. Пациент адаптируется к анемии и обращается к врачу только тогда, когда панцитопения выражена значительно. Клиническая картина депрессии кроветворения складывается из анемии различной выраженности, тромбоцитопении (кровоподтёки, петехиальные высыпания на коже, носовые кровотечения, меноррагии), нередко встречающейся нейтропении (с частыми пневмониями, отитами, пиелитами и другими воспалительными процессами). Анемия связана как с нарушением образования эритроцитов, так и с имеющими место вторичными кровотечениями. Отмечаются выраженная бледность, кожные геморрагии, воспалительные изменения на слизистой оболочке рта и слизистой прямой кишки. Нередко выявляется систолический шум на верхушке сердца. При идиопатической форме болезни селезёнка не пальпируется (её увеличение имеет место при аутоиммунной форме и гемосидерозе, развивающемся в результате массивных трансфузий крови).
98
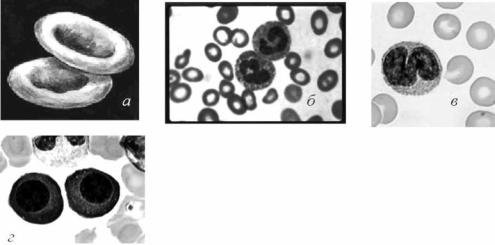
Со стороны гемограммы наиболее типичным является существенное снижение гемоглобина (иногда до 20–30 г/л). Анемия чаще всего нормохромная, макроцитарная (рис. 3.4). Содержание ретикулоцитов – от 0 до 5 % (ретикулоцитоз свидетельствует об иммунной форме болезни). Эритрокариоциты в периферической крови наблюдаются редко. Характерна выраженная гранулоцитопения (иногда количество гранулоцитов снижается до 200 в 1 мкл), сопровождающаяся развитием инфекционных осложнений. В ряде случаев имеет место снижение абсолютного количества моноцитов. Уровень лимфоцитов в большинстве наблюдений не изменён. Количество тромбоцитов всегда снижено (иногда до нулевой отметки), удлиняется время кровотечения, развивается геморрагический синдром, возрастает СОЭ (до 30–50 мм/ч). В костном мозге чаще всего уменьшено количество миелокариоцитов (преимущественно за счёт предшественников клеток миелоидного ряда), иногда отмечается раздражение красного ростка кроветворения. Увеличено количество плазматических и тучных клеток. Мегакариоциты могут полностью отсутствовать. В костном мозге резко повышено содержание железа (большая его часть находится вне эритрокариоцитов). При гистологическом исследовании костного мозга в одних случаях имеет место почти полное исчезновение костномозговых элементов и замещение их жировой тканью, в других наблюдаются небольшие очаги кроветворения на фоне значительного опустошения костного мозга. Содержание железа сыворотки крови у большинства обследуемых увеличено, насыщение трансферрином приближается к 100%. При исследовании феррокинетики при помощи радиоактивного железа выявляется удлинение времени выведения железа из плазмы и снижение количества железа, включённого в эритроциты. Продолжительность жизни эритроцитов, измеренная при помощи радиоактивного хрома, обычно несколько укорочена. В ряде случаев имеет место увеличение уровня фетального гемоглобина.
Рис. 3.4. Изменения гемограммы, характерные для апластической анемии: нормохромная макроцитарная анемия (а), гранулоцитопения (б), моноцитопения (в) и увеличение размера плазматических (г) и тучных клеток
99
Диагностика апластической анемии основана на выявлении панцитопении периферической крови, данных тщательного цитологического и гистологического исследований костного мозга (для исключения гемобластозов). При периферической панцитопении возникает необходимость исключения группы анемий, связанных с нарушением синтеза ДНК и РНК (мегалобластных анемий), у пожилых людей – В12-дефицитных, а у детей – фолиеводефицитных анемий.
Прогноз заболевания не однозначен – в одних случаях болезнь прогрессирует быстро и приводит к смерти, в других она протекает сравнительно нетя - жело (с периодическими ремиссиями), иногда возможно полное выздоровление. При адекватном лечении ремиссия развивается примерно у половины пациентов. У детей прогноз несколько лучше, чем у взрослых. Прогноз также лучше, когда увеличено содержание ретикулоцитов, в костном мозге имеется более полиморфная картина, отмечается небольшое увеличение размеров селезёнки и хотя бы небольшой, но выраженный эффект от кортикостероидных гормонов (в этих случаях спленэктомия оказывает, как правило, хороший эффект, вплоть до полного выздоровления). У некоторых пациентов апластический синдром является началом острого лейкоза (иногда признаки гемобластоза выявляются лишь через несколько лет от начала болезни).
Железодефицитная анемия – широко распространенный патологический синдром, характеризующийся снижением количества железа в организме (в крови, костном мозге и депо), при котором нарушается синтез гема, а также белков, содержащих железо (миоглобина, железосодержащих тканевых ферментов). В большинстве случаев железодефицитной анемии способствует тканевый дефицит железа.
Причиной дефицита железа является нарушение его баланса в сторону преобладания расходования железа над его поступлением, наблюдаемое при различных физиологических состояниях или заболеваниях. Повышенный расход железа, вызывающий развитие гипосидеропении, связан с кровопотерей или усиленным его использованием при некоторых физиологических состояниях (беременности, быстром росте). У взрослых дефицит железа развивается, как правило, вследствие кровопотери (к отрицательному балансу железа приводят постоянные небольшие кровопотери и хронические скрытые кровотечения – 5–10 мл/сут, однократная массивная потеря крови с превышением запасов железа в организме или повторные значительные кровотечения, после которых запасы железа не успевают восстановиться). При этом наиболее частыми источниками геморрагий служат гениталии (беременность, патологические менструации, фибромиомы матки, дисфункции яичников) и пищеварительный тракт (эрозивные эзофагиты, гастриты и дуодениты, язвенная болезнь, дивертикулы, геморрой, опухоли, хронические неспецифические энтероколиты, болезнь Крона, болезнь Менетрие, осложнения дивертикула Меккеля). После повторных носовых, лёгочных, почечных, травматических кровотечений, а также кровотечений после экстракции зубов сидеропения
100
