
Физика [РТФ, Браже & Долгов, 1 семестр] / Шизика
.pdf
мая через сферические функции; n,l,m – квантовые числа. Они имеют следующий физический смысл:
• n – главное квантовое число. Оно характеризует энергию стационарных состояний электрона в атоме (17.2) и принимает значения
n =1,2, 3, …;
•l – орбитальное квантовое число. Оно характеризует орбиталь-
ный момент импульса электрона в атоме
M = |
|
(17.4) |
l(l +1) |
и принимает значения
l =0,1, 2, 3, …, (n −1 ).
Орбитальное квантовое число принимает nзначений. Возможны только такие переходы электрона из одного стационарного состояния в другое, при которых выполняется правило отбора
l=±1;
•m – магнитное квантовое число. Оно характеризует проекцию момента импульса электрона на физически выделенное направление в пространстве (направление внешнего поля)
Mz = m |
(17.5) |
и принимает значения
m =0, ±1, ±2, ±3, …, ±l.
Магнитное квантовое число принимает 2l +1 значение, а при квантовых переходах электрона выполняется правило отбора
∆m =0, ±1.
211
Таким образом, одному и тому же значению энергии электрона в атоме отвечают несколько состояний с различными значениями l и m. Говорят, что такие состояния вырождены, а кратность вырождения (число состояний с одинаковыми значениями En ) равна числу всевозможных допустимых значений m :
n−1
∑(2l +1)=1+3+5+…+2(n −1)+1=n2.
l=0
Полученный результат не отражает возможных различий в ориентации собственного момента импульса электрона (спина). С учетом спина кратность вырождения получается вдвое большей.
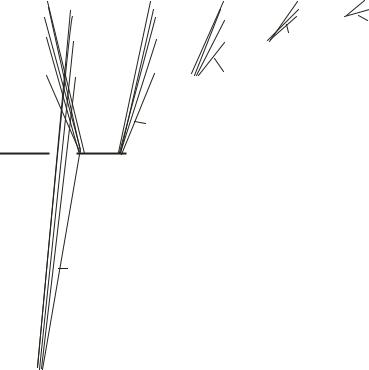
На рис. 17.2 показана схема энергетических уровней электрона в атоме водорода и возможные излучательные или поглощательные переходы между ними – спектральные линии, объединенные в спектральные серии. При переходе на более низкий энергетический уровень происходит испускание кванта электромагнитной энергии, а при переходе на более высокий уровень – поглощение.
Представленные на рис. 17.2 спектральные серии названы по имени известных ученых-спектроскопистов конца XIX–начала XX вв. Частоты линий излучения (поглощения) этих серий можно вычислить по вытекающей из (17.2) формуле:
ω |
|
= |
E |
|
−E |
|
= |
|
|
me4 |
|
|
Z 2 |
1 |
− |
1 |
|
; |
||||||||
nm |
n |
|
m |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
m2 |
n2 |
|||||||||||||||
|
|
|
|
|
|
|
32π2 3ε02 |
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
* |
|
2 |
1 |
|
|
|
|
1 |
|
|
|
|
||||||
|
|
|
|
ω |
= R Z |
|
|
|
|
− |
|
|
|
|
|
|
|
|
|
|
(17.6) |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
nm |
|
|
|
|
m2 |
|
|
|
n2 |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
или |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
= RZ |
2 |
|
1 |
− |
|
1 |
|
|
. |
|
|
|
(17.7) |
|||||||
|
|
|
|
|
λnm |
|
m2 |
n2 |
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
212
|
s |
|
|
p |
|
d |
|
|
f |
|
g |
|
h |
||||
l = 0 l = 1 l = 2 l = 3 l = 4 |
|
l = 5 |
|||||||||||||||
n = 5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Серия Пфунда |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
n = 4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
Серия Брэкета |
||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
n = 3 |
|
|
|
|
|
|
|
|
|
Серия Пашена (ИК) |
|||||||
|
|
|
|
|
|
|
|||||||||||
Серия Бальмера (видимый свет)
n = 2
Серия Лаймана (УФ)
n = 1 |
|
(E = -13,6 эВ) |
|
Рис. 17.2. Спектральные серии атома водорода
Формулы (17.6) и (17.7) называются формулами Ридберга в честь известного шведского физика И. Р. Ридберга (1854–1919), систематизатора атомных спектров.
Постоянные
R* = 2,07 1016 с−1
и
R = R* / (2πc)=1,097 107 м−1
называются постоянными Ридберга.
213

Иногда выражение (17.7) называют сериальной формулой Бальмера, отдавая дань уважения швейцарскому учителю физики И. Бальмеру, установившему ее частный случай для m = 2 (серия Бальмера).
Согласно выражениям (16.16), (17.3), радиальное распределение электронной плотности вероятности в водородоподобной системе
wn (r)~ |
|
Rn (r) |
|
2 . |
(17.8) |
|
|
Графики этого распределения для s- и p-состояний в атоме водорода представлены на рис. 17.3.
wn (r)
а
0 wn (r)
б
0
n = 1
n = 2 |
|
|
|
s-состояние (l = 0) |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
n = 3 |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
10 |
20 |
30 |
|
|
rВ1 |
|||||||
n = 2
p-состояние (l = 1)
n = 3
|
|
|
|
|
|
rВ1 |
|
|
|
|
|
|
|
10 |
20 |
30 |
||||
Рис. 17.3. Радиальное распределение электронной плотности вероятности
в атоме водорода: s-состояние (а), p-состояние(б). Расстояние от электрона до ядра отложено в значениях радиуса первой боровской орбиты
rB1 ≈ 0,53 A
Угловое распределение электронной плотности вероятности
wlm (θ,ϕ)~ |
|
Ylm (θ,ϕ) |
|
2 |
(17.9) |
|
|
||||
|
|
|
|
|
|
представлено на рис. 17.4.
214

|
|
m = 1 |
m = 2 |
|
|
|
m = 1 |
3s |
3p |
m = 0 3d |
m = 0 |
|
|
|
m = -1 |
|
|
m = -1 |
m = -2 |
2s |
2p |
m = 0 |
 z
z
1s
Рис. 17.4. Угловое распределение электронной плотности вероятности
в атоме водорода для низкоэнергетических состояний. Внешнее поле направлено вдоль оси z
Рис. 17.3, 17.4 дают представление о местах наиболее и наименее вероятного положения электрона относительно ядра в атоме водорода для различных квантовых состояний. Для водородоподобных ионов рассмотренные распределения имеют похожий вид.
§2. Многоэлектронные атомы
Впредыдущем параграфе мы уже упоминали о наличии у электрона собственного момента импульса – спина. Величина спина характеризуется так называемым спиновым квантовым числом s через формулу, похожую на (17.4):
Ms = |
|
, |
(17.10) |
s(s +1) |
215
а его проекция на физически выделенное направление – через формулу, похожую на (17.5):
Msz = ms , |
(17.11) |
где ms – магнитное спиновое квантовое число. У электрона s =1/ 2, а
ms = ±1/ 2.
Все микрочастицы делятся на два класса. Частицы с целочисленными значениями спинового квантового числа называются бозонами (в честь индийского физика Ш. Бозе), а частицы с дробными (полуцелыми) значениями s – фермионами (в честь итальянского физика Э. Ферми). Бозоны являются «коллективистами»: они «обожают» себе подобные частицы и могут накапливаться в любом квантовом состоянии в любом количестве. Фермионы, наоборот, являются «индивидуалистами»: в одном квантовом состоянии может находиться не более одного фермиона. Такое поведение фермионов было установлено в 1924 г. В. Паули и получило название принципа Паули. Применительно к электронам в атоме принцип Паули можно сформулировать следующим образом:
В одном атоме не может быть двух и более электронов с одинаковым набором квантовых чисел.
Состояние электрона в атоме можно охарактеризовать четырьмя квантовыми числами: n, l, m, и ms. В дальнейшем нам будет удобнее пользоваться другим набором квантовых чисел для отдельных электронов в атоме:
•n – главное квантовое число;
•l – орбитальное квантовое число;
•j – квантовое число полного момента импульса, складываемого из орбитального и спинового моментов;
•mj – квантовое число проекции полного момента импульса на физически выделенное направление в пространстве.
216
Квантовые числа j и mj принимают значения через единицу и вычисляются по следующим правилам:
|
l −s |
|
≤ j ≤ |
|
l +s |
|
, |
(17.12) |
|
|
|
|
|||||
|
− j ≤ mj ≤ j . |
(17.13) |
||||||
В многоэлектронном атоме электроны стараются сначала заполнить состояния с меньшей энергией (такие состояния более устойчивы), постепенно переходя в состояния с большей энергией. Но при этом неукоснительно должен соблюдаться принцип Паули. Распределение электронов в атоме по состояниям происходит с образование
оболочек и подоболочек.
Оболочкой называется совокупность электронов в атоме, имеющих одинаковые значения главного квантового числа n.
Внутри оболочки электроны вырождены по всем остальным квантовым числам, кроме n. Следовательно, максимальное количество электронов, которые могут находиться в одной оболочке, составляет Nn =2n2 (см. § 1 настоящей лекции). В зависимости от значения n оболочкам присваиваются следующие буквенные обозначения:
Оболочка |
K |
L |
M |
N |
O |
P |
Q |
… |
|
|
|
|
|
|
|
|
|
n |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
… |
|
|
|
|
|
|
|
|
|
Nn |
2 |
8 |
18 |
32 |
50 |
72 |
98 |
… |
|
|
|
|
|
|
|
|
|
Подоболочкой называется совокупность электронов внутри одной оболочки, имеющих одинаковые значения орбитального квантового числа l.
217
Максимальное количество электронов, могущих находиться в одной подоболочке, составляет Nl =2(2l +1) , так как m пробегает значения чрез единицу от -l до l , и для каждого значения m возможны два значения ms . В зависимости от значения l подоболочкам присваиваются следующие буквенные обозначения:
Подболочка |
s |
p |
d |
f |
g |
h |
… |
|
|
|
|
|
|
|
|
l |
0 |
1 |
2 |
3 |
4 |
5 |
… |
|
|
|
|
|
|
|
|
Nl |
2 |
6 |
10 |
14 |
18 |
22 |
… |
В действительности, в основном состоянии атома подоболочки высоких номеров часто оказываются незаполненными, так как из-за вытянутости соответствующих угловых распределений электронной плотности вероятности (атомных орбиталей) энергия электрона в таких состояниях должна быть большей, чем в s-состоянии следующей оболочки. Поэтому, по принципу минимума энергии, оказывается более выгодным начать застройку следующей оболочки.
До калия заполнение энергетических состояний идет согласно возрастанию чисел n и l . Но уже у калия, имеющего 19 электронов, электронная конфигурация выглядит следующим образом:
1s2 2s2 2p63s23p63d0 4s1,
т. е. пропущены целых десять d-состояний в M-оболочке. Здесь числа 1, 2, 3 и т. д. означают номер оболочки (значения квантового числа n), а буквы s, p, d и т. д. – номер подоболочки (буквенные обозначения для орбитального квантового числа l). Верхние индексы указывают число электронов в соответствующей подоболочке. Подобные нарушения последовательности заполнения состояний нарастают по мере приближения к концу таблицы Менделеева.
218
Химические свойства элементов не зависят от внутренних заполненных электронами оболочек, а определяются количеством электронов на внешней оболочке, так называемыми валентными электронами. Химическое сродство разных элементов определяется тем обстоятельством, что у похожих по своим химическим свойствам элементов в одинаковых валентных оболочках, независимо от номера оболочки, находится одинаковое число электронов. Так, например, у всех щелочных металлов единственный валентный электрон находится в s-подоболочке.
§3. Характеристическое рентгеновское излучение
В1895 г. немецкий физик-экспериментатор В. Рентген открыл излучение с длиной волны, более короткой, чем длина волны ультрафиолетовых лучей. Это излучение получило название рентгеновского излучения или X-лучей. Его источником являются рентгеновские трубки, некоторые радиоактивные изотопы, ускорители частиц. Собственно говоря, Рентген открыл так называемое тормозное рентгеновское излучение, возникающее при торможении электронов при попадании на антикатод рентгеновской трубки и имеющее сплошной спектр. Однако при высоких напряжениях, приложенных к рентгеновской трубке, на фоне сплошного спектра наблюдаются четкие линии другого вида рентгеновского излучения, названного характери-
стическим рентгеновским излучением, спектр которого зависит от материала антикатода.
Детальное исследование этого вида рентгеновского излучения было проведено английским физиком Г. Мозли, открывшим в 1913 г. закон, которому подчиняются длины волн линий излучения:
219
1 |
= R(Z −σ ) |
2 1 |
1 |
|
|
||
|
|
|
− |
|
. |
(17.14) |
|
λnm |
m2 |
n2 |
|||||
Выражение (17.14) очень похоже на формулу Ридберга (17.7), описывающую длины волн излучения в спектрах одноэлектронных систем (атома водорода и водородоподобных ионов), отличаясь от последней лишь величиной σ , называемой постоянной экранирования.
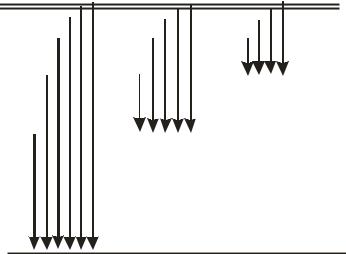
Природа характеристического рентгеновского излучения имеет простое объяснение. Ускоренные сильным электрическим полем электроны выбивают электроны из внутренних электронных оболочек атомов антикатода. На их место приходят электроны из оболочек более высокого номера. Так, при удалении электронов из К-оболочки возникает К-серия излучения, при удалении электронов из L-оболочки – L-серия и т. д. (рис. 17.5). В пределах одной серии линии излучения снабжаются индексами, например, Kα, Kβ, Kγ , ….
N |
|
|
|
|
|
|
|
|
|
|
|
M |
|
|
|
|
|
|
|
M-серия |
|
|
|
|
|
|
|
|
|
L |
|
|
|
|
|
|
|
L-серия |
|
|
|
|
|
|
|
|
K
K-серия
Рис. 17.5. Спектр характеристического рентгеновского излучения
220
