
1-280 pdf
.pdf
Machine Translated by Google
. Nhóm tác giả. “Nội bệnh. Tập 1 "
Các mảng xơ vữa động mạch dễ bị tổn thương hoặc chưa trưởng thành được phân biệt bởi một bao mô liên kết mỏng và một lõi lipid lỏng. Các mảng xơ vữa động mạch chưa trưởng thành thường không gây co mạch đáng kể về mặt huyết động. Trong khi đó, họ đang
sự hình thành nguy hiểm hơn các mảng ổn định, vì nắp xơ của như vậy mảng ít chống lại các yếu tố huyết động và protease. Sự vi phạm
sự toàn vẹn của tegmentum của một mảng xơ vữa động mạch chưa trưởng thành có thể dẫn đến sự hình thành huyết khối tắc và thiếu máu cục bộ cấp tính của cơ quan mà không có dấu hiệu thiếu máu cục bộ mãn tính
trước đó - ví dụ, đến sự phát triển của nhồi máu cơ tim mà không có cơn đau thắt ngực trước đó. Tại giáo dục của cục huyết khối không tắc ở vùng tổn thương mảng xơ vữa động mạch chưa trưởng thành, thiếu máu
cục bộ có thể tăng lên do phản ứng co thắt của các cơ trơn thành mạch chưa mất khả năng co bóp để đáp ứng với tác dụng của tiểu cầu. tiết ra
hợp chất hoạt mạch.
Hình thái học. Các tổn thương xơ vữa của thành mạch được chia thành
sáu giai đoạn (loại). Loại I được đặc trưng bởi sự tích tụ của các đại thực bào và các tế bào bọt dưới nội mô ở những nơi chịu áp lực cơ học mạnh nhất
(sự phân nhánh và khúc cua gấp của động mạch). Sự lắng đọng của các tế bào bọt và các tế bào cơ trơn chứa đầy lipid tạo thành các vệt lipid, đó là một dấu hiệu
tổn thương loại II. Tổn thương loại III được đặc trưng bởi sự hiện diện của không chỉ trong tế bào, mà còn lắng đọng lipid ngoại bào, cũng như vi phạm tính toàn vẹn của cơ quan. Qua
khi chúng phát triển, tích tụ ngoại bào của lipid hợp nhất vào lõi lipid của xơ vữa động mạch các mảng, sự hình thành trong số đó được coi là tổn thương loại IV. Đối với loại thất bại
V được đặc trưng bởi sự hình thành của một lớp mô liên kết dạng sợi dày, tạo thành
bìa của một mảng xơ vữa động mạch. Tegmentum được ngăn cách với dòng máu bởi một lớp tế bào nội mô. Dấu hiệu của tổn thương loại VI là các vết nứt trên nắp mảng xơ vữa động mạch, tụ máu và huyết khối bên trong.
Các mảng xơ vữa động mạch chưa trưởng thành thường chiếm ít hơn một nửa chu vi của động mạch bị ảnh hưởng và hơi thu hẹp lòng mạch của nó. Do hàm lượng lipid cao và sự hiện diện của một nang mô liên kết tương đối mỏng, các mảng như vậy
có màu vàng. Các mảng xơ vữa trưởng thành thường đồng tâm và gây co mạch đáng kể về mặt huyết động. Các mảng của loại này có màu trắng
màu sắc, bởi vì qua bao xơ của chúng (dày hơn so với các mảng chưa trưởng thành), lõi lipid không xuyên qua được. Một tính năng đặc trưng của các mảng xơ vữa động mạch trưởng thành là
sự phì đại rõ rệt của tế bào cơ trơn.
hình ảnh lâm sàng. Biểu hiện lâm sàng của xơ vữa động mạch được xác định bằng khu trú, tốc độ tiến triển và mức độ nghiêm trọng của các thay đổi hình thái. Phần lớn
Các mảng xơ vữa thường phát triển ở động mạch vành, não, động mạch thận, động mạch chi dưới và động mạch chủ. Cho đến khi sự thu hẹp của tàu đạt đến mức độ quan trọng,
huyết khối, phình mạch hoặc tắc mạch sẽ không phát triển, xơ vữa động mạch không có triệu chứng. Tại
quá trình tiến triển chậm và thu hẹp dần của tàu bị ảnh hưởng
hiện nay một triệu chứng của xơ vữa động mạch phản ánh sự không thể tăng lưu lượng máu khi tăng
giảm nhu cầu oxy của mô. Ví dụ về một biến thể như vậy của quá trình xơ vữa động mạch có thể là phục vụ như cơn đau thắt ngực và ngắt quãng. Hẹp động mạch thận chậm được biểu hiện bằng tăng huyết áp mạch máu. Trong trường hợp động mạch bị tắc nghẽn đột ngột do huyết khối hoặc tắc mạch, các triệu chứng lâm sàng của thiếu máu cục bộ cấp tính xảy ra (ví dụ,
MI, đột quỵ). Với tổn thương lan rộng của các động mạch lớn, sự hình thành
chứng phình động mạch. Nguyên nhân phổ biến nhất của xơ vữa động mạch là chứng phình động mạch bụng.
động mạch chủ.
Đôi khi, thường ở những bệnh nhân bị tăng lipid máu có tính chất gia đình (di truyền), có sự lắng đọng lipid ở độ dày của da - xanthoma và xanthelasma. Xanthomas đại diện
21

Machine Translated by Google
. Nhóm tác giả. “Nội bệnh. Tập 1 "
dày lên dọc theo Achilles và các gân khác, trong khu vực của khớp xương ức. Trong một số trường hợp, các xanthomas dạng củ hình thành trên khuỷu tay và các xanthomas nhỏ trên
da toàn thân. Xanthelasma là các nốt sần màu vàng trên mí mắt và vùng da xung quanh con mắt. Vòm mỡ là một dấu hiệu bệnh lý của tăng cholesterol máu gia đình.
giác mạc - sự hình thành sáng ở dạng vòng hoặc nửa vòng dọc theo rìa giác mạc. Phòng thí nghiệm và chẩn đoán công cụ. Trong một tỷ lệ đáng kể bệnh nhân có
Các dấu hiệu lâm sàng của bệnh, dựa trên xơ vữa động mạch, cho thấy những thay đổi đặc trưng trong phổ lipid của máu. Rối loạn lipid máu thường được phát hiện và
ở giai đoạn tiền lâm sàng của quá trình xơ vữa động mạch. Tuy nhiên, phổ lipid bình thường
máu không loại trừ chẩn đoán xơ vữa động mạch.
Các phương pháp chẩn đoán hình ảnh được sử dụng để phát hiện các mảng xơ vữa ở các động mạch lớn và trung bình, chủ yếu là chụp mạch và siêu âm bằng tia phóng xạ. Trong những năm gần đây, ngày càng có nhiều phương pháp tiên tiến được sử dụng trong thực hành lâm sàng. phương pháp hình ảnh - siêu âm nội mạch, chụp cắt lớp vi tính, chụp cộng hưởng từ. Với sự trợ giúp của các kỹ thuật hình ảnh hiện đại
có thể chẩn đoán các dấu hiệu ban đầu của xơ vữa động mạch, đánh giá kích thước của mảng xơ vữa và mối quan hệ của chúng với thành mạch, và phát hiện các mảng xơ vữa động mạch bị loét.
Theo yêu cầu của hướng dẫn quốc gia về chẩn đoán và điều chỉnh rối loạn chuyển hóa lipid, tất cả nam giới đều phải sàng lọc để phát hiện rối loạn lipid máu.
trên 35 tuổi và tất cả phụ nữ trên 45 tuổi. Nên sàng lọc cho
liên hệ với bác sĩ, bất kể lý do là gì, và trong quá trình kiểm tra phòng ngừa định kỳ. Ở những loại bệnh nhân này, nên xác định nồng độ
tổng lượng cholesterol trong máu và ở giá trị bình thường của nó, lặp lại phân tích tổng số cholesterol một lần
5 năm. Nếu nồng độ cholesterol toàn phần vượt quá 5 mmol / l thì cần lấy phổ lipid chi tiết: cholesterol toàn phần, TG, HDL cholesterol, LDL cholesterol, xác định nguy cơ biến chứng do Thang điểm SCORE, đưa ra các đề xuất về thay đổi lối sống và sau đó, nếu cần,
kê đơn thuốc. Ở nam 20-35 tuổi và nữ 20-45 tuổi, tầm soát
nó được khuyến khích thực hiện trong sự hiện diện của bệnh đái tháo đường, di truyền trầm trọng hơn bởi các bệnh tim mạch, tiền sử gia đình cho thấy di truyền
tăng lipid máu, và sự kết hợp của một số yếu tố nguy cơ. Trong loại bệnh nhân này
bạn cần có được một hồ sơ lipid hoàn chỉnh. Ở trẻ em và thanh thiếu niên, phân tích toàn bộ phổ lipid máu được coi là cần thiết nếu tiền sử gia đình bị trầm trọng hơn bởi
về các bệnh tim mạch.
Việc khám một bệnh nhân nghi ngờ rối loạn lipid máu hoặc một bệnh mà cơ sở hình thái là xơ vữa động mạch bao gồm nhiều giai đoạn. Đầu tiên, cần phải xác định hồ sơ lipid hoàn chỉnh trong máu được lấy khi đói (sau 9-12 giờ nhịn ăn) và tính hệ số sinh xơ vữa. Sau đó, bạn cần xác định sự hiện diện của chính
biểu hiện lâm sàng của xơ vữa động mạch (IHD, xơ vữa động mạch cảnh, làm mất mảng xơ vữa của mạch chi dưới, phình động mạch chủ bụng) và / hoặc
các yếu tố nguy cơ chính (hút thuốc lá, tăng huyết áp, tiền sử gia đình có biểu hiện sớm bệnh mạch vành, tuổi).
Sau đó, cần xác định phân loại nguy cơ tử vong trong 10 năm do các bệnh tim mạch và thiết lập giá trị mục tiêu của LDL-C phù hợp với phân loại.
rủi ro. Các biện pháp được liệt kê là cần thiết để lựa chọn chiến thuật điều trị hợp lý. liên quan đến một bệnh nhân cụ thể và theo dõi hiệu quả điều trị của anh ta.
Chẩn đoán. Trong những trường hợp xơ vữa động mạch là cơ sở hình thái của bất kỳ bệnh nào có các biểu hiện lâm sàng độc lập riêng biệt (các dạng lâm sàng khác nhau của bệnh mạch vành, tai biến mạch máu não cấp tính, mạch máu
AG), thuật ngữ này không được chấp nhận khi xây dựng chẩn đoán. Nếu bệnh
22

Machine Translated by Google
. Nhóm tác giả. “Nội bệnh. Tập 1 "
Vì các rối loạn cấu trúc của thành động mạch lớn và bộ máy van tim liên quan đến xơ vữa động mạch, nên thuật ngữ "xơ vữa động mạch" được đưa vào công thức chẩn đoán.
Các ví dụ chẩn đoán.
1.Xơ vữa động mạch chủ. Phình động mạch chủ bụng.
2.Xơ vữa động mạch chủ. Mổ phình động mạch chủ. Nhọn
thiểu năng van động mạch chủ.
Lưu lượng. Xơ vữa động mạch được đặc trưng bởi một quá trình nhấp nhô với sự thay đổi của các giai đoạn đợt cấp và thuyên giảm. Trong đợt cấp của chứng xơ vữa động mạch, sự hình thành các mảng xơ vữa động mạch mới
và sự phát triển nhanh chóng của chúng, tổn thương các mảng với sự hình thành huyết khối nội mạch và các triệu chứng lâm sàng tương ứng được ghi nhận. Trong thời gian thuyên giảm
các biểu hiện lâm sàng của xơ vữa động mạch được xác định bởi vị trí và mức độ nghiêm trọng của tắc nghẽn mạch máu, tức là mức độ thiếu máu cục bộ mãn tính của cơ quan nhận được nguồn cung cấp máu từ
động mạch bị ảnh hưởng. Trong trường hợp tiến triển chậm, xơ vữa động mạch có thể thời gian - cho đến khi hình thành sự co mạch đáng kể về mặt sinh lý - không kèm theo
Triệu chứng lâm sàng.
Dự báo và kết quả. Nguy cơ phát triển và bản chất của các biến chứng, tuổi thọ
bệnh nhân và nguyên nhân tử vong được xác định bởi loại và đặc điểm của quá trình bệnh phát triển trên cơ sở xơ vữa động mạch. Điều quan trọng đối với dự báo là
tốc độ tiến triển của xơ vữa động mạch và mức độ nghiêm trọng của các quá trình thích ứng trong các cơ quan và
các mô thiếu máu cục bộ.
Sự đối đãi. Điều trị không dùng thuốc. Cơ sở của phòng ngừa xơ vữa động mạch chủ yếu và thứ phát là thay đổi lối sống. Các biện pháp điều trị không dùng thuốc
các biện pháp can thiệp bao gồm chế độ ăn kiêng, quản lý cân nặng, tăng cường hoạt động thể chất và cai thuốc lá.
Số lượng calo tiêu thụ với thức ăn không được vượt quá mức cần thiết để duy trì trọng lượng cơ thể lý tưởng cho bệnh nhân. Bạn cần hạn chế ăn chất béo
Nguồn gốc động vật. Lượng chất béo (bao gồm cả chất béo thực vật) được tiêu thụ trong trong ngày, không nên nhiều hơn 30% tổng hàm lượng calo, và tỷ lệ
chất béo bão hòa không được nhiều hơn 7% tổng số của chúng. Ở những người không bị rối loạn protein máu, có biểu hiện lâm sàng của chứng xơ vữa động mạch và nguy cơ tử vong cao trong 10 năm
khỏi các bệnh tim mạch, lượng cholesterol từ thức ăn không được vượt quá 300 mg /
ngày Trong các trường hợp khác, lượng cholesterol tiêu thụ hàng ngày với thức ăn nên được giới hạn ở mức 200 mg.
Tác động tiêu cực của cholesterol trong chế độ ăn uống đối với chuyển hóa lipid ít đáng kể hơn so với tiêu thụ chất béo bão hòa. Về vấn đề này, khi giải thích cho bệnh nhân các nguyên tắc ăn uống lành mạnh
trước hết cần nhấn mạnh sự cần thiết phải giảm tiêu thụ chất béo bão hòa. Nên thay thế bơ thực vật cứng và chất béo nấu ăn bằng dầu thực vật. Từ chế độ ăn uống nên loại trừ các sản phẩm thịt có hàm lượng chất béo cao,
thay thế chúng bằng thịt nạc, cá, thịt gia cầm, các loại đậu. Cá biển nhiều dầu (cá hồi, cá ngừ,
cá thu), chứa nhiều axit béo không no omega-3 có tác dụng ngăn ngừa sự phát triển của xơ vữa động mạch, nên sử dụng 2-3 lần / tuần. Tiêu dùng hàng ngày
rau và trái cây tươi có chứa chất xơ ngăn cản sự hấp thu cholesterol, nên (trừ khoai tây) ít nhất 400 g. Nên tiêu thụ hàng ngày
sữa và các sản phẩm từ sữa có hàm lượng chất béo thấp. Tỷ lệ đường trong khẩu phần ăn hàng ngày
(kể cả đường có trong thức ăn) không được vượt quá 10% tổng lượng calo. Tổng lượng muối ăn tiêu thụ mỗi ngày không được vượt quá
hơn 6 g. Tỷ lệ năng lượng sau được coi là tối ưu: protein - 15%, chất béo - 30%, carbohydrate - 55% tổng lượng calo mỗi ngày.
23

Machine Translated by Google
. Nhóm tác giả. “Nội bệnh. Tập 1 "
Chỉ số khối cơ thể (BMI) được sử dụng để ước tính trọng lượng cơ thể, được tính theo công thức sau:
2
BMI \ u003d Cân nặng, kg: Chiều cao, m
Chỉ số khối cơ thể bình thường nằm trong khoảng 18,5 - 25 kg / m2 . Giảm cân
cơ thể đạt được nhờ một chế độ ăn uống ít chất béo và tập thể dục thường xuyên. Trong những trường hợp khó đạt được trọng lượng cơ thể tối ưu,
khuyến nghị giảm 10% trọng lượng so với ban đầu hoặc giảm chỉ số khối cơ thể lên đến
27 kg / m2 khi duy trì chỉ số này ở mức đạt được sau đó.
Khi lựa chọn mức độ hoạt động thể chất hàng ngày, cần tính đến tuổi của bệnh nhân, tình trạng của hệ tim mạch, hệ cơ xương và các hệ thống giải phẫu và sinh lý khác. Sinh lý nhất, an toàn và giá cả phải chăng
loại hoạt động thể chất là đi bộ. Thời lượng đề xuất của các lớp học -
30 - 45 phút, tần suất - 4 - 5 lần một tuần. Khi chọn tốc độ đi bộ riêng, bạn nên tập trung vào nhịp tim, ở độ cao của tải
phải đạt 70% mức tối đa cho một độ tuổi nhất định. Nhịp tim tối đa được tính theo công thức:
HRmax = 220 - tuổi (năm)
Đối với bệnh nhân bệnh mạch vành, khi xác định nhịp độ đi bộ tối ưu, cần dimo có tính đến kết quả của bài kiểm tra với hoạt động thể chất (veloergometry).
Cai thuốc lá là một phần thiết yếu của việc ngăn ngừa thành công
xơ vữa động mạch. Khi nhận được khuyến cáo từ bỏ thói quen xấu này, bệnh nhân cần được thông báo rằng không chỉ
chủ động, nhưng cũng hút thuốc thụ động. Nếu cần để tạo điều kiện cho việc cai thuốc lá
Liệu pháp thay thế nicotine có thể được sử dụng.
Theo kết quả của một số nghiên cứu thực nghiệm và lâm sàng, tiêu
liều lượng nhỏ rượu có thể làm giảm nguy cơ tử vong do bệnh mạch vành. Tác dụng bảo vệ của rượu liên quan đến tác dụng chống căng thẳng của nó, làm tăng mức HDL cholesterol và giảm khả năng đông máu của huyết tương. Tuy nhiên, những người lạm dụng rượu
nguy cơ tử vong tăng lên đáng kể. An toàn cho sức khỏe là lượng cồn nguyên chất uống hàng ngày, không quá 30 g đối với nam và 20 g đối với nữ. Bệnh nhân cao huyết áp
bệnh gút, béo phì và rối loạn nhịp tim không nên uống rượu.
Ở những bệnh nhân đang dùng statin, uống rượu có thể gây tiêu cơ vân. Có tính đến các đặc điểm quốc gia, không phù hợp để cư dân Nga đề xuất
Mục tiêu của việc ngăn ngừa xơ vữa động mạch là thường xuyên uống rượu với liều lượng nhỏ, vì
điều này có liên quan đến nguy cơ nghiện rượu cao, tác hại của nó vượt xa lợi ích của khuyến cáo này.
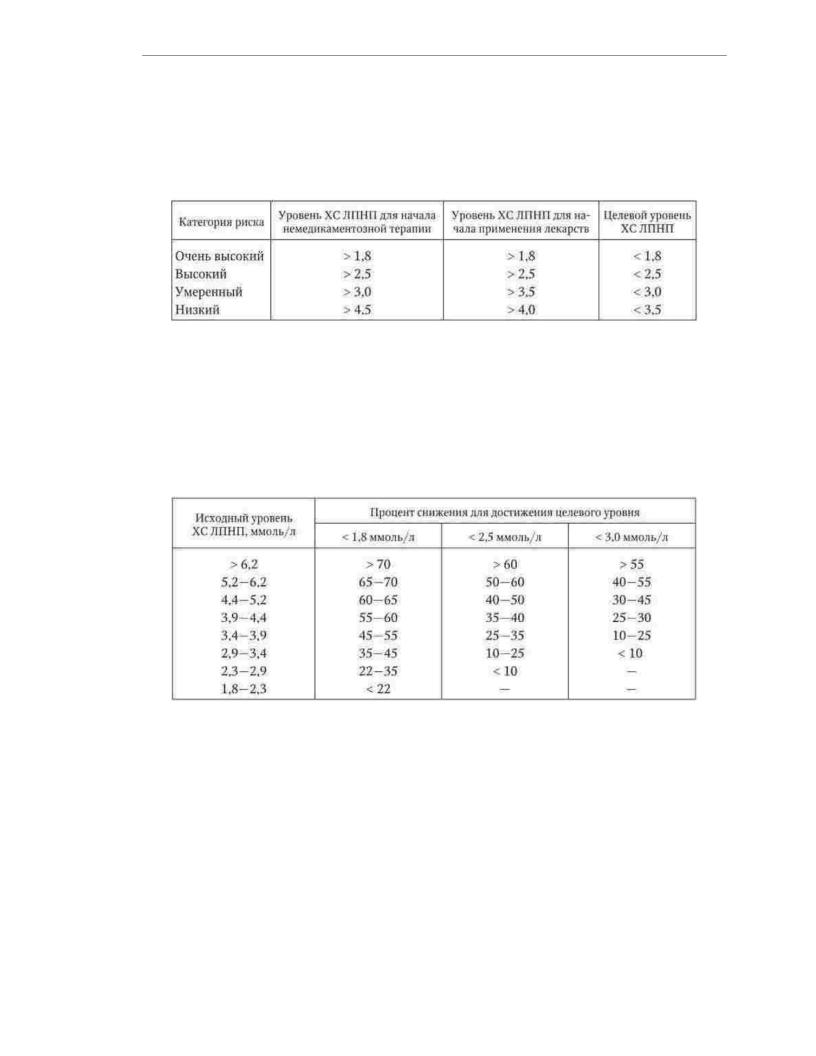
Điều trị y tế. Chỉ định sử dụng thuốc được xác định tùy thuộc vào loại nguy cơ tử vong trong 10 năm do các bệnh tim mạch và mức LDL-C của bệnh nhân (Bảng 1.4). Ở những người có nguy cơ trung bình và thấp, chỉ có thể sử dụng các biện pháp không dùng thuốc để phòng ngừa xơ vữa động mạch
3 tháng Nếu trong thời gian này không thể đạt được mức LDL-C mục tiêu, điều trị y tế sẽ được bắt đầu. Ở những bệnh nhân có nguy cơ cao và rất cao, việc sử dụng thuốc
Thuốc nên được bắt đầu đồng thời với điều trị không dùng thuốc. Trước khi bắt đầu
24
Machine Translated by Google
. Nhóm tác giả. “Nội bệnh. Tập 1 "
điều trị, nên tính toán bằng bao nhiêu (theo tỷ lệ phần trăm của giá trị ban đầu) cần thiết để giảm hàm lượng cholesterol LDL trong máu để đạt được mức mục tiêu (Bảng 1.5).
Bảng 1.4
Mức cholesterol LDL để xác định chiến thuật điều trị bệnh nhân và mức mục tiêu
Cholesterol LDL tùy thuộc vào loại nguy cơ (mmol / l)
Thuốc để điều chỉnh các rối loạn chuyển hóa lipid bao gồm:
Chất ức chế HMG-CoA reductase (statin), ezetimibe, chất cô lập axit mật (nhựa trao đổi ion), dẫn xuất axit fibric (fibrat), axit nicotinic (niacin)
và axit béo không bão hòa đa omega-3.
Bảng 1.5
Cần giảm LDL-C để đạt được mức mục tiêu (% từ bản gốc)
Statin. Cơ chế hoạt động của statin dựa trên sự ức chế enzym quan trọng của giai đoạn đầu tổng hợp cholesterol, HMG-CoA reductase. Với việc giảm hoạt động của điều này
Enzyme, xảy ra sự thiếu hụt cholesterol nội bào trong thời gian ngắn. Kết quả là, tế bào gan biểu hiện số lượng tăng các thụ thể LDL, dẫn đến tăng hấp thu LDL-C từ huyết tương. Đồng thời, do sự thay đổi tỷ lệ các dạng lipoprotein trung gian, mức độ chất béo trung tính giảm vừa phải xảy ra và liên quan đến điều này
và một số tăng mức HDL. Ngoài việc ảnh hưởng đến phổ lipid máu, statin có một số hiệu ứng bổ sung (đa hướng), trong đó chính là:
ức chế sự tổng hợp của các chất trung gian gây viêm, cải thiện chức năng nội mô, phòng ngừa sự thay đổi oxy hóa của LDL, sự ổn định của bao xơ xơ vữa động mạch
mảng, tác dụng kháng huyết khối. Statin được sử dụng để điều trị bệnh nhân tăng lipid máu loại IIa, IIb và III. Nhóm thuốc này có thể làm giảm mức cholesterol LDL.
từ 25 - 50%. Một số statin cũng có tác dụng hạ chất béo trung tính. Ví dụ, việc sử dụng atorvastatin có thể làm giảm mức chất béo trung tính từ 25-45%. Trong lâm sàng
25

Machine Translated by Google
. Nhóm tác giả. “Nội bệnh. Tập 1 "
Trong thực tế, các loại thuốc sau được sử dụng: lovastatin (mevacor) - 20 - 80 mg / ngày, simvastatin (zocor) - 10 - 40 mg / ngày, pravastatin (lipostat) - 20 - 40 mg / ngày, fluvastatin (leskol) - 20 - 40 mg / ngày, atorvastatin (liprimar) - 10 - 20 mg / ngày, rosuvastatin (crestor) - 5 - 10 mg / ngày ngày Trong những năm gần đây, khái niệm về liệu pháp hạ lipid máu “tích cực” ngày càng trở nên phổ biến, theo đó những bệnh nhân có nguy cơ cao và rất cao mắc
đạt được các giá trị LDL-C mục tiêu, liều cao statin được sử dụng: simvastatin
và atorvastatin - lên đến 80 mg / ngày, rosuvastatin - lên đến 40 mg / ngày. Để giảm mức cholesterol LDL simvastatin với liều 40 mg / ngày, atorvastatin với liều 20 mg / ngày, rosuvastatin với liều 5– 10 mg / ngày, để giảm LDL cholesterol 45–50%
từ liều ban đầu của simvastatin nên là 80 mg / ngày, liều atorvastatin - 40 mg / ngày,
liều rosuvastatin - 20 mg / ngày. Statin được sử dụng một lần một ngày, vào buổi tối, sau bữa ăn. Statin là loại thuốc khá an toàn. Thỉnh thoảng dùng statin
có thể kèm theo đau bụng, đầy hơi, táo bón. Ở 1-3% bệnh nhân, sự gia tăng hoạt động của các men gan được quan sát thấy. Ngừng statin được coi là
Được chứng minh nếu, trong khi điều trị, mức alanin hoặc aspartic aminotransferase trong hai lần đo liên tiếp vượt quá giới hạn trên hơn 3 lần
giá trị bình thường. Đau cơ và bệnh cơ xảy ra dưới 1% các trường hợp statin. Bệnh cơ nặng được biểu hiện bằng đau cơ, yếu cơ và tăng hoạt động của creatine phosphokinase, gấp 5 lần giới hạn trên của mức bình thường.
Nếu bệnh cơ không được chẩn đoán kịp thời và không ngừng dùng statin, có thể
sự phát triển của tiêu cơ vân, một biến chứng hiếm gặp và nghiêm trọng của điều trị bằng thuốc.
Ezetimibe ức chế sự hấp thụ cholesterol, làm giảm hàm lượng của nó trong tế bào gan, và kết quả là làm tăng biểu hiện của các thụ thể LDL và tăng hấp thu cholesterol.
LDL từ huyết tương. Thuốc không ảnh hưởng đến sự hấp thu axit béo, triglycerid và các vitamin tan trong chất béo. Ezetimibe được khuyến nghị sử dụng kết hợp với statin để
không đủ hiệu quả ở liều điều trị trung bình. Có thể sử dụng cái này thuốc và đơn trị liệu với cá nhân không dung nạp statin. ezetimibe được kê đơn với liều 10 mg một lần một ngày, bất kể lượng thức ăn.
Chất cô lập axit mật là các hợp chất cao phân tử phức tạp liên kết các axit mật trong lòng ruột non, ngăn cản sự tái hấp thu của chúng. Kết quả là, quá trình tổng hợp axit mật trong gan được kích hoạt và nhu cầu
trong cholesterol cần thiết cho quá trình này. Tăng biểu hiện của các thụ thể trong tế bào gan LDL, làm tăng dòng chảy của cholesterol từ máu đến các tế bào gan. Trên nền
điều trị bằng thuốc cô lập acid mật, mức cholesterol LDL giảm 15 - 30%. Các chất cô lập axit mật đã được sử dụng làm thuốc giảm lipid trong hơn 30 năm.
Các loại thuốc được biết đến nhiều nhất của nhóm này là cholestyramine (8–24 g / ngày) và cholestipol (5–30 g / ngày). Điều trị bằng các loại thuốc này thường gây ra táo bón và rối loạn tiêu hóa. Tác dụng phụ của chất cô lập axit mật bao gồm
tăng triglycerid máu. Về vấn đề này, chúng được chống chỉ định trong bệnh tăng lipid máu độ III và IV. các loại. Ngoài ra, các chất cô lập axit mật cản trở sự hấp thu của các loại thuốc khác và các vitamin tan trong chất béo, vì vậy chúng nên được uống trước 1 đến 2 giờ hoặc
4 giờ sau khi dùng các loại thuốc khác.
Chất xơ hoạt hóa lipoprotein lipase ở gan, ức chế các men tham gia tổng hợp acid béo, tăng đào thải cholesterol qua mật. Do ảnh hưởng đến sự chuyển hóa của VLDL, fibrat đáng kể, từ 30-50%, làm giảm mức độ chất béo trung tính. Ngoài ra, các loại thuốc thuộc nhóm này làm giảm mức cholesterol LDL từ 10-15% và tăng mức độ
HDL cholesterol giảm 10 - 20%. Chỉ định chính cho việc sử dụng fibrat là tăng lipid máu loại IV kết hợp với mức HDL-C thấp. Trong trường hợp kết hợp
tăng lipid máu (loại IIb và III), có thể kết hợp fibrat với statin. Liều lượng
26

Machine Translated by Google
. Nhóm tác giả. “Nội bệnh. Tập 1 "
và tần suất dùng các thuốc chính trong nhóm này là: ciprofibrate (Lipanor) -
100 mg 1-2 lần một ngày, bezafibrate (cholestenorm) - 200 mg 2-3 lần một ngày, fenofibrate (lipantil 200 M và tricor 145 mg) - 200 mg và 145 mg, tương ứng, 1 lần mỗi ngày. Tác dụng phụ của fibrat được quan sát thấy ở 5-10% bệnh nhân. Thường xuyên nhất trong số này là
buồn nôn, đau bụng, táo bón, tiêu chảy, đầy hơi. Trong một số trường hợp, đau đầu đau và mất ngủ. Sự kết hợp của fibrat với statin làm tăng nguy cơ mắc bệnh cơ.
Việc sử dụng fibrat thế hệ đầu tiên có liên quan đến việc tăng nguy cơ mắc bệnh sỏi mật. Tác dụng phụ này không phải là đặc điểm của các loại thuốc hiện đại.
Axit nicotinic có tác dụng hạ axit béo bằng cách ức chế tổng hợp VLDL do làm giảm lượng axit béo từ mô mỡ. Cái này
Hiệu quả được thể hiện khi sử dụng axit nicotinic với liều 2 - 4 g / ngày. Trong bối cảnh điều trị axit nicotinic, làm giảm mức cholesterol LDL từ 10 - 20%, giảm mức độ
TG tăng 20 - 30% và mức cholesterol HDL tăng 15 - 20%. Chỉ định chính cho việc sử dụng axit nicotinic là tăng lipid máu loại IIb, cũng như tăng triglycerid máu kết hợp với mức cholesterol HDL thấp. Axit nicotinic được khuyến khích kê đơn
bệnh nhân có các loại tăng lipid máu được liệt kê kết hợp với xơ vữa làm tắt nghẽn mạch của các mạch ở chi dưới, vì hợp chất này có tác dụng giãn mạch mạnh. Dạng kéo dài của axit nicotinic - thuốc enduracin - được kê đơn với liều 0,5 g 3 lần một ngày. Tác dụng phụ: đỏ bừng mặt và trên
nửa người, cảm giác nóng, nhịp tim nhanh, ngứa. Những sự kiện này có thể được giảm thiểu tăng dần liều lượng axit nicotinic và kê đơn aspirin 30 phút trước khi uống.
với liều 0,125 g. Nên uống axit nicotinic trong bữa ăn.
Axit béo không bão hòa đa omega-3 có tác dụng chống xơ vữa tổng hợp bằng cách tăng cường hoạt động tiêu sợi huyết của huyết tương, chống viêm, phục hồi chức năng nội mô và cải thiện trạng thái chức năng.
màng tế bào, làm giảm mức triglycerid trong huyết tương. Thuốc thuộc nhóm này
được khuyến cáo để điều trị bệnh nhân tăng lipid máu loại IV và V. Việc sử dụng omega-3 axit béo không bão hòa đa có thể cải thiện tiên lượng của bệnh nhân sau nhồi máu cơ tim, bằng cách giảm nguy cơ tử vong nói chung, tim mạch và đột tử. Tác dụng này có liên quan đến
tác dụng ổn định của chúng trên màng tế bào cơ tim. Ở Nga, một loại thuốc có chứa axit béo bão hòa omega-3-polynene có độ tinh khiết cao, omacor, đã được đăng ký. Một viên nang của thuốc chứa khoảng 0,9 g omega-3
axit béo không bão hòa đa. Nó được khuyến khích để điều chỉnh tăng triglycerid máu uống 2-4 viên omacor mỗi ngày.
Trong một số trường hợp, thường là ở những bệnh nhân bị rối loạn lipid máu có tính chất gia đình, với sự gia tăng đáng kể mức cholesterol và lipoprotein gây xơ vữa, một quy trình plasmapheresis được sử dụng để điều chỉnh phổ lipid máu. Điện di chọn lọc giúp loại bỏ LDL một cách có chọn lọc khỏi máu bằng cách sử dụng các chất hấp thụ hóa học và miễn dịch.
Các thủ tục điện di thường xuyên kết hợp với điều trị bằng thuốc cung cấp tác dụng hạ lipid máu ổn định và ức chế sự tiến triển của xơ vữa động mạch.
27

Machine Translated by Google
. Nhóm tác giả. “Nội bệnh. Tập 1 "
1.3. BỆNH HYPERTONIC
Sự định nghĩa. Thuật ngữ "tăng huyết áp động mạch" dùng để chỉ hội chứng tăng
ĐỊA NGỤC. Tiêu chuẩn chẩn đoán tăng huyết áp là huyết áp tâm thu tăng lên 140 hoặc hơn. mmHg Mỹ thuật. và / hoặc tăng huyết áp tâm trương lên 90 mm Hg trở lên. Mỹ thuật.
Tăng huyết áp (AH) là một bệnh mãn tính, biểu hiện chính
là hội chứng tăng huyết áp, không liên quan đến sự hiện diện của các quá trình bệnh lý, trong đó sự gia tăng huyết áp là do các nguyên nhân đã biết (triệu chứng hoặc thứ phát
AG). Thuật ngữ "tăng huyết áp" do G. F. Lang đề xuất và đồng nghĩa với
được sử dụng ở các quốc gia khác, thuật ngữ "tăng huyết áp động mạch thiết yếu". Mức độ phổ biến. Huyết áp tăng cao được ghi nhận trung bình ở 25% người lớn.
Tần suất THA tăng dần theo tuổi: tỷ lệ THA ở nhóm dân số dưới 39 tuổi là 10-15%, nhóm trên 60 tuổi là hơn 50%. Ở người già và
Tuổi già ít phổ biến hơn ở những người trẻ tuổi và trung niên, nó được ghi nhận
Tăng huyết áp tâm trương cô lập, nhưng tăng huyết áp tâm thu cô lập phổ biến hơn nhiều.
Ở Liên bang Nga, tỷ lệ tăng huyết áp là 39,2% ở nam giới và
41,1% ở phụ nữ. Biết về sự hiện diện của tăng huyết áp 37,1% nam giới và 58,9% nữ giới. 21,6% nam và 45,7% nữ dùng thuốc hạ huyết áp, nhưng chỉ 5,7% nam và 17,5% nữ được điều trị hiệu quả (tức là đạt được mức huyết áp bình thường).
Tăng huyết áp là yếu tố nguy cơ quan trọng nhất của bệnh tim mạch. Các nghiên cứu dân số đã chỉ ra rằng những bệnh nhân cao huyết áp, so với những người có huyết áp bình thường, có nguy cơ bị đột quỵ, bệnh mạch vành và suy tim sung huyết cao hơn đáng kể.
sự thiếu hụt. Kết quả là, việc giảm tỷ lệ tử vong do các bệnh tim mạch ở phần lớn được xác định bởi hiệu quả của việc điều trị GB.
Căn nguyên. Theo quan niệm hiện đại, yếu tố nguy cơ chính cho sự phát triển của HD là gánh nặng di truyền đối với bệnh này. Bây giờ
Nhiều gen đã được xác định có các khuyết tật dẫn đến tăng huyết áp. Chúng bao gồm các gen cho enzym chuyển đổi angiotensin (ACE), angiotensinogen, renin, gen,
xác định thể tích dịch ngoại bào, phản ứng với tải trọng muối và tái hấp thu natri, độ nhạy của các mô với insulin, tính thấm của màng tế bào, chức năng
các kênh ion, v.v. Các yếu tố khác cũng góp phần vào sự phát triển của HD: tuổi tác, thừa cân cơ thể, tiêu thụ muối ăn với số lượng vượt quá mức sinh lý,
không đủ hàm lượng kali, canxi và magiê trong thức ăn, suy nhược cơ thể, hút thuốc, lạm dụng rượu. Căng thẳng tâm lý là yếu tố nguy cơ ngoại sinh mạnh nhất đối với HD. Tầm quan trọng của quá trình căng thẳng thần kinh xảy ra
sau khi quá tải cấp tính và kéo dài cảm xúc, trong việc ổn định tăng huyết áp được nhấn mạnh trong tác phẩm cổ điển của G. F. Lang và A. L. Myasnikov. Sau đó, một hiệp hội đã được tìm thấy
phát triển của bệnh này với các đặc điểm nhân cách. Bệnh nhân có nguy cơ ổn định AH cao được đặc trưng bởi tính hiếu chiến tiềm ẩn, tham vọng, phấn đấu để lãnh đạo,
cảm xúc hoang mang, hấp tấp và bốc đồng. Những phẩm chất này thường được kết hợp với cảm giác lo lắng liên tục và giai đoạn trầm cảm.
Sự phát triển của HD phụ thuộc vào sự tương tác của các yếu tố di truyền và môi trường. Cơ chế sự tương tác này vẫn hoàn toàn không giải thích được. Tuy nhiên, có lý do để tin rằng mối quan hệ nhân quả giữa hai nhóm yếu tố được chỉ ra là
tính chất hai chiều: một mặt, đặc điểm di truyền xác định phản ứng
sinh vật đối với các yếu tố môi trường, và mặt khác, các ảnh hưởng ngoại sinh góp phần làm biểu hiện các khuyết tật di truyền.
28

Machine Translated by Google
. Nhóm tác giả. “Nội bệnh. Tập 1 "
Cơ chế bệnh sinh. Các thông số sinh lý chính xác định mức huyết áp,
là khối lượng đột quỵ, khối lượng máu lưu thông, độ đàn hồi của thành động mạch chủ và
các nhánh lớn của nó, khả năng chống lưu lượng máu ở cấp độ động mạch nhỏ và tiểu động mạch, độ nhớt máu. Vai trò hàng đầu trong việc hình thành huyết áp được đóng bởi hai chỉ số huyết động học: thể tích tuần hoàn máu theo phút, là sản phẩm của thể tích đột quỵ.
về nhịp tim, và tổng sức cản mạch ngoại vi. Trong điều kiện điều hòa thần kinh bình thường của tuần hoàn máu, thể tích máu được tim bơm vào các mạch, và
trương lực mạch phụ thuộc lẫn nhau - sự thay đổi một trong những thông số này dẫn đến những thay đổi ngược lại trong những thông số kia. Do sự cân bằng giữa thể tích tuần hoàn máu và tổng sức cản mạch ngoại vi, mức huyết áp tối ưu cho cơ thể được duy trì và ngăn chặn sự dao động mạnh của nó. Sự vi phạm
điều hòa hoạt động của tim và trương lực mạch máu, cũng như ảnh hưởng lẫn nhau của chúng dẫn đến huyết áp không thay đổi được.
Các tùy chọn sau đây đối với những thay đổi trong huyết động trung tâm được phân biệt, gây ra tăng huyết áp liên tục:
1) tăng thể tích tuần hoàn máu trong trường hợp không giảm đủ kháng lực mạch máu;
2)sự gia tăng sức đề kháng của mạch máu trong trường hợp không giảm đủ khối lượng tuần hoàn máu phút;
3)kết hợp tăng thể tích tuần hoàn máu và sức cản mạch máu
leniya.
Tỷ lệ mắc các biến thể huyết động khác nhau của AH không giống nhau. Hơn hơn 80% trường hợp ở bệnh nhân GB có sự gia tăng tổng số mạch ngoại vi
Sức cản.
Theo khái niệm thần kinh về cơ chế bệnh sinh của HD, được phát triển bởi G.F. Lang và A. L. Myasnikov, cơ sở của căn bệnh này là sự vi phạm các quy định của tuần hoàn máu, xảy ra do làm việc quá sức và chấn thương về lĩnh vực tinh thần của con người. Một vai trò quan trọng trong sự
phát triển của tăng huyết áp được thực hiện bởi sự hoạt hóa của hệ thống giao cảm-thượng thận. Trên Ở giai đoạn đầu của bệnh, nhiều bệnh nhân bị tăng calci huyết, được biểu hiện bằng sự gia tăng
nhịp tim và sức co bóp cơ tim với sự hình thành một kiểu huyết động tăng và tăng trương lực mạch. Ngoài ra,
suy giao cảm đi kèm với sự gia tăng tổng hợp các tế bào thần kinh khác góp phần vào
tăng huyết áp do ảnh hưởng đến trương lực động mạch, tái hấp thu natri và nước (renin, angiotensin II, aldosterone, vasopressin). Kích hoạt hệ thống giao cảm-thượng thận là một cơ chế mà thông qua đó các tác động huyết động của căng thẳng tâm lý-cảm xúc được thực hiện, kết hợp khái niệm này với khái niệm thần kinh.
cơ chế bệnh sinh của GB. Tuy nhiên, có những nguyên nhân khác gây ra chứng giảm trương lực cơ: một sự thay đổi nhạy cảm của các thụ thể baroreceptor và adrenoreceptor, suy giảm tái hấp thu noradrenaline ở khe tiếp hợp, giảm trương lực của hệ thần kinh phó giao cảm.
Sự phát triển của tăng huyết áp có thể liên quan đến sự rối loạn trong cơ chế điều hòa muối nước trao đổi, do đó xảy ra giữ natri và tăng thể tích máu. Xơ vữa thận (bao gồm cả phát triển ở giai đoạn cuối của HD) không phải là nguyên nhân duy nhất gây suy giảm chức năng bài tiết của thận. Giữ lại natri và nước trong cơ thể có thể
là do sự hoạt hóa của giao cảm-thượng thận và renin-angiotensin-aldosterone
hệ thống, cũng như giảm hoạt động của hệ thống peptit lợi tiểu natri. Theo quan niệm của A. Guyton, sự giảm khả năng bài tiết natri của thận, được ghi nhận là
ở một số bệnh nhân ở giai đoạn đầu của bệnh, không phải là hậu quả, mà là nguyên nhân của tăng huyết áp. Sự gia tăng huyết áp trong những trường hợp như vậy là một phản ứng bù trừ cung cấp
29

Machine Translated by Google
. Nhóm tác giả. “Nội bệnh. Tập 1 "
tăng bài niệu và do đó nhằm duy trì sự cân bằng nước-điện giải bình thường.
Lý thuyết "màng" về cơ chế bệnh sinh của tăng huyết áp, do Yu V. Postnov và S. N. Orlov đề xuất, giải thích sự gia tăng huyết áp do một khiếm khuyết được xác định về mặt di truyền trong màng sinh chất, do đó sự vận chuyển qua màng của các ion canxi bị rối loạn. .
Sự tích tụ canxi trong dịch bào gây ra sự tăng trương lực của các tế bào cơ trơn của mạch máu. thành và tăng sức co bóp của các tế bào cơ tim, đồng thời cũng góp phần vào việc kích hoạt
hệ giao cảm-thượng thận và đi kèm với sự gia tăng tính nhạy cảm của tế bào đối với tác động của norepinephrine.
Theo quan niệm hiện đại, mất cân bằng thần kinh đóng vai trò hàng đầu trong việc tăng huyết áp trong giai đoạn đầu của quá trình phát triển AH, biểu hiện quan trọng nhất là suy giảm chức năng của hệ thống renin-angiotensin-aldosterone.
các hệ thống. Peptide tác động chính của hệ thống thần kinh này, angiotensin II, không chỉ lưu thông trong máu mà còn được hình thành trong các mô. Angiotensin II lưu hành gây ra các tác dụng ngắn hạn: tăng nhịp tim, co mạch, giữ natri và nước. Angiotensin II ở mô gây ra các tác động lâu dài của việc kích hoạt hệ thống renin-angiotensin-aldosterone, bao gồm
phì đại cơ tim, sự hình thành và tiến triển của xơ vữa tim, phì đại cơ tim
các tế bào cơ trơn của thành mạch, giảm tính đàn hồi và sự thu hẹp dai dẳng của lòng các động mạch nhỏ, tăng áp lực trong các cầu thận dẫn đến cái chết sau đó của chúng
và sự phát triển của chứng xơ cứng thận. Sự hoạt hóa của hệ thống renin-angiotensin- aldosterone góp phần vào sự phát triển của rối loạn chức năng nội mô, được biểu hiện bằng sự mất cân bằng của các hoạt chất sinh học do tế bào nội mô tiết ra: sản xuất oxit nitric, Yếu tố tăng phân cực nội mô và prostacyclin, có đặc tính giãn mạch, chống tăng sinh và chống đông máu, làm giảm và sản xuất nội mô,
thromboxan A2 và các hợp chất khác gây co mạch, tăng sinh tế bào cơ trơn và tăng kết tập tiểu cầu.
Trong lý thuyết "chuyển hóa" về sự hình thành của tăng huyết áp, vai trò trung tâm
được trao cho sự đề kháng insulin của các mô. Giảm độ nhạy của mô đối với insulin do đột biến gen và ảnh hưởng của các yếu tố môi trường. Trong hầu hết các trường hợp, kháng insulin
kết hợp với béo phì và kèm theo rối loạn chức năng nội mô, tăng hàm lượng
natri và canxi trong các tế bào cơ trơn của thành mạch, góp phần vào sự tăng sinh của chúng và làm tăng tính nhạy cảm của các động mạch nhỏ với tác dụng co mạch.
Kháng insulin dẫn đến tăng insulin máu, do đó
dẫn đến tăng hoạt động của hệ giao cảm-thượng thận, phì đại cơ trơn cơ thành mạch, tăng tái hấp thu natri. Ngoài những thay đổi đó
sự gia tăng huyết áp, insulin kích thích sự tổng hợp cholesterol và quá trình oxy hóa lipid trong thành mạch, do đó góp phần vào sự tiến triển của xơ vữa động mạch.
Do đó, các cơ chế hình thành AH rất đa dạng. Sự kết hợp của các cơ chế di truyền bệnh và vai trò của chúng trong sự hình thành và tiến triển của HA được xác định bởi tập hợp các yếu tố môi trường và di truyền của từng bệnh nhân.
Hình thái học. AH đi kèm với sự phát triển của những thay đổi hình thái trong các cơ quan đích, trong đó chính là tim, mạch động mạch, thận và não.
Một dấu hiệu đặc trưng của "tim ưu trương" là sự gia tăng khối lượng cơ tim của tâm thất trái. Trong cơ tim của bệnh nhân cao huyết áp, không chỉ khối lượng tế bào tăng lên mà còn và nội dung của chất nền ngoại bào, tăng sản nguyên bào sợi phát triển và sản xuất collagen tăng lên, tức là tiến triển xơ vữa tim. Những thay đổi tương tự xảy ra ở thành của các
động mạch chính, dày lên và xơ hóa đi kèm với
ba mươi
