
- •3.10.3.7. Неврологические осложнения
- •3.10.3.8. Острая почечная недостаточность
- •3.10.4. Особенности ведения больных при различных оперативных вмешательствах
- •3.10.4.1. Операции по поводу аневризм восходящего, грудного и торакоабдоминалъного отделов аорты
- •3.10.4.2. Операции при коарктации аорты
- •3.10.4.3. Каротидная эндартерэктомия
- •3.10.4.4. Операции по поводу ишемической болезни сердца
- •3.10.4.5. Реконструктивные операции на почечных артериях
- •3.10.4.6. Операции на брюшном отделе аорты и аортобедренное шунтирование
- •3.10.4.7. Операции реваскуляризации артерий нижних конечностей
- •3.11. Диспансеризация больных с сосудистыми заболеваниями в условиях поликлиники
- •3.11.1. Физиотерапевтическое лечение
- •3.11.2. Хроническая венозная недостаточность нижних конечностей
- •3.11.3. Лимфедема
- •Глава 4
- •4.1. Транслюминальная баллонная ангиопластика
- •4.2.1. Имплантация кава-фильтров
- •4.2.2. Транскатетерная тромбоэмболэктомия
- •4.2.3. Лечение обструкций полых и других крупных вен
- •4.2.4. Баллонная ангиопластика и стентирование обструкций при артериовенозных фистулах у пациентов, находящихся на гемодиализе
- •Глава 5
- •5.1.1. Стабильная стенокардия напряжения
- •5.1.2. Нестабильная стенокардия
- •5.2. Аортокоронарное шунтирование
- •5.2.1. Техника аортокоронарного шунтирования с искусственным кровообращением
- •5.2.2. Техника маммарокоронарного шунтирования в условиях искусственного кровообращения
- •5.2.3. Операции прямой реваскуляризации миокарда на работающем сердце без искусственного кровообращения — малоинвазивная коронарная хирургия
- •5.2.4. Трансмиокардиалышя реваскуляризация миокарда
- •5.3. Синдром Марфана
- •5.3.1. Этиология (генетические предпосылки развития синдрома Марфана)
- •5.3.2. Патогенез и патоморфология
- •5.3.3. Диагностические критерии
- •Диагностические критерии синдрома Марфана
- •Диагностические критерии синдрома Марфана
- •Диагностический указатель
- •Костно-суставная система
- •Орган зрения
- •Сердечно-сосудистая система
- •Респираторная система
- •Кожа и наружные покровы
- •Твердая мозговая оболочка (dura mater)
- •Семейный/Генетический анамнез
5.2.2. Техника маммарокоронарного шунтирования в условиях искусственного кровообращения
Наряду с использованием аутове-нозных трансплантатов при операциях АКШ широкое признание получил метод маммарокоронарного шунтирования (МКШ), имеющий как преимущества, так и недостатки. К преимуществам метода МКШ можно отнести использование артериального кондуита, однородного с КА, оптимальное соотношение диаметров ВГА и КА и высокую линейную скорость кровотока. Недостатками использования ВГА следует считать ее высокую склонность к спазмированию и тот факт, что в 25 % случаев отмечается ее малый диаметр и низкий объемный кровоток. В связи с этим перед тем как создать анастомоз между внутренней грудной и коронарной артериями, необходимо выполнить контрольное измерение объемной скорости кровотока по ВГА путем кровопускания в мерную емкость. Обыч-
534
но объемная скорость кровотока по ВГА варьирует от 40 до 180 мл/мин при средних значениях артериального давления в ней 50—60 мм рт.ст. [Rankir J.S. et al., 1986]. Кровоток, превышающий 40 мл/мин, считается вполне приемлемым для использования ее при шунтировании коронарных артерий малых размеров. Однако для шунтирования коронарных артерий больших размеров и при выполнении последовательных маммарокоронарных анастомозов для достижения хороших результатов необходим кровоток, приближающийся к 100 мл/мин и более. При введении папаверина в просвет артерии диаметр ВГА колеблется от 1,5 до 3,5 мм, составляя в среднем 2 мм.
Техника маммарокоронарного шунтирования (МКШ) состоит в следующем: после выполнения срединной стернотомии выделяют левую и правую ВГА на всем протяжении. Боковые ветви клипируют, лигируют или коагулируют. Предпочтительно анастомоз между ВГА и КА выполнять нитью 7/0 (рис. 5.3). Анализируя собственный опыт наложения дистальных анастомозов как с аутовеной, так и с внутренней грудной артерией, мы пришли к заключению, что предпочтительно накладывать первые швы не к «пятке» с последующим непрерывным швом с обеих сторон двумя иглами навстречу друг другу, а накладывать первый П-образный шов на боковую стенку ВГА или аутовены. Это позволяет раскрыть просвет шунтируемой коронарной артерии и под контролем зрения, с хорошей ее экспозицией выполнить непрерывный сосудистый шов. Такая техника почти в 100 % случаев гарантирует проходимость анастомоза (рис. 5.4).
При множественной реваскуля-ризации миокарда анастомоз между ВГА и КА выполняют в последнюю очередь, после наложения аутове-нозных аортокоронарных шунтов.
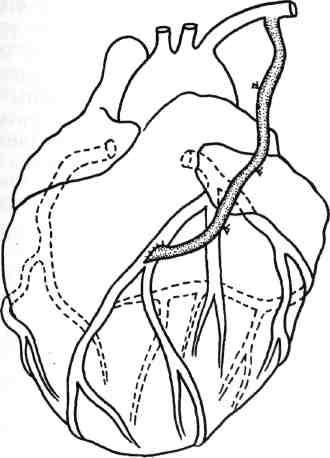
Рис. 5.3. Маммарокоронарное шунтирование.
Это позволяет избежать дополнительной травмы ВГА. Для увеличения объема прямой реваскуляризации миокарда (т.е. числа шунтированных сосудов) с использованием ВГА применяют последовательное, или секвенциальное, МКШ (рис. 5.5). МКШ чаще всего производят для шунтирования ПМЖВ и ДВ. При использовании ВГА для последовательного шунтирования коронарных артерий in situ ее диаметр должен быть не менее 2—2,5 мм, кровоток — 100 мл/мин и более, она должна быть достаточной по длине, чтобы без натяжения достигнуть места дистальных анастомозов.
При последовательном шунтировании ПМЖВ и ДВ используют параллельную технику, однако при шунтировании комбинации ОВ и краевых ветвей, когда угол между проксимальным (первым) и диста-льным (вторым) анастомозами составляет 90°, используют так называемый анастомоз диамонд. При
этом следует учитывать, что слишком большая артериотомия приводит к характерному стенозу в виде крыльев чайки, описанному C.M.Grondin и др. Во избежание этого зоны коронарных артерий с выраженным кальцинозом нельзя шунтировать при помощи анастомоза бок в бок; нельзя также выполнять их при интрамиокардиаль-ном расположении коронарных артерий, так как ВГА может перегибаться при выходе из глубокой миокардиальной борозды.
При ВГА для двух или трех анастомозов необходимо избегать ее
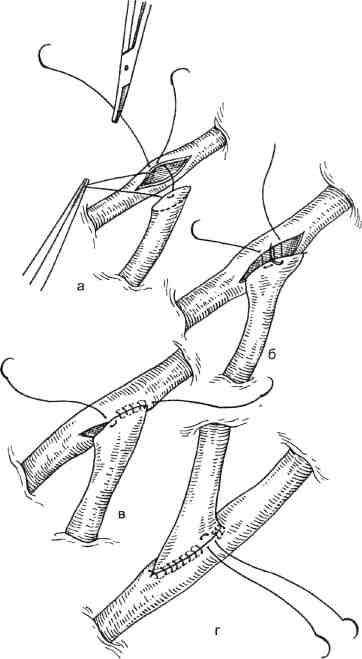
Рис. 5.4. Наложение анастомоза с коронарной артерией (методика автора).
а — начало наложения анастомоза; б, в — последующие этапы; г — окончательный вид анастомоза.
535
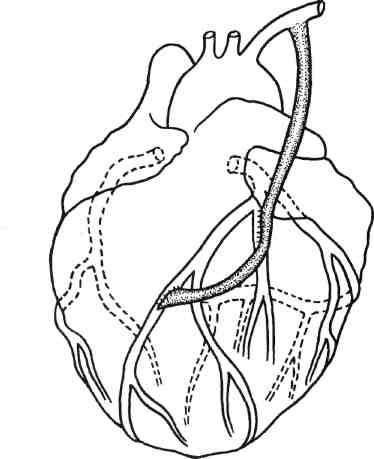
сильных изгибов, которые значительно снижают кровоток в дис-тальные артериальные сегменты. Следует отметить, что увеличенные в объеме легкие во время операции могут сместить ВГА медиально и привести к ошибке при ориентировке ВГА.
Непосредственные результаты аортокоронарного шунтирования. Большой опыт, накопленный более чем за 30-летний период использования КШ в лечении ИБС, постоянное совершенствование хирургической техники, методик анестезиологического и реаниматологического пособия, а также перфузио-логии позволили существенно снизить риск операции и добиться положительных результатов хирургического лечения.
По данным разных авторов, в группе пациентов старше 65 лет без выраженных нарушений сократительной способности ЛЖ риск операции составляет не более 1 %, а для пациентов моложе 65 лет с ФВ
536
менее 35 % — не превышает 5 %. Частота периоперационного инфаркта миокарда колеблется от 2,2 до 5,0 %, кровотечения в послеоперационном периоде возможны у 2,2 % больных, нарушения ритма сердца, в том числе фибрилляция желудочков (ФЖ), встречаются с различной частотой — от 3 до 31 % случаев, а необходимость в ино-тропной поддержке в послеоперационном периоде возникла у 34 % больных [CartierR., 1966, 1998].
Неврологические расстройства — наиболее часто встречающееся осложнение после операций с ИК: их частота составляет от 0,4 до 80 % [Mora C.T., 1995]. Тяжесть неврологических осложнений варьирует от легкого нарушения тонких психических функций до очаговых неврологических расстройств, ступора и комы. При этом летальность при первом виде мозговых осложнений достигает 10 %, а во втором — 21 %. Наиболее вероятной причиной развития неврологической симптоматики после операций, выполненных в условиях ИК, является микроэм-болизация. Частота развития послеоперационных осложнений напрямую зависит от длительности проведения ИК. Так, при продолжительности ИК более 180 мин, отек мозга возникает у 14,3 % больных, при ИК в пределах 150—180 мин — у 4 %, а при ИК менее 150 мин мозговых осложнений не наблюдалось. Согласно последним данным Дьюкского университета, около 50 % пациентов, перенесших операцию КШ в условиях ИК, впоследствии страдают слабоумием.
Частым осложнением (1—4 %) после операций КШ является меди-астинит. В исследованиях, проведенных J.Braxton и соавт. (2000), были детально изучены причины и факторы риска медиастинита. По утверждению авторов, наибольшему риску развития этого осложнения подвержены пациенты, которым операция выполнялась в экст-
ренном порядке, а также пациенты с различными сопутствующими заболеваниями, с выраженной сердечной недостаточностью и ФВ менее 40 %. Особое значение в развитии этого осложнения отводится ожирению, в зависимости от степени выраженности которого вдвое повышается риск медиастинита. Риск раннего закрытия шунтов при медиастините значительно выше: через 12 мес после перенесенного медиастинита закрытыми оказались 38 % шунтов по сравнению с 9 % у пациентов с неосложненным послеоперационным течением.
Пережатие аорты, необходимое при выполнении операций в условиях ИК, приводит к ишемии миокарда во время наложения дисталь-ных анастомозов. Напряженный поиск методов защиты миокарда, проводимый на протяжении почти 30 лет, способствовал созданию достаточно эффективных кардиопле-гических растворов, однако ни один из них не является идеальным [Lichtenstein S. et al., 1991]. Исследования, начатые в этом направлении W.Bigelow и соавт. (1950) и N.Shumway и соавт. (1959), продолженные D.Cooley и соавт. (1972), S.Lichtenstein и соавт. (1991), позволили создать теорию реперфузи-онного повреждения и возникновения феномена «оглушенного миокарда». Он заключается в резком уменьшении уровня энергетических фосфатов, внутриклеточной перегрузке кальцием, образовании супероксидных радикалов и нарушении микроциркуляторного русла. Вследствие этого возникают обратимые и необратимые повреждения митохондрий, актинмиозиновых связей, собственно миофибрилл [Benetti F. et al., 1986], что вызывает нарушение сократительной способности миокарда. Тяжесть «оглушения» зависит от длительности пережатия аорты и исходного состояния миокарда [Akins C.W. et al., 1984]. Таким образом, пациенты с
исходно низкой фракцией выброса, с нестабильной стенокардией и острым ИМ, а также повторно оперируемые больные образуют группу повышенного риска при операциях с ИК и пережатием аорты.
