
- •5.7.3. Расслоение аорты
- •5.7.4. Хирургическое лечение аневризм и расслоений аорты
- •5.8. Неспецифический аортоартериит
- •5.8.1. Связь неспецифического аортоартериита с другими заболеваниями и наследственные факторы
- •5.8.2. Аутоиммунные механизмы
- •5.8.3. Классификация и клиническая картина
- •5.8.4. Медикаментозное лечение
- •5.8.5. Хирургическое лечение
- •5.9. Хроническая сосудисто-мозговая недостаточность (окклюзионное поражение ветвей дуги аорты)
- •5.9.1. Атеросклероз
- •5.9.2. Классификация сосудисто-мозговой недостаточности
ственно. В поздние сроки из 15 смертей 7 были связаны с осложнениями со стороны аорты.
В целом сердечно-сосудистые нарушения являются основной (66— 75 %) причиной смерти в поздние сроки после операций у больных с синдромом Марфана, среди которых первое место занимают новые поражения аорты и сердечная недостаточность, связанная с длительно существовавшей аортальной и/или митральной недостаточностью. Так, причинами летального исхода служат дальнейшее расслоение аорты у 23 % пациентов, периоперационная смерть при новом расслоении/аневризме — также у 23 %, застойная сердечная недостаточность — у 13 %, разрыв аневризмы аорты — у 10 %, внезапная смерть — у 10 %, инсульт — у 7 %, другие сердечно-сосудистые причины (аритмии, протезный эндокардит, недостаточность клапанов) — у 20 %, причины некардиоваскуляр-ного генеза — у 20—37 % больных. Совершенствование принципов хирургического лечения и повышение качества медикаментозной терапии позволили увеличить среднюю продолжительность жизни у больных с синдромом Марфана с 48 лет в 1972 г. до 61—72 лет ко второй половине 90-х годов. Среди оперированных пациентов до 30 лет сегодня доживают 90 %, до 40 — 75 %, до 50—60 %, а до 60 лет — 55 %, что на 10, 15, 20 и 35 % соответственно для каждого возраста превышает продолжительность жизни при естественном течении (без какого-либо лечения) заболевания. Кумулятивная ожидаемая 10-летняя выживаемость оперированных больных при синдроме Марфана к середине 90-х годов достигла более 70 %.
Синдром Элерса—Данло, известный также как болезнь «индийского резинового человека», относится к наследуемым дефектам развития мезенхимы (коллагеновых структур) и проявляется гиперэластично-
стью и повышенной ранимостью кожи, ее гиперпигментацией, разболтанностью суставов и их склонностью к вывиху; нередко выявляют сколиоз, синдактилию, бронхо-эктазы, дивертикул езы толстой кишки, хрупкость глазного яблока, возможны нарушения интеллекта. Для синдрома характерны 10 четких фенотипов, два из которых представляют интерес для хирургов:
тип I (форма Gravis, или классическая) наследуется по аутосом-но-доминантному типу и клинически проявляется повышенной растяжимостью кожи, склонностью к образованию кожных рубцов, разболтанностью суставов, скелетными деформациями, пролапсом митрального клапана, различными вариантами вовлечения артерий. При поражении аорты обычно вовлекаются синусы Вальсальвы;
тип IV (синдром Sack-Barabas, или артериально-экхимозная форма) наследуется по аутосомно-до-минантному типу (в 4 % случаев по рецессивному), характеризуется выраженной склонностью к образованию кровоподтеков при малейшей травматизации, истончением кожи с выступающими венозными сплетениями без повышения ее растяжимости, ранним старением кожи кистей и лица, гиперпигментацией, склонностью к образованию выраженных кожных рубцов, умеренной разболтанностью суставов, за исключением суставов пальцев рук, разрывами кишечника, характерными чертами лица и частым вовлечением в патологический процесс артерий. У этих пациентов выявляется дефицит коллагена III типа.
Редко разрыв аорты наблюдается при VI фенотипе (окулярно-сколи-отическая форма), возникающем вследствие наследования мутантно-го аллеля от каждого из родителей, что приводит к наложению и усилению эффекта действия мутантных аллелей по варианту составной ге-
653
терозиготности. Генные и биохимические проблемы при синдроме Элерса—Данло связаны с нарушением преобразования проколлагена в коллаген за счет наследуемой по аутосомно-рецессивному типу недостаточности лизилгидроксилазы и наследуемой сцепленно с Х-хро-мосомой недостаточности лизилок-сидазы. За счет потери коллагена и эластина, фрагментации и разрывов внутренней эластической мембраны происходит диффузное истончение медии, что приводит к расслоению, спонтанному разрыву аорты или периферических артерий, образованию артериовенозных фистул и множественных аневризм.
Как и при синдроме Марфана, женщины с синдромом Элерса— Данло особенно склонны к расслоению или разрыву аорты во время III триместра беременности, при физической нагрузке или во время родов. При наличии поражения клапанов сердца и/или аорты им следует выполнять реконструктивную операцию до наступления последнего триместра беременности или выполнять кесарево сечение.
Наиболее детальное исследование сердечно-сосудистых проявлений синдрома Элерса—Данло провели Cikrit и соавт., которые включили в анализ результаты наблюдения за 5 семьями и данные литературы. Авторами отмечено 38 случаев спонтанного кровотечения у 36 больных главным образом из аорты, висцеральных, сонных и тибиальных артерий, реже из подвздошных, бедренной, подключичной и подмышечной артерий, в одном наблюдении — из коронарных сосудов. Среди 15 из указанных пациентов выявлено 29 случаев возникновения аневризм в вышеописанных позициях, кроме бедренно-подколенно-го сегмента, чаще всего в висцеральных и сонных артериях и аорте. В 8 случаях описаны артериовеноз-ные фистулы, из них 5 каротидно-кавернозных. У 36 больных выпол-
нено 29 сосудистых операций: ли-гирование 15 кровоточащих сосудов, 5 аневризм, 4 каротидно-ка-вернозных фистул, 1 тромбэктомия и 4 шунтирующих вмешательства, из которых только одно оказалось успешным. Хирургическая летальность составила 24 % (7 пациентов), а всего из 36 больных 21 погиб вследствие кровотечения (58 %).
Хирургическое лечение аневризм аорты при синдроме Элерса—Данло принципиально идентично таковому при синдроме Марфана, но гораздо более опасно из-за проблем с гемостазом. Cikrit и соавт. из 12 ар-териографий отметили образование обширных гематом в 5 наблюдениях, тромбоз бедренной артерии — у 1 больного и 2 случая смерти от кровотечения. Тем не менее опыт Methodist Hospital при данном заболевании включает несколько случаев успешных реконструкций тора-коабдоминальной аорты при аневризмах [Svensson L.G., Crawford E.S., 1997].
Среди других врожденных заболеваний соединительной ткани к поражениям аорты очень редко могут приводить такие болезни, как pseu-doxantoma elasticum, osteogenesis imperfecta (несовершенный остеогенез или «внутриутробная ломкость костей»), поликистоз почек, алкаптону-рия, гомоцистинурия, мукополиса-харидозы, синдромы Менкеса, Ну-нан, Клиппеля—Фейля, Турнера, семейный пролапс митрального клапана, дварфизм (патологическое недоразвитие тела).
Аортиты делят на две основные категории: инфекционные и те, при которых инфекционный агент неизвестен.
Неинфекционные аортиты возможно разделить на две большие подгруппы: аортиты, поражающие преимущественно аорту, и аортиты, вовлекающие в процесс в первую очередь другие органы и системы, но способные привести к пораже-
654
нию аорты и других сегментов артериального русла.
К первой подгруппе прежде всего относится неспецифический аото-артериит, или болезнь Такаясу. К другим типам неинфекционных аортитов, первично поражающих аорту, относят очень редко встречающиеся хронические воспалительные аневризмы неизвестного гене-за, в основном инфраренального отдела брюшной аорты, казуистически редко возникающие в грудной аорте (преимущественно восходящий отдел). Такие аневризмы не удается связать с болезнью Такаясу или другими системными заболеваниями соединительной ткани сосудистой стенки.
При неспецифическом аортоарте-риите (болезни Такаясу) L.G.Svens-son и E.S.Crawford выделяют несколько анатомических типов поражения, в том числе тип V, или анев-ризматический. Последний был описан Ueno в 1967 г. в виде диффузного аневризматического поражения аорты и ее ветвей. При изучении японцев с болезнью Такаясу было выявлено, что в 32 % наблюдений встречались аневризмы аорты, чаще поражающие восходящий отдел, а аортальная регургитация отмечена у половины таких пациентов. При гистологических исследованиях данного заболевания было установлено, что при преимущественном развитии медионекро-за имеется тенденция к возникновению аневризм, тогда как при преобладании интимальной пролиферации чаще возникают окклюзиру-ющие изменения ветвей аорты. Соотношение заболевших женщин и мужчин при неспецифическом аор-тоартериите составляет от 4:1 до 7:1 [Lupi-Herrera E. et al., 1977]. Наиболее подробно клиническая картина при неспецифическом аортоартери-ите была описана А.В.Покровским (1979), выделившим 10 вариантов клинических проявлений заболевания в зависимости от наличия вос-
паления и локализации поражения; он же сообщает о частоте развития аневризм аорты при этом заболевании, составившей 10 %. Симптоматика при аневризмах грудной аорты при болезни Такаясу связана с локализацией поражения и симптомами сдавления окружающих тканей. Прогрессирующий рост таких аневризм может приводить к разрыву или расслоению аорты. Принципы хирургического лечения аневризм грудной аорты при неспецифическом аортоартериите аналогичны таковым при других аневризмах, за исключением необходимости более частого восстановления проходимости ветвей дуги аорты с помощью шунтирующих процедур или эндар-терэктомии либо с помощью обеих методик.
Более подробно морфологические изменения, клиническая картина, диагностика, принципы до- и послеоперационной противовоспалительной терапии, результаты лечения при неспецифическом аортоартериите изложены в соответствующем разделе.
Ко второй подгруппе неинфекционных аортитов аутоиммунного характера, прежде всего приводящих к стенотическому поражению артерий среднего калибра, но изредка вовлекающих в процесс аорту, относятся гигантоклеточный артериит (гранулематозный аортит, болезнь Хортона), ревматоидный артрит, рецидивирующий полихон-дрит, болезни Сьегрена и Рейтера, анкилозирующий спондилит, системная красная волчанка, синдром Когана (в сочетании со зрительными и слуховыми нарушениями), ревматическая полимиалгия, реже болезни Кавасаки, Крона, Bechet, язвенный колит и саркоид. Обычно не связываются с аутоиммунными поражениями эрготизм и радиационный фиброз.
Среди перечисленных аутоиммунных заболеваний наиболее часто поражает артерии среднего диа-
655
метра и иногда аорту гигантокле-точный артериит, наиболее известным проявлением которого служит височный артериит, приводящий к тяжелой головной боли и слепоте. У некоторых больных развитию ги-гантоклеточного артериита предшествует ревматическая полимиалгия. Гистологическая картина дает название указанному заболеванию, когда на фоне утолщения интимы за счет воспалительных клеток имеется инфильтрация медии аорты гранулемами, содержащими многоядерные гигантские клетки, эпителиальные клетки, Т-лимфоциты, мононуклеары и различные типы клеток белой крови. Включений гранулоцитов в отличие от других васкулитов не наблюдается. Часто происходят некроз и фрагментация внутренней эластической мембраны, могут встречаться локальные кровоизлияния в стенке аорты. Нередко поражение носит мозаичный характер, когда здоровые участки перемежаются поврежденными сегментами аорты. Возможно присутствие периваскулитов vasa vasorum. Частота возникновения гиганто-клеточного артериита в популяции составляет 17,4 случая на 100 000 населения в год [Hunder G.G. et al., 1975]. Соотношение женщин и мужчин — 2:1, с возрастом число заболевших увеличивается, и среди больных свыше 50 лет частота заболевания достигает 30 случаев на 100 000 населения [Weyand CM. et al., 1994]. Гигантоклеточный артериит сопровождается головной болью и расстройствами зрения на фоне лихорадки неясного генеза. Приблизительно у 60 % пациентов не определяется пульсация височной артерии, часто встречаются мышечная боль при движении челюстью (вариант перемежающейся хромоты при жевании), миалгия, артриты, частичная или полная потеря зрения на один или оба глаза вследствие ишемического повреждения зрительного нерва. Реже воз-
никают amaurosis fugax, ТИА, инсульты, острая спутанность сознания, ишемическая цервикальная миело-патия, нарушение функции глазодвигательных мышц, тошнота, общая слабость, потеря аппетита, исчезновение пульсации артерий, особенно сонных, височных, затылочных. Возраст больных, как правило, превышает 60 лет.
В лабораторных показателях отмечается повышение СОЭ, про-тромбинового времени, уровней а2-глобулина, трансаминаз, алка-линфосфатазы, антикардиолипино-вых антител. При поддержании активности заболевания сохраняется повышенным уровень 1-антихимо-трипсина, при снижении его менее 0,7 г/л можно говорить о стихании процесса. Подтверждением диагноза гигантоклеточного артериита служит темпоральная биопсия. В отличие от болезни Такаясу при обсуждаемом заболевании не происходит вовлечения в процесс аортального клапана и формирование аневризмы восходящей аорты протекает без уплотнения, воспаления и утолщения последней, а поражение ветвей аорты носит более дис-тальный характер, в том числе возможно вовлечение бедренных и ин-тракраниальных артерий. Своевременно начатая противовоспалительная терапия обычно приводит к купированию вышеописанных острых симптомов. При формировании поражений аорты выполнять операции в хронической стадии технически несложно из-за рубцо-вого утолщения аорты, облегчающего ее прошивание при наложении анастомозов с протезом. Как правило, если при гигантоклеточ-ном артериите аневризма возникает в восходящем отделе (реже в нисходящем), то аорта прогрессивно расширяется на остающемся протяжении, что часто характеризуется как мега-аорта.
При редких случаях вовлечения аорты при ревматоидном артрите
656
поражаются восходящий отдел и аортальный клапан, казуистически редко дуга и нисходящая аорта. В поздних стадиях заболевания часто происходит обызвествление восходящей аорты. Гистологические изменения в данном случае типичны для аортитов. Возможны сопутствующие поражения в виде язв диста-льных фаланг пальцев рук, их гангрены, синдрома Рейно, гангрены кишечника.
Рецидивирующий полихондрит
проявляется полиартритом, воспалением носовых и ушных хрящей, вовлечением крупных дыхательных путей, общевоспалительными симптомами. На поздних стадиях заболевания возможно развитие аневризмы и нередки расслоения в любом отделе аорты, которые часто приводят к смерти больных.
При анкилозирующем спондилите в 5 % случаев возникает поражение аортального клапана. Риск указанного осложнения зависит от длительности заболевания, встречаясь в 12 % наблюдений при сроках болезни более 30 лет и в 2 % — до 10 лет. Вовлечению аортального клапана сопутствуют нарушения проводимости, кардиомегалия, перикардит, ангинозная боль неясного генеза. Реже возникают аннулоаортальная эктазия, расширение синусов Валь-сальвы. Гистологические изменения включают дегенерацию медии, мозаичные воспалительные изменения всех слоев аорты.
Болезнь Bechet проявляется аф-тозными язвами слизистых оболочек полости рта и половых органов, увеитом; наиболее часто поражает мужчин от 20 до 40 лет. Кроме того, отмечаются узелковая эритема, пустулы, изменения желудочно-кишечного тракта, как при болезни Крона, панкреатит, пневмонит, си-новиты суставов, артриты, гипопи-он, эпидидимоорхит, гломеруло-нефрит, полиневропатии и менин-гоэнцефалит. На поздних стадиях заболевания присоединяются сле-
пота и сердечно-сосудистые осложнения, к которым относятся эндо-, мио- и перикардит, нарушения проводимости, деструкция клапанов, аневризмы и стенозы коронарных артерий, грудные и брюшные аневризмы, тромбофлебиты, тромбозы магистральных вен, включая верхнюю и нижнюю полые, стенозы легочной артерии и окклюзиру-ющие поражения артерий среднего калибра. Изолированные аневризмы последних в бассейне легочной артерии сопровождаются кровохарканьем. Аневризмы грудной аорты являются типично воспалительными, но в послеоперационном периоде у этих больных отмечается высокая склонность к тромбозам, из-за чего требуется назначение антикоагулянтов.
Ревматическая полимиалгия проявляется болью в плечах, шее, мышцах бедра, утренней скованностью и соответствующими системными симптомами. У 10—15 % больных в процесс вовлекается аорта, что сопровождается расслоениями, образованием аневризм или окклю-зирующими поражениями ее ветвей.
Инфекционные аортиты возникают при сифилисе и туберкулезе. Общими для этих поражений аорты являются отсутствие возбудителя в стенке аорты и выраженное утолщение последней с ее уплотнением за счет склероза и рубцового процесса, что не приводит к расслоению аорты и облегчает наложение анастомозов.
Сифилитический аортит в третичном периоде заболевания являлся основной причиной образования аневризм грудной и брюшной аорты в период до внедрения в клиническую практику антибиотиков. При локальном вовлечении аорты аневризмы носят мешотчатую форму, при диффузном — веретенообразную. Чаще в процесс вовлекаются восходящий отдел и дуга аорты. Недостаточность аортального кла-
657
пана вторична и появляется при увеличении размеров аневризмы восходящей аорты. Для сифилитического аортита характерно стено-зирующее поражение устьев коронарных артерий за счет воспалительных изменений, приводящее к ишемии миокарда. Антисифилитическая терапия не вызывает регресс изменений в сосудистой стенке. Средний период от установления диагноза развернутого сифилиса до возникновения сосудистых осложнений составляет 10—20 лет, средняя продолжительность жизни после появления симптомов аневризмы не превышает 6—8 мес у неопе-рированных больных. Скорость увеличения и риск разрыва при сифилисе мешотчатых аневризм выше, чем при веретенообразных аневризмах.
Туберкулезный аортит характеризуется накоплением агрегатов лимфоцитов в адвентиции — наиболее утолщенном слое аорты с развитием в последнем богатой сети лимфатических сплетений. В остальном гистологические и клинические проявления заболевания типичны для аортитов.
Термин «микотические аневризмы» впервые употребил W. Osier (1885), описавший грибовидное выпячивание стенки аневризмы. В настоящее время такие аневризмы определяют как расширение сегмента аорты, вызванного микроорганизмом, попавшим из очага другой локализации. Несмотря на название, развитие микотических аневризм обусловливают, как правило, микроорганизмы и казуистически редко грибы. В подавляющем большинстве развитие микотических аневризм связывают с эпизодом бактериального клапанного эндокардита в анамнезе. Показано, что возникновению микотических аневризм могут способствовать ко-арктация или гипоплазия аорты, другие поражения аорты при возникновении бактериемии. Кроме
того, такие аневризмы возможны при инфицировании внутрипрос-ветного тромба в ранее возникших атеросклеротических или посттравматических аневризмах.
Типичными местами возникновения микотических мешотчатых аневризм являются дуга аорты и висцеральные ветви ее брюшного отдела, хотя локализация таких поражений может быть множественной. При инфицировании стенки аорты по всей толщине возможно образование ложных аневризм или разрывов.
Основными возбудителями, приводящими к развитию микотических аневризм, являются (в порядке убывания по частоте встречаемости) Staphylococcus aureus, Staphylococcus epidermalis, Salmonella и Streptococcus. Реже высевают Haemophilus influenzae, Pseudomonas, Enterobacter, Proteus, Yersinia, Campylobacter fetus, Bacteroides fragilis, Candida и Escherichia coli. Сальмо-неллезные микотические аневризмы вызываются Salmonellae Chole-raesuis et Typhimurium. Характерно, что спектр микроорганизмов, высеваемых при микотических аневризмах, значительно шире такового при клапанном эндокардите. По данным L.G.Svensson и E.S.Crawford, положительные посевы крови отмечались только у 27 % пациентов, тогда как при интраоперацион-ной биопсии бактерии определялись в 77 % наблюдений.
Факторами, предрасполагающими к образованию микотических аневризм на фоне угнетения иммунитета, являются стероидная и химиотерапия, алкоголизм, хроническая почечная недостаточность, диабет, новообразования, туберкулез, хронический панкреатит, кол-лагенозы и облучение. Частота депрессии иммунитета среди больных с микотическими аневризмами может достигать 87 %. Новой группой риска для таких поражений являются больные СПИДом. Инфициро-
658
вание аорты может носить также ятрогенный характер.
Клиническими признаками, заставляющими предположить мико-тический генез аневризмы аорты, являются лихорадка и связанные с ней симптомы, наличие воспалительных изменений в анализах крови, присутствие в анамнезе инфекционного заболевания, чаще клапанного эндокардита. Лечение больных с подозрением на микотическую аневризму должно начинаться с назначения антибиотиков непосредственно сразу после взятия крови на посев, так как культура не всегда высевается, а ожидание результатов анализа может привести к неоправданной задержке операции у зачастую находящихся в тяжелом состоянии больных.
До сих пор среди хирургов нет единого мнения о предпочтительности реконструкций in situ или экстраанатомического шунтирования при микотических аневризмах. Наиболее агрессивным считается подход, когда операцию in situ выполняют в срочном порядке из-за высокой летальности при изолированной медикаментозной терапии, значительного риска разрыва, дис-семинации инфекционного процесса и развития полиорганной недостаточности. Принципиальными моментами таких вмешательств являются удаление всех потенциально инфицированных тканей с особым вниманием к любым тромбам и сгусткам, окутывание протеза сальником или окружающими тканями с заполнением всего мертвого пространства и для изоляции окружающих органов и структур, установка в грудной клетке вдоль протеза нескольких промывных дренажей, в том числе для ирригации антибиотиками, обязательный посев из окружающих тканей для возможной модификации антибиотикотерапии. При указанной системе хирургических мероприятий удается добиться выживания до 90 % пациентов, ко-
торых в дальнейшем переводят на пожизненный прием антибиотиков для снижения риска инфицирования других отделов артериального русла и протеза аорты.
К случаям инфицирования протезов, в том числе и аорты, относят бактериальное обсеменение протеза, присутствие гноя вокруг протеза или оба этих признака. Такой диагноз подтверждается положительным посевом крови и образованием ложных, как правило, аневризм. Частота таких осложнений в хирургии аорты составляет от 0,86 до 3 %, и они являются наиболее драматичными. Так, по данным L.G.Svensson и E.S.Crawford, на 1509 операций протезирования то-ракоабдоминального отдела аорты у 13 больных развилась поздняя инфекция протеза, из-за чего 12 из них погибли. При инфицировании протезов восходящей аорты этот показатель может достигать 75 %. Инфицирование протезов грудной аорты может возникать в любые сроки после первичной операции, но наибольшая частота отмечается в первый месяц [Hargrove W.C., Edmunds J.H., 1989]. Контаминация протезов может возникать вследствие миграции микроорганизмов из отнесенного места, непосредственного обсеменения во время первичной операции или перехода инфекции с окружающих протез контами-нированных тканей. Профилактикой такого осложнения являются бережная хирургическая техника, сокращение по возможности времени операции и искусственного кровообращения, объема инфузии кровезаменителей, тщательный гемостаз и адекватное дренирование ран, рациональная антибиотикоте-рапия в периоперационном периоде, санация до операции потенциальных источников инфицирования (инфекция дыхательных и мочевых путей, кариес, язвы мягких тканей конечностей). Инфицирование протезов восходящего отдела и дуги
659
аорты в присутствии воспаления послеоперационной раны облегчается отсутствием фасции и мышц между протезом и поверхностными слоями раны.
Ложные аневризмы анастомозов в поздние сроки при инфицировании протезов, кроме общевоспалительных симптомов, могут сопровождаться такими клиническими признаками, как лихорадка, воспалительные изменения в анализах крови, бактериемия, кровотечения из анастомозов, явные или скрытые кровотечения из желудочно-кишечного тракта, дренирование гноя из послеоперационных ран, разрыв анастомозов или ложных аневризм анастомозов, образование свищей (аортолегочный, аортопищевод-ный), аортовенозных фистул и сообщений с полостями сердца, дис-тальными эмболиями септическим материалом, тромбозом протеза и его браншей или реплантированных ветвей аорты.
Диагностика таких аневризм предусматривает использование КТ, ангиографии, ЭхоКГ. Ценность чреспищеводной ЭхоКГ заключается при этом в возможности выявления деструкции корня аорты и ан-нулярных абсцессов. Большой диагностической значимостью обладает МРТ, позволяющая различить перипротезную жидкость или кровь, а также выявляет перипро-тезное воспаление. 100 % чувствительностью в определении инфицирования протезов обладает сцин-тиграфия с мечеными лейкоцитами. Важным диагностическим шагом в такой ситуации является при возможности КТ-контролируемая пункция перипротезного пространства с посевом содержимого с целью исследования флоры и чувствительности к антибиотикам. То же справедливо для отделяемого из ран и крови. Наиболее часто при инфекции аортальных протезов высевают Staphylococci aureus et epidermidis (до 60 % случаев), что прогностиче-
ски менее благоприятно, чем выделение других возбудителей. Среди последних находят Pseudomonas, Salmonella, Streptococcus, Entero-bacter, Proteus, Bacteroides fragilis, Klebsiella, Corynebacterium, Citro-bacter, Escherichia coli, Enterococci, Candida и другие грибы.
Если инфицирование протеза аорты было вызвано не стафилококками, а менее агрессивными возбудителями, некоторым авторам удавалось добиться в небольшой части случаев излечения больных консервативными мероприятиями — эвакуацией парапротезного содержимого, дренированием (под контролем КТ), промыванием перипротезного пространства и ирригацией протеза антибиотиками. Ряд хирургов в таких ситуациях использовали дополнительно окутывание протеза мышечными лоскутами или сальником без удаления протеза.
Второй подход к лечению инфицированных протезов грудной аорты заключается в репротезировании in situ по принципам, описанным в разделе, посвященном микотиче-ским аневризмам. Несмотря на большое количество сообщений по этой теме, включающих значительное количество наблюдений (до нескольких десятков), среди авторов нет единства в выборе пластического материала (аллопротезы, гомо- и биотрансплантаты), разнятся показатели летальности — от 5 до 50 % [Chan F.Y. et al., 1989; Coselli J.S. et al., 1990; Sversson L.G., 1994]. Очень важной при таких операциях является профилактика реинфек-ции, заключающаяся, в числе других мероприятий, в ликвидации мертвых пространств, остающихся после резекции ложных аневризм, и удалении нежизнеспособных и инфицированных тканей вокруг аорты и протеза. Накопление крови или жидкости в таких свободных, незакрывшихся полостях — наиболее значимый фактор риска повторного бактериального обсеменения.
660
Заполнение этих пространств и окутывание нового протеза или аорты производят сальником, мышечными лоскутами (из грудных мышц, прямых мышц живота, зубчатых, широчайших мышц спины, межреберных) с помощью торакопластики в различных модификациях. Практически у всех больных с ложными аневризмами протезов грудной аорты или без них на фоне инфекции доступ в средостение или плевральную полость может сопровождаться массивным кровотечением. Поэтому в таких ситуациях предпочтительнее подключать АИК через бедренные артерию, вены, охлаждать больного до состояния глубокой гипотермии и только после этого приступать к основному этапу операции.
В дальнейшем больных после консервативного лечения или ре-протезирования, как и при микоти-ческих аневризмах, переводят на пожизненный прием антибиотиков.
К посттравматическим аневризмам грудной аорты относят случаи частичного или полного разрыва стенки аорты с формированием хронического расширения (аневризмы) аорты и существующие в течение 3 мес и более после эпизода закрытой травмы грудной клетки. Основными видами закрытой травмы, приводящими к таким аневризмам, являются автомобильные аварии и падение с высоты, когда происходит разрыв аорты в местах ее фиксации (отхождение восходящей аорты от сердца, перешеек аорты в месте прикрепления артериальной связки, нисходящая аорта при прохождении через аортальное отверстие диафрагмы) за счет того, что менее фиксированные сегменты аорты продолжают движение при резком торможении, смещаясь относительно более фиксированных. Первым травматический разрыв аорты описал в 1557 г. Vesalius у больного после его падения с лошади. В XX в., особенно в
последние десятилетия, с появлением высокоскоростных транспортных средств частота таких разрывов и соответственно образования посттравматических аневризм существенно возросла. От 73 до 92 % пациентов с травматическими разрывами аорты являются водителями, пассажирами или пешеходами. От 70 до 80 % таких больных — мужчины, средний возраст которых 35—37 лет. В некоторых патолого-анатомических статистиках до 20 % смертей вследствие автоаварий сопровождалось разрывом аорты.
Среди пациентов с острым разрывом аорты приблизительно только 2—5 % выживают без операции, и у них формируются хронические ложные аневризмы. У 90—94 % этих больных аневризмы локализуются в перешейке аорты, а в остальных наблюдениях равномерно распределяются между восходящей аортой, дугой и нисходящим отделом грудной аорты.
Среди неоперированных по поводу хронических посттравматических аневризм грудной аорты больных в сроки до 5 лет выживает 71 %, до 10 лет — 66 % и до 20 лет — 62 %, но среди умерших треть погибает от разрыва аневризмы в поздние сроки. Клиническая симптоматика, связанная с аневризмой аорты, в течение первого года появляется у 22 % пациентов, через 5 лет — имеется у 42 % и через 10 лет — у 58 % пациентов.
5.7.3. Расслоение аорты
Расслоением аорты называется расхождение (разделение) медии аорты на два слоя за счет попадания внутрипросветной крови через разрыв интимы и возникновение патологического сообщения между истинным просветом аорты и образовавшимся каналом в среднем слое аорты, называемым ложным просветом.
661
Ранее в случае описываемого заболевания аорты широко использовался термин «расслаивающие аневризмы аорты». Во-первых, этот термин неприменим к больным с острым расслоением, когда практически не происходит значимого расширения аорты, а во-вторых, даже при хронической стадии заболевания далеко не у всех пациентов образуется аневризма за счет ослабления стенки аорты или расслаивается ранее существовавшая аневризма, когда был бы уместен термин «расслаивающая аневризма аорты». В связи с вышесказанным наиболее употребляемым и принятым на сегодняшний день является термин «расслоение аорты».
Первое упоминание о расслоении аорты относится к средним векам и принадлежит D.Sennertus, представившему в 1650 г. описание расхождения слоев аортальной стенки. В новое время фундаментальную работу по строению, физиологии и патологии сердечно-сосудистой системы с описанием расслоения аорты выпустил в Оксфорде в 1732 г. F.Nichols, который являлся личным врачом короля Георга И, умершего внезапно 26 октября 1760 г. во время акта дефекации. На вскрытии F.Nichols выявил «интравазацию крови между слоями» аорты, вызванную расслоением. Приблизительно в то же время G.B.Morgagni (1761) сообщил о патологических изменениях при разрыве аорты в перикард. Еще через 40 лет J.P.Maunoir определил понятие «расслоение». Термин «расслаивающая аневризма» ввел в обращение в 1819 г. R.Laen-nес. В 1822 г. J.Shekelton представил наблюдение «двуствольной» аорты, возникшей в результате образования дистальной фенестра-ции.
Хирургическое лечение расслоений аорты до середины 50-х годов XX в. заключалось в попытках создания широкого сообщения между
истинным и ложным просветом аорты, которые заканчивались фатально. Первая успешная операция при расслоении аорты была выполнена М.Е. De Bakey и соавт. в 1955 г. Она заключалась в иссечении расширенной порции аорты, сшивании дистальных расслоенных слоев и восстановлении проходимости нисходящего отдела аорты анастомозом конец в конец. C.A.Hufnagel к 1961 г. и P.W.Conrad к 1962 г. суммарно накопили опыт 7 наблюдений хронических расслоений восходящей аорты, при которых проводилось линейное протезирование аорты и пликация аортального клапана. В 1962 г. G.C.Morris, W.S.Henly и М.Е. De Bakey впервые выполнили успешное вмешательство при остром расслоении восходящей аорты. Этому же больному в 1977 г. было проведено протезирование аортального клапана, а в 1990 г. — успешное протезирование восходящей аорты клапансо-держащим кондуитом.
В России первую успешную операцию при расслоении восходящей аорты произвел Б.В.Петровский в 1964 г., а при расслоении торакоаб-доминального отдела аорты (в условиях искусственного кровообращения) — А.В.Покровский в 1965 г. При расслоении восходящей аорты впервые операцию Cabrol выполнил Г.И.Цукерман в 1983 г.
Расслоения аорты в зависимости от срока, прошедшего от начала заболевания, делят на острые (до 2 нед) и хронические. Ряд авторов выделяют и подострую стадию болезни сроком до 2 мес. Длительность острого периода определяется тем, что в течение этого времени отмечается наибольшая хрупкость стенки аорты и максимально выражено ее воспаление, и тем, что в эти сроки погибают 74 % неопери-рованных больных с расслоениями аорты.
Для описания расслоений аорты по локализации и протяженности в
662
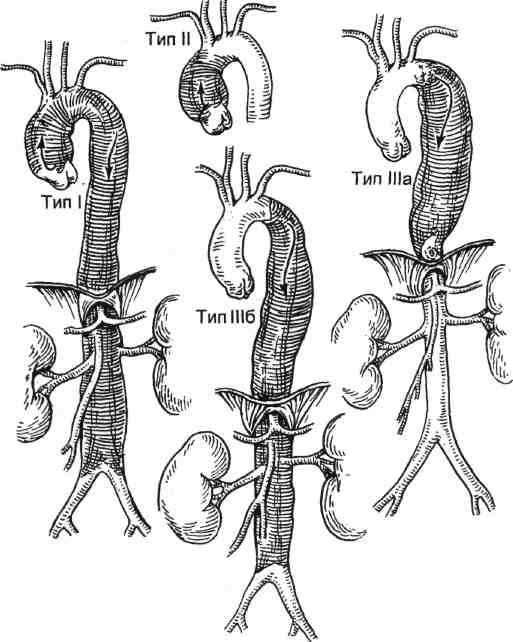
свое время были предложены две оригинальные классификации. De Bakey в 1965 г. разделил расслоения аорты следующим образом (рис. 5.57):
I тип — расслоение начинается в восходящем отделе, переходит через дугу в нисходящий отдел, а далее может распространяться на любом протяжении;
II тип — расслоение захватывает только восходящую аорту;
IIIа тип — расслоение начинается ниже устья левой подключичной артерии и распространяется только в пределах нисходящего отдела аорты;
IIIb тип — расслоение такое же, как и при типе IIIa, но распространяется через аортальное отверстие диафрагмы на брюшную аорту (рис. 5.58).
В классификации De Bakey не выделены в самостоятельные подгруппы расслоения, начинающиеся в дуге аорты. Все такие расслоения
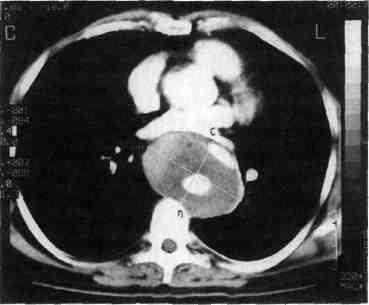
Рис. 5.58. КТ больного с хроническим расслоением типа IIIb.
663
даже при интактном состоянии восходящего отдела аорты автор относил к I типу расслоения.
Второй оригинальной классификацией явилась классификация Стэнфордского университета, предложенная Daily и соавт. в 1970 г.:
тип А — любое расслоение, вовлекающее восходящую аорту;
тип В — любое расслоение, располагающееся ниже уровня отхож-дения левой подключичной артерии.
В Стэнфордской классификации любые расслоения дуги аорты без вовлечения восходящего отдела рассматриваются в настоящее время как тип В, тогда как в оригинальном описании их относили к типу А.
С накоплением опыта стало понятно, что локализация первичного разрыва интимы не так важна, а показания к хирургическому вмешательству и результаты лечения больных при расслоениях зависят только от того, какие отделы аорты — проксимальнее или дистальнее левой подключичной артерии — вовлечены в процесс. Сегодня более широкое распространение получает следующая систематизация расслоений: если расслоение вовлекает восходящую аорту и/или дугу аорты вне зависимости от состояния нисходящего и нижележащих отделов аорты (I и II типы по De Bakey, a также типы III с ретроградным расслоением и тип А по Стэнфордской классификации, включая тип В с ретроградным расслоением), то его относят к проксимальному расслоению. Расслоение аорты ниже левой подключичной артерии без поражения проксимальной аорты (типы III по De Bakey и В по Стэнфордской классификации без ретроградного расслоения) относят к дисталь-ному расслоению. При расслоении аорты в торакоабдоминальном отделе для более детального описания используется классификация Crawford.
Частота установления диагноза расслоения аорты в США составляет 2000 случаев ежегодно, но истинное их количество остается неизвестным. Среди больных, умерших от расслоения аорты в госпитале, в 35 % наблюдений диагноз прижизненно не устанавливается [Lilien-feld D.E. et al., 1987]. Расслоение, начинающееся в дуге аорты, диагностируется до смерти только у 1/3 пациентов [Roberts C.S., 1990]. В ходе нескольких локальных попу-ляционных исследований было выявлено, что соотношение расслоений аорты и разрывов аневризм брюшной аорты, по которым имеются более четкие статистические данные, составляет 2:1. Исходя из приведенных выше косвенных данных, истинную частоту возникновения расслоений аорты можно приблизительно определить как 10 случаев на 100 000 населения в год [Svensson L.G., Crawford E.S., 1992].
По данным патологоанатомиче-ских исследований, частота расслоений аорты составляет от 0,2 до 0,8 %. Соотношение частоты расслоений у мужчин и женщин, по данным различных авторов, — от 2:1 до 5:1. Пик дистальных расслоений аорты приходится на 60— 70 лет, а проксимальных — на 50— 55 лет. В одной из крупнейших хирургических статистик De Bakey средний возраст при расслоениях I, II и III типов составил 53, 42 и 65 лет соответственно, а соотношение мужчин и женщин при проксимальных расслоениях было 2:1, а при дистальных увеличивалось до 3:1.
Этиология. Основными причинами возникновения расслоений являются дегенеративное поражение медии аорты и артериальная гипер-тензия. Частота обнаружения ги-пертензии у больных с расслоениями аорты в многочисленных клинических и патологоанатомических исследованиях составляет 75 % и выше — вплоть до 90 %. Считается, что повышенное артериальное дав-
664
ление может приводить к расслоению само по себе в отсутствие дегенеративного заболевания аорты за счет возникновения механических и метаболических напряжений в стенке аорты в ответ на пульсовую волну. Подтверждением сказанному служит факт редчайших расслоений легочной артерии, которые происходят только в присутствии легочной гипертензии. Следует отметить, что при проксимальных расслоениях артериальная гипертензия отмечается у 80 % пациентов, тогда как при дистальных — только у 50 %. В принципе, развитие расслоений может происходить при всех тех же заболеваниях, которые приводят к возникновению аневризм грудной аорты, рассматриваемых в соответствующем разделе, но некоторые особенности требуют обсуждения.
Одно- или двустворчатое строение аортального клапана выявляют приблизительно у 9 % больных с проксимальным расслоением аорты, что в 5 раз чаще, чем встречаемость указанного врожденного дефекта клапана в популяции. Считается, что причиной дегенерации медии в восходящем отделе аорты в такой ситуации служат те же врожденные аномалии развития, которые приводят к формированию одно- или двустворчатого клапана. Подтверждением сказанному может служить то обстоятельство, что при неполном количестве створок аортального клапана проксимальная фенестрация при расслоениях всегда находится в восходящей аорте, тогда как в общей группе проксимальных расслоений такое местоположение указанной фенестрации отмечается лишь в 68 % наблюдений.
Еще в 1928 г. M.E.Abbott в статистике из 200 случаев показала, что расслоение при коарктации аорты в сегменте аорты, расположенном проксимально к перешейку, происходит в 8 раз чаще, чем в дисталь-ной порции, причем эта частота на-
растает с возрастом. Полагают, что причиной данного обстоятельства является сочетание дегенерации медии именно с проксимальной ги-пертензией. Среди больных с врожденными заболеваниями сосудистой ткани расслоения аорты возникают чаще, чем собственно аневризмы. Так, при синдроме Марфа-на у 75 % больных операции выполняют именно по поводу или расслоений аорты, или расслоения ранее существовавших аневризм.
Расслоение — наиболее частый клинический симптом при идиопа-тическом кистозном медионекрозе Эрдгейма, описанного автором в 1929 г. Также чаще расслоением, а не образованием аневризмы сопровождаются редкие ятрогенные повреждения аорты. Часто в качестве причины расслоения описывается локальная травма аорты при наложении зажима, особенно в пораженном участке аорты и при наличии расширения последней.
Медионекроз беременных является причиной расслоений аорты у 50 % женщин моложе 40 лет [Hirst A.E., 1958]. Расслоение аорты возникает чаще в III триместре или во время родов. Причиной развития медионекроза считают гемодинами-ческие и гормональные изменения во время беременности, которые связывают с возрастанием уровня релаксина, что сопровождается деструкцией соединительной ткани.
Особо следует отметить повышение риска расслоения аорты у больных после операции протезирования аортального клапана. Pieters и соавт., анализируя данные литературы, касающиеся 31 больного с указанным осложнением, в 68 % случаев отметили артериальную ги-пертензию, в 88 % — расширение восходящей аорты на момент первичного вмешательства и в 55 % случаев — аортальную регургита-цию. Среднее время возникновения расслоения аорты после протезирования клапана составило 4,3 года
665
(от 0,1 до 15 лет), и 55 % пациентов с данным осложнением погибли. Собственный опыт авторов (330 протезирований аортального клапа на) включал 18 больных, у которых, по данным дооперационной эхогра фии, размер восходящей аорты со ставлял более 5 см. У 4 из этих 18 пациентов произошло расслоение восходящей аорты, причем всем имплантировали монодисковые
протезы. Из оставшихся 14 человек троим была выполнена повторная превентивная операция по протезированию восходящей аорты. Ни у одного больного с исходным размером восходящей аорты менее 5 см расслоения аорты после протезирования аортального клапана не произошло. Кроме того, риск расслоения повышается и после других вмешательств на восходящей аорте (аортокоронарное шунтирование).
Патологическая анатомия и патологическая физиология расслоений аорты. Расслоение аорты начинается с разрыва интимы более чем у 95 % пациентов. В 65 % случаев проксимальная фенестрация располагается на 1—3 см выше устьев коронарных артерий, в 20 % наблюдений — в верхней порции нисходящей аорты, в 10 % — в дуге аорты и в 5 % случаев — в других отделах аорты, крайне редко и в абдоминальном. В патологоанатомических статистиках, касающихся расслоений, острое вовлечение восходящей аорты отмечено в 65—86 % наблюдений и у 70 % больных причиной смерти послужила тампонада сердца. В большинстве случаев разрыв интимы располагается поперечно и занимает более полуокружности аорты. Точные причины возникновения разрывов интимы неизвестны. При атеросклерозе предполагается, что причиной разрыва интимы может служить изъязвление бляшки. У небольшой части больных (13 % — по данным чреспище-водной ЭхоКГ и 4 % — по результатам вскрытий) не удается выявить
сообщений между истинным и ложным просветами. Такая ситуация описывается как интрамуральная гематома, которая содержит кровь в свернувшемся состоянии. Существование интрамуральных гематом позволяет предположить механизм расслоения за счет разрыва vasa va-sorum или кровоизлияния в область некроза медии. Очень редко (типично для пациентов с синдромом Марфана — приблизительно в 6 % наблюдений) выявляют разрывы интимы грудной аорты, не продолжившиеся в расслоение.
Отслоенная мембрана, или перегородка, между истинным и ложным просветами состоит из интимы и, как правило, внутренней трети медии. Ширина ложного просвета может колебаться от 1 мм до полного циркулярного расслоения медии, а протяженность — от включения в процесс локального сегмента аорты (изолированное расслоение восходящего отдела аорты) до расслоения всей аорты в грудном и брюшном отделах, а в ряде случаев с ретроградным переходом на межжелудочковую перегородку или распространением ниже бифуркации аорты. Расслоение может захватывать только одну или несколько стенок аорты, но часто имеет спиральный ход, неоднократно обходя аорту по периметру. При вовлечении восходящей аорты ложный канал, как правило, начинается по ее правой полуокружности, переходит на переднюю или левую боковую стенку дуги аорты и спускается по левой стенке нисходящего отдела.
Если расслоение заканчивается слепым мешком, то чаще всего происходит полный или частичный тромбоз ложного просвета. При наличии дистальной фенестрации (т.е. возврате крови из ложного просвета обратно в истинный через дистальные разрывы интимы) в ложном просвете продолжает поддерживаться, как правило, актив-
666
ный кровоток. Разрыв слепого мешка через адвентицию приводит к массивной кровопотере и быстрой смерти больного.
Как при остром, так и при хроническом расслоении возможно сдавление истинного просвета ложным вплоть до полного. В такой ситуации адекватность перфузии ветвей дуги аорты начинает зависеть от присутствия и размеров дисталь-ных фенестраций. Нарушения проходимости ветвей аорты возникают приблизительно в 30 % случаев. Помимо вышеописанного механизма, это может происходить за счет обструкции сосуда отслоенной мембраной между истинным и ложным просветами, сдавления артерии ложным просветом вплоть до развития тромбоза, распространением расслоения на ветвь аорты или отрывом артерии от истинного просвета, приводя к тому, что кровоток по ней может осуществляться только из ложного просвета. Клинические проявления указанных осложнений весьма вариабельны и представлены нарушениями мозгового кровообращения (включая спинальные), развитием почечной недостаточности, мезентериальной ишемией и ишемией нижних конечностей.
Обычно расслоение распространяется от первичного разрыва интимы в каудальном или антеград-ном направлении, но возможно и ретроградное расслоение аорты, а иногда в обоих направлениях. В случае ретроградного распространения проксимального расслоения на синусы Вальсальвы (обычно минуя некоронарный синус) возникает тяжелая аортальная регургитация, как правило, приводящая к фатальной сердечной недостаточности. Нарушение проходимости коронарных артерий (чаще поражается правая) сопровождается острой ишемией миокарда. Еще более проксимальное расслоение, переходящее в левый желудочек на межжелудочко-
вую перегородку, приводит к нарушениям ритма вплоть до остановки сердца и несостоятельности митрального клапана.
Основной причиной смерти при острых проксимальных расслоениях является тампонада сердца или сдавление коронарных артерий за счет внутриперикардиального разрыва восходящей аорты или накопления жидкости в полости сердечной сорочки за счет транссудации. Острая правожелудочковая недостаточность может возникать вследствие сдавления легочной артерии или разрыва в нее расслоенной восходящей аорты. Как при проксимальных, так и при дистальных острых расслоениях разрыв может происходить в средостение, плевральные полости, пищевод, бронхиальное дерево, забрюшинное пространство, свободную брюшную полость, крупные венозные стволы (верхняя или нижняя полые вены, левая почечная). Основной точкой разрыва аорты при острых расслоениях является адвентиция в области проксимальной фенестраций. Помимо разрывов, выживаемость больных в остром периоде определяется тем, продолжается ли распространение расслоения, возникает ли дистальная фенестрация и насколько выражена ишемия органов, питаемых ветвями аорты с нарушенной проходимостью вследствие расслоения. Осложнениями течения расслоений в хронической стадии являются разрыв аорты, развитие аневризм аорты, вновь появляющиеся расслоения и возникновение ишемии органов, кровоснабжа-емых ветвями аорты, вовлеченными в расслоение. Разрыв аорты в хронической стадии расслоения возникает у 30 % пациентов и прежде всего определяется качеством контроля за артериальной гипертензией. По данным De Bakey (1982), такие разрывы отмечаются у 46 % больных с гипертензией и только у 17 % без таковой. Кроме того, риск раз-
667
рыва в значительной степени зависит от размера аорты. По данным L.G.Svensson и др. (1990), в 88 % наблюдений размер аневризмы аорты при разрыве составлял до 10 см, а при ее размере до 6 см разрыв состоялся только у 23 % пациентов. Исследования показали, что при хроническом расслоении риск разрыва аорты значительно возрастает, если последняя достигает диаметра 5 см и более [Svensson L.G. et al., 1992].
Клиническая картина расслоения аорты характеризуется острым, практически мгновенным началом на фоне повышенного артериального давления с развитием интенсивного болевого синдрома, выраженного настолько, что внешне, несмотря на гипертензию, больной выглядит как находящийся в кол-лаптоидном состоянии (заторможенность, фиксация взора, холодный липкий пот, слабая периферическая пульсация). Причинами нередко стойкой и тяжелой гипертен-зии являются повреждение бароре-цепторов аорты, выброс катехола-минов и в ряде случаев, как правило, при вовлечении в расслоение левой почечной артерии — активация ренин-ангиотензиновой системы. Снижение артериального давления приводит к приостановке расслоения аорты и уменьшению выраженности болевого синдрома со стабилизацией общего состояния, но затем возможно волнообразное нарастание этого процесса вновь и вновь. Причинами гипо-тензии при расслоении аорты, помимо компенсаторных механизмов (вазоплегия вследствие шока, перераспределение ОЦК), могут служить тампонада сердца, аортальная регургитация, разрыв аорты, окклюзия коронарной артерии. Локализация боли зависит от места начала расслоения: за грудиной — при I и II типах, в межлопаточной области — при III типе. Однако с распространением расслоения ис-
точник боли смещается и может достигать нижних отделов живота и поясничной области. В 10—15 % случаев расслоение протекает практически бессимптомно и первыми симптомами заболевания служат признаки ишемии других органов и систем.
Вне зависимости от наличия или отсутствия болевого синдрома типичными острыми проявлениями ишемии прочих органов являются коронарная недостаточность (3 %), инсульт или преходящие нарушения мозгового кровообращения (7 %), парапарез или параплегия (2,5 %), клиника мезентериального тромбоза (1,5 %), острой почечной недостаточности, острой артериальной непроходимости нижних конечностей (13 %). Недостаточность аортального клапана отмечается у 2/3 больных, причем у 55 % она носит выраженный характер.
Симптомы хронического расслоения и его осложнений (разрыв) идентичны описанным в разделе грудных аневризм и определяются обширностью расслоения, т.е. степенью вовлечения в процесс различных отделов грудной аорты. Среди больных с хроническим расслоением аневризмы в 25 % случаев они формируются в сроки до 5 лет после эпизода острого расслоения [De Bakey M.E., 1982]. Клиническая симптоматика у пациентов с хроническим расслоением в первую очередь связана с увеличением размеров аорты.
Диагностика. При физикальной диагностике особое внимание необходимо обращать на различие в пульсации между артериями верхних конечностей или верхних и нижних конечностей, наличие признаков тампонады сердца (парадоксальная пульсация, ослабление тонов сердца) и аортальной недостаточности: диастолический шум определяется у 50 % больных [Svensson L.G., Crawford E.S., 1992]. Прочие физи-кальные признаки идентичны тако-
668
вым, представленным в разделе «Аневризмы грудной аорты».
Тактика ведения больного с подозрением на острое расслоение аорты после госпитализации заключается в качественном, незамедлительном и одновременном проведении трех комплексов мероприятий, начинающихся в отделении интенсивной терапии хирургического стационара:
медикаментозная терапия;
выполнение диагностических исследований;
подготовка к возможной операции.
Больному с подозрением на расслоение аорты устанавливают центральный венозный катетер большого диаметра и максимально быстро начинают введение р-блокаторов и вазодилататоров для замедления ритма и снижения АД. Частота сердечных сокращений должна колебаться в пределах 60—70 ударов в 1 мин, а систолическое АД необходимо поддерживать в пределах 90— 100, но не выше 100 мм рт.ст. Одновременно с введением артериального катетера в лучевую артерию, катетера Свана—Ганца — в легочную налаживают ЭКГ-мониториро-вание, проводят катетеризацию мочевого пузыря с определением почасового диуреза, выполняют рентгенографию легких, параллельно собирают анамнез и проводят фи-зикальный осмотр с учетом неврологического статуса и проходимости артерий конечностей. Последнее обстоятельство важно для выбора схемы подключения АИК. Физикальный статус необходимо мониторировать на протяжении до-операционного этапа, так как его изменения могут произойти в любой момент. Болевой синдром контролируют на основании частоты сердечных сокращений и АД, но если они снижены до вышеуказанных пределов, а боль сохраняется, то вводят опиаты. В обязательном порядке обеспечивают ингаляцию
кислорода, устанавливают группу крови, определяют и мониторируют уровень гемоглобина, гематокрита, электролитов, газового состава и основных биохимических показателей крови. Следует избегать переливания большого объема жидкостей из-за опасности повышения АД вследствие гиперволемии.
Прежде чем начинать диагностические мероприятия, необходимо провести дифференциальную диагностику между острым расслоением аорты и острой ишемией миокарда. Окончательное и быстрое решение данного вопроса жизненно важно для таких больных, поскольку необходимое при коронарной недостаточности немедленное введение тромболитиков приведет к фатальному исходу расслоения.
В принципе для диагностики расслоений аорты (особенно хронических) используют все те же методы, что и при грудных аневризмах, тем не менее некоторые особенности требуют обсуждения. Цель диагностической стратегии при остром расслоении — прежде всего выявление расслоенной мембраны в просвете аорты и ее дифференциация с интрамуральной гематомой, т.е. подтверждение или исключение собственно диагноза расслоения (рис. 5.60). Вторым принципиальным моментом в диагностике острых расслоений является определение локализации процесса — проксимальное или диста-льное, что определяет выбор тактики лечения — оперативное или консервативное. В случае выявления мембраны при остром проксимальном расслоении операция является абсолютно показанной без дополнительной диагностики в отсутствие осложняющих факторов, так как состояние дуги аорты и устьев коронарных артерий может быть адекватно оценено интраопе-рационно. В целом же вопрос об объеме и виде диагностических манипуляций зависит от срочности
669

ситуации и возможностей учреждения.
Больных с нестабильной гемодинамикой и отсутствием эффекта от первичных немедленных медикаментозных воздействий при подозрении на проксимальное расслоение переводят в операционную, где после начала общей анестезии одновременно с подготовкой к хирургическому вмешательству (подключение линий мониторирования) выполняют чреспищеводную ЭхоКГ. При подтверждении диагноза производят операцию. В случае исключения диагноза расслоения или затруднительности визуализации аорты больной после стабилизации или начала относительной контролируемости состояния может быть переведен в блок интенсивной терапии для дальнейшего лечения или перемещен в другие диагностические кабинеты (КТ, ангиография).
При относительно стабильном состоянии пациентов с острым расслоением аорты методом выбора в диагностике является та же чреспищеводная ЭхоКГ. Следующее место по доступности, быстроте, аккуратности и распространенности занимает КТ с контрастированием, причем использование спирального КТ с трехмерной реконструкцией, возможно, повысит точность метода [Svensson L.G. et al., 1990]. Применение MPT при остром расслоении аорты ограничено, хотя по точности этот метод диагностики даже несколько опережает чреспищеводную ЭхоКГ. Использование МРТ возможно в редких случаях острого расслоения только у полностью стабильных пациентов, способных обойтись значительное время без медикаментозной поддержки и мониторинга. Кроме того, данная методика иногда абсолютно необхо-
670
дима при остром расслоении для выявления состояния дуги аорты (невозможность визуализации при чреспищеводной ЭхоКГ) в случае подозрения на ретроградное расслоение при III и В-типах расслоения.
Частота использования ангиографии при острых расслоениях постепенно снижается прежде всего из-за травматичности метода для крайне тяжелых пациентов. Тем не менее, если учитывать состояние (проходимость) ветвей аорты при расслоении, ангиография остается методом выбора. О необходимости выполнения коронарографии при остром расслоении единого мнения у хирургов нет. С одной стороны, ряд авторов считают, что у 10—30 % пациентов с поражением коронарных артерий и проксимальным расслоением аорты интраоперацион-ная оценка вполне достаточна для решения вопроса об одномоментной реваскуляризации миокарда [Larson E.W., 1984]. С другой стороны, было доказано, что выполнение одномоментного аортокоронарного шунтирования у больных с проксимальным расслоением аорты не влияло на госпитальную выживаемость, хотя отдаленная выживаемость у больных с сопутствующей ИБС без реваскуляризации миокарда была достоверно ниже [Svensson L.G. et al., 1990].
Естественное течение расслоений аорты. При острых проксимальных расслоениях летальность в течение первых 24 и 48 ч составляет, по меньшей мере, 33 и 50 % соответственно, т.е. каждый час погибает не менее 1 % неоперированных больных. В течение недели умирает 80 %, а в течение первого месяца — 95 % пациентов с острыми проксимальными расслоениями аорты. Среди больных с хроническими проксимальными расслоениями через 5 лет остаются в живых 10— 15 %. При дистальных расслоениях в течение месяца остаются в живых
75 % пациентов. В наибольшей сборной статистике, опубликованной в 1972 г. и учитывающей 963 случая нелеченных острых как проксимальных, так и дистальных расслоений, летальность через неделю составила 70 %, через 3 мес — 90 %, а через 3 года были живы только 8 % больных.
Показания к оперативному лечению:
▲ при остром проксимальном рас слоении аорты показана экстренная операция из-за крайне высокого риска разрыва аорты или тампона ды сердца. При выраженной тампо наде сердца и гипотензии во время подготовки к операции для восста новления жизненно важных функ ций организма показана пункция перикарда с постепенным дрениро ванием для профилактики возмож ного разрыва аорты вследствие рез кого возрастания АД. Неврологиче ский дефицит не является противо показанием к операции, так как у большинства пациентов происходит его полный регресс после вмешате льства [Svensson L.G., Crawford E.S., 1992];
▲ при хроническом проксимальном расслоении аорты показано плановое оперативное вмешательство вне зависимости от размера аорты, симптоматики, обусловленной расширением аорты, осложнений вследствие произошедшего острого расслоения или выполненных ранее хирургических вмешательств;
▲ при остром дистальном расслое нии аорты оперативное лечение считается показанным в случае рефрактерности артериальной ги- пертензии или болевого синдрома к медикаментозной терапии, рециди ве болей, увеличении диаметра аор ты свыше 5 см, возникновении осложнений, связанных с наруше нием проходимости ветвей аорты (почечная недостаточность, парапа- рез/параплегия, ишемия конечно стей и/или кишечника), разрыве аорты;
671
▲ при хроническом дистальном расслоении операция показана больным с симптомным течением заболевания, при размерах аорты более 5 см и при росте диаметра аорты более 1 см в год.
