
- •5.3.4. Естественное течение
- •5.3.5. Кардиальные проявления синдрома Марфана (клиника, диагностика и хирургическое лечение)
- •5.3.5.2. Аневризма восходящей аорты
- •5.3.6. Общие вопросы хирургии аневризм восходящей аорты
- •5.3.6.1. Открытая техника формирования дистального анастомоза
- •5.3.7. Частные вопросы хирургии аневризм восходящей аорты
- •5.3.7.1. Имплантация клапансодержащего кондуита
- •5.3.7.2. Клапансохраняющие операции
- •5.3.7.3. Протезирование дуги аорты
- •5.3.8. Осложнения
- •5.3.9. Результаты операций
- •5.3.10. Синдром Марфана у детей
- •5.3.11. Особенности кардиологического мониторинга у пациентов с синдромом Марфана
- •5.4. Врожденные деформации дуги аорты
- •5.5. Коарктация аорты
- •5.6. Открытый артериальный проток
- •5.7. Аневризмы грудного отдела аорты
- •5.7.1. Аневризмы грудной аорты
- •5.7.2. Отдельные нозологические формы, вызывающие развитие аневризм грудной аорты
Новая диагностическая схема базируется на больших и малых клинических критериях синдрома, относящихся к различным органам и системам и их комбинациям. Большие критерии состоят из симптомов со стороны опорно-двигательной, сердечно-сосудистой систем и органа зрения. Например, диагностической значимостью относительно опорно-двигательного аппарата обладает обнаружение по крайней мере 4 из 8 типичных симптомов: pectus carinatum («куриная» грудь), pectus excavatum (грудь сапожника), симптомы большого пальца и запястья, уменьшение соотношения между верхним и нижним сегментами тела (индекс Аполлона) и сколиоз (>20°). Основным критерием, характеризующим сердечно-сосудистую систему, считаются дилатация или расслоение восходящей аорты, а при исследовании органа зрения — дислокация хрусталика.
Среди больших признаков следует особо выделить растяжение твердой мозговой оболочки спинного мозга (dural ectasia), которая вызывает узурацию пояснично-крестцо-вого отдела позвоночного столба (менингоцеле) и может быть обнаружена рентгенологически у 50— 60 % пациентов с СМ. Дуральная эктазия может быть ценным симптомом, поскольку с высокой специфичностью встречается лишь у пациентов с СМ, синдромом Элерса— Данло и нейрофиброматозом. Диагностическая значимость этого симптома повышается при использовании магнитно-резонансной томографии. По данным R.Fattori и соавт., эктазия твердой мозговой оболочки наблюдается у 90—92 % пациентов с СМ.
Малые критерии включают дополнительные патологические признаки, характерные для вышеупомянутых органов и систем, а также специфические проявления, касающиеся дыхательной системы, кожи
и наружных покровов. В случае отсутствия семейного анамнеза СМ диагноз основывается на обнаружении больших критериев, касающихся по крайней мере двух основных систем и тех или иных малых признаков — третьей системы. Если же в семье ранее была обнаружена мутация соответствующего гена, для постановки диагноза достаточно только одного большого признака и какого-либо признака поражения другой системы. Если мутация не определяется, для диагностики СМ необходимо наличие одного большого критерия в семейном анамнезе, одного большого критерия со стороны какого-либо органа или системы и малых признаков поражения другой системы.
Пациентов с СМ следует отличать от больных с так называемой неонатальной (инфантильной, или врожденной) формой СМ (н-СМ). У пациентов с н-СМ «марфаноид-ные» черты присутствуют уже при рождении. В то же время для этих больных характерны некоторые проявления, отсутствующие при СМ. Доминирующие черты поражения сердечно-сосудистой системы при н-СМ включают пролапс митрального и трикуспидального клапанов, нередко сочетающийся с выраженной регургитацией, и дилата-цию корня аорты, напротив, с редко возникающей регургитацией (выраженная регургитация на аортальном клапане — типичный признак классического СМ). Кроме того, для н-СМ характерна дилатация легочной артерии, что редко встречается при СМ. Скелетные проявления, такие как арахнодак-тилия, долихоцефалия, деформация грудной клетки и плоскостопие, являются часто встречающимися признаками н-СМ. У этих больных также наблюдаются сгибательные контрактуры, гипермобильные суставы, а отличительной чертой синдрома считается старческий внешний вид больного. Основной при-
553
чиной смерти при этом становится прогрессирующая сердечная недостаточность, развивающаяся, как правило, на первом году жизни.
Проявления СМ могут выступать в виде изолированных независимых доминирующих признаков, не удовлетворяющих принятым диагностическим критериям СМ. В 1994 г. была описана доминирующая дислокация хрусталика с некоторыми скелетными (но не сердечно-сосудистыми) проявлениями, связанная с первой мутацией FBN1. Интересно и то, что относительно недавно мутации в гене FBN1 были обнаружены в семьях, имеющих только скелетные проявления СМ.
В настоящее время хорошо известно, что фенотипические проявления синдрома могут варьировать от едва заметных скелетных аномалий или изолированной эктопии хрусталика до тяжелых патологических проявлений болезни, порой несовместимых с жизнью и наблюдающихся у новорожденных. Несмотря на наличие генетических и биохимических маркеров заболевания, диагноз СМ с классическим фенотипом по ряду причин остается чисто клиническим.
Диагностические признаки основываются на манифестации проявлений патологии основных органов и систем: глаз, костной системы, сердца и аорты и др., а также на семейном анамнезе.
Патология глаз. Глазные симптомы выявляют у 80 % мужчин и 60 % женщин с СМ. Наиболее характерные из них — двусторонний подвывих и вывих хрусталика, направленный почти всегда кверху и кнаружи. С возрастом почти у всех больных образуется катаракта. Вывих хрусталика в переднюю камеру может привести к вторичной глаукоме. Из-за недостаточной поддержки радужка может описывать волнообразные движения при быстром переводе взора из стороны в сторону.
Возможна спонтанная отслойка сетчатки.
Патология костной системы.
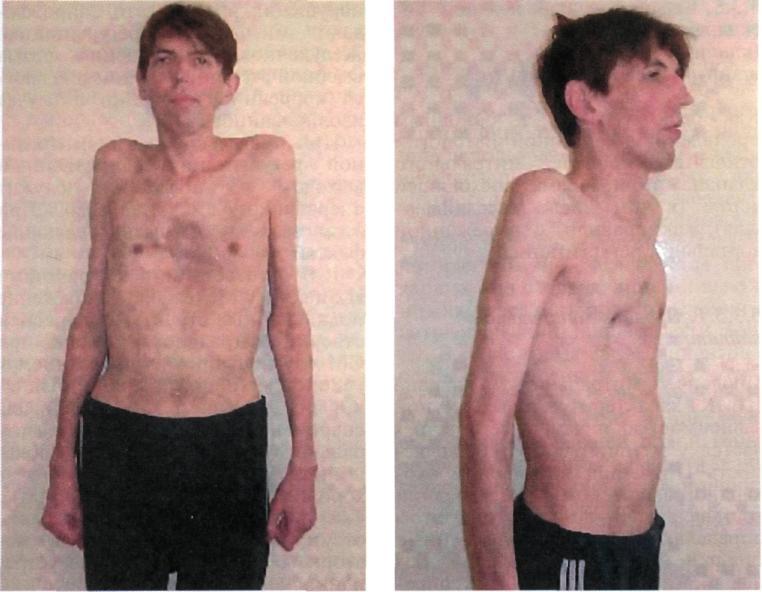
В своей типичной форме болезнь проявляется худобой, высоким ростом, исключительно длинными конечностями, особенно удлинением предплечий и бедер. Размах рук больше, чем рост. Пальцы рук и ног длинные, паукообразные. У части пациентов отмечается выраженная в той или иной степени воронкообразная деформация грудной клетки (рис. 5.16). Голова обычно долихоцефалической формы с развитыми надглазничными гребнями и выступающим лбом, глаза глубоко запавшие. На коже груди, живота, ягодиц могут наблюдаться стрии, гипертрихоз. Подкожный жировой слой и мышцы развиты плохо. Важным признаком может быть расслабленность связок с чрезмерной подвижностью суставов кистей и стоп.
Патология сердечно-сосудистой системы. Примерно у 1/3 больных имеется какой-либо врожденный порок сердца. Наиболее частыми осложнениями со стороны сердечно-сосудистой системы являются пролапс митрального клапана и ди-латация синусов Вальсальвы. Дети с СМ имеют большую склонность к тяжелому поражению митрального клапана, в то время как недостаточность аортального клапана чаще встречается в юношеские годы и у взрослых людей.
Среди перечисленных признаков наиболее ранние и специфичные для СМ следующие:
дилатация и расслоение аорты у молодых пациентов без предшествующей артериальной гипертензии;
подвывих и дислокация хрусталика;
дуральная эктазия.
В то же время сколиоз, гипермобильность суставов, миопия и пролапс митрального клапана характерны и для других наследственных аномалий соединительной ткани.
554
5.3.4. Естественное течение
Средняя продолжительность жизни при СМ составляет от 30 до 50 лет. Основные причины летальности — осложнения сердечно-сосудистой системы, причем дилатация аорты при этом наблюдается в 60—80 % случаев. Разрыв и расслоение аорты наряду с сердечной недостаточностью клапанного генеза — наиболее частые причины гибели больных. Наличие диастоличе-ского шума и кардиомегалии ассоциируется с низкой выживаемостью.
Митральная недостаточность является основной причиной гибели детей с СМ.
Среди пациентов, получающих
b-блокаторы, средняя скорость ди-латации корня аорты составляет 1,9 мм/год, однако индивидуальная частота расширения аорты варьирует в широком диапазоне и порой непредсказуема. В течение 4 лет 25 % пациентов нуждаются в оперативном лечении вследствие прогрессивного расширения диаметра аорты.
Острое расслоение восходящей аорты может произойти даже при сравнительно небольшой ее дилата-ции. У 7 из 26 пациентов, у которых наблюдалось расслоение восходящей аорты, наибольший диаметр аорты оказался менее 6,5 см. Риск осложнений обычно выше у пациентов с семейным анамнезом расслоения аорты.
555
5.3.5. Кардиальные проявления синдрома Марфана (клиника, диагностика и хирургическое лечение)
Как было указано, к основным проявлениям сердечной патологии относятся пролапс митрального клапана и аневризма восходящей аорты (в том числе расслаивающая), как правило, с выраженной аортальной регургитацией.
5.3.5.1. Пролапс митрального клапана
Пролапс митрального клапана (ПМК) характеризуется возрастной зависимостью и чаще всего встречается у женщин с СМ. Выявляе-мость ПМК при двухмерном эхо-кардиографическом исследовании составляет 60—80 %. При этом определяются крупные удлиненные створки митрального клапана. Большей информативностью в определении ПМК обладает сочетание двухмерной, М-модальной и доп-плеровской эхокардиографии.
Непосредственной причиной
митральной регургитации считаются дилатация фиброзного кольца митрального клапана, а также растяжение и/или внезапный отрыв хорд. У 10 % пациентов с подтвержденной регургитацией определяется кальциноз фиброзного кольца митрального клапана.
О прогрессировании заболевания судят по появлению и утяжелению митральной регургитации на основании клинических и эхокардиог-рафических критериев. Подобное прогрессирование наблюдается по крайней мере у 1/4 части пациентов с СМ, что гораздо выше частоты встречаемости ПМК в общей популяции.
Ряд пациентов с ПМК при СМ страдают серьезными желудочковыми и суправентрикулярными нарушениями ритма. Наджелудочковые
нарушения ритма часто сопровождают митральную регургитацию. Желудочковые нарушения ритма высокой степени с трудом поддаются коррекции, особенно в случае изолированного ПМК.
При прогрессировании митральной регургитации единственным выходом из положения служит оперативное вмешательство. При этом важно учитывать следующие факты.
1. В соответствии с работами H.Sirak и M.Ressallat поражение подклапанных структур и передней створки митрального клапана при СМ служило противопоказанием к реконструктивной операции. Однако, по мнению ряда авторов, на современном этапе пластика митрального аппарата при СМ в большинстве случаев успешна и дает хорошие отдаленные результаты. Так, по данным J.Fuzellier и соавт., отсутствие необходимости в повторных операциях с целью устранения митральной недостаточности на протяжении 10 лет после операции отмечено у 87,1 % больных. Лишь у 2 из 28 выживших пациентов митральная регурги-тация достигла умеренной степени выраженности (II степени), причем у одного из них регургитация была связана с отрывом хорды вследствие инфекционного эндокардита.
В случае значительного растяжения створок, наличия повреждения хорд и выраженного кальциноза пластическая коррекция может быть существенно затруднена. Однако распространенный кальциноз не является противопоказанием к проведению пластической коррекции митрального клапана, что подтверждается хорошими клиническими результатами, полученными рядом авторов. В клинических ситуациях, когда результат пластической операции может оказаться непредсказуемым, хорошей альтернативой является протезирование
митрального клапана с сохранением подклапанного аппарата, что, с одной стороны, обеспечивает надежную коррекцию митральной недостаточности и, с другой, позволяет наиболее полно восстановить сократительную способность левого желудочка.
До операции по коррекции митральной регургитации необходимо обращать особое внимание на состояние аорты. Опираясь на тщательное наблюдение за функцией левого желудочка, степенью митральной регургитации и состоянием аорты, рекомендуется по возможности консервативное ведение пациентов до развития выраженной дилатации аорты (синусов Вальса-львы), при которой показано ее (их) протезирование. В этом случае одновременно выполняют коррекцию митральной регургитации. В то же время, если основным показанием к хирургическому вмешательству является дилатация аорты, даже небольшая митральная регур-гитация во время операции на аорте может быть устранена с помощью аннулопластики.
СМ, как практически все наследственные нарушения соединительной ткани, отличается особой предрасположенностью к образованию паравальвулярных фистул вокруг механических протезов, несмотря на особую тщательность хирургов во время их имплантации. Использование методики протезирования митрального клапана с сохранением подклапанного аппарата позволяет укрепить фиброзное кольцо за счет сохраняемых створок и обеспечивает более плотную фиксацию протеза к фиброзному кольцу. Использование биопротезов, наиболее предпочтительное у пациентов старшего возраста, в еще большей степени уменьшает риск развития в послеоперационном периоде паравальвулярных фистул.
