
- •5.3.4. Естественное течение
- •5.3.5. Кардиальные проявления синдрома Марфана (клиника, диагностика и хирургическое лечение)
- •5.3.5.2. Аневризма восходящей аорты
- •5.3.6. Общие вопросы хирургии аневризм восходящей аорты
- •5.3.6.1. Открытая техника формирования дистального анастомоза
- •5.3.7. Частные вопросы хирургии аневризм восходящей аорты
- •5.3.7.1. Имплантация клапансодержащего кондуита
- •5.3.7.2. Клапансохраняющие операции
- •5.3.7.3. Протезирование дуги аорты
- •5.3.8. Осложнения
- •5.3.9. Результаты операций
- •5.3.10. Синдром Марфана у детей
- •5.3.11. Особенности кардиологического мониторинга у пациентов с синдромом Марфана
- •5.4. Врожденные деформации дуги аорты
- •5.5. Коарктация аорты
- •5.6. Открытый артериальный проток
- •5.7. Аневризмы грудного отдела аорты
- •5.7.1. Аневризмы грудной аорты
- •5.7.2. Отдельные нозологические формы, вызывающие развитие аневризм грудной аорты
5.6. Открытый артериальный проток
Открытый артериальный проток
является одним из наиболее часто встречающихся врожденных пороков сердца, составляя 5—10 % от общего числа врожденных сердечных аномалий. Открытый артериальный проток (ОАП) — сосуд, через который после рождения сохраняется патологическое сообщение между аортой и легочной артерией (рис. 5.47).
Артериальный проток — необходимая анатомическая структура в системе кровообращения плода, обеспечивающая эмбриональный тип кровообращения. После рождения, с появлением легочного дыхания и перераспределением кровотока в легочное русло надобность в нем исчезает, и проток постепенно обл итерируется.
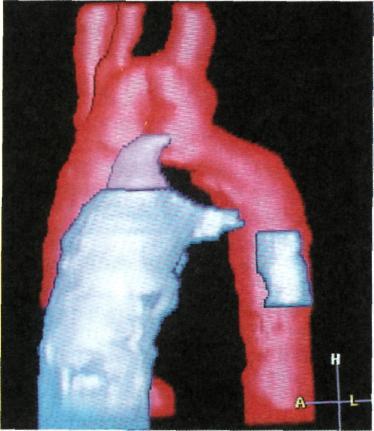
Рис. 5.47. Компьютерная реконструкция открытого артериального протока.
Сведения об артериальном протоке связывали с именем Боталло (Botallus). Функциональное значение артериального протока в эмб-
риональном кровообращении и потеря его в постнатальном периоде впервые были описаны Гарвеем.
О механизме облитерации протока и ее сроках существуют различные мнения. К.Ргес (1955) установил, что функция протока практически прекращается сразу после рождения или продолжается в резко уменьшенном объеме не более 15—20 ч. В норме процесс анатомического закрытия протока длится не более 2—8 нед [Chistie A., 1930].
Определить истоки клинических исследований патологии сложно, но, несомненно, основными из них следует считать работы G.Gibson (1900), установившего диагностическую ценность специфического си-столодиастолического шума.
Идея о возможности хирургического лечения порока принадлежит J.Manro (1907), однако первая успешная операция перевязки ОАП была выполнена Гроссом в 1938 г. [Gross R., Habbard J., 1939]. В 1944 г. им же выполнена и операция пересечения протока [Gross R., 1947].
В нашей стране успешная операция по перевязке ОАП впервые была выполнена А.Н.Бакулевым в 1948 г.
Частота. ОАП — один из наиболее распространенных врожденных пороков сердца. По результатам па-тологоанатомических исследований M.Abbott (1936) он составил 9,8 % среди всех ВПС. По данным различных клинических статистик, частота его встречаемости еще выше — от 11 до 20 % [Петровский Б.В., 1963; Ga-sul В. et al., 1966]. Порок встречается почти в 2 раза чаще у женщин.
Патологическая анатомия. Чаще всего артериальный проток отходит от дуги аорты напротив левой подключичной артерии и идет в косом направлении кпереди и вниз, впадая в бифуркацию легочного ствола
626
и частично в левую легочную артерию. Описаны случаи наличия двух протоков, соединяющих аорту с правой и левой ветвями легочной артерии [Kelsey J. et al., 1953]. Проток имеет форму цилиндра или усеченного конуса длиной 10—25 мм и шириной до 20 мм. Спереди проток покрыт париетальной плеврой, у легочного конца — перикардом. Впереди протока проходит левый блуждающий нерв. Возвратный нерв огибает его по нижнему краю вблизи аорты и поднимается вверх, между задней стенкой протока и главным бронхом левого легкого. Ствол и ветви легочной артерии расширены в мелких легочных артериях и артериолах.
По мере развития легочной ги-пертензии происходят фиброзно-мышечное перерождение и утолщение стенок, а вследствие этого — уменьшение их просвета. Увеличивается количество артериовенозных и артерио-артериальных анастомозов [Архангельская Н.В., 1960; Еси-пова И.К. и др., 1973]. Размеры сердца умеренно увеличены за счет расширения полостей левого предсердия и левого желудочка, а с развитием легочной гипертензии присоединяется гипертрофия правого желудочка. При сердечной недостаточности возможна дилатация всех полостей сердца.
Гемодинамика при ОАП обусловлена поступлением оксигенирован-ной крови из аорты в легочную артерию из-за более высокого внут-риартериального давления как в систолу, так и в диастолу. Соответственно в легкие поступает возрастающий объем крови, который из сосудов малого круга возвращается в левые полости сердца и аорту. Величина артериовенозного сброса крови зависит от диаметра протока, разницы показателей давления между аортой и легочной артерией и соотношения сосудистого сопротивления в малом и большом круге кровообращения.
Вследствие большой резервной емкости сосудистого русла легких даже длительный сброс крови у детей не вызывает развития легочной гипертензии. Периферическое сопротивление в легких у них в норме или несколько снижено. Повышение давления в легочной артерии, вплоть до высокой степени, в основном является следствием передачи давления из аорты при наличии широкого сообщения между сосудами. Сброс способствует объемной перегрузке левого желудочка. Это первая стадия заболевания — стадия первичной адаптации: в этот период могут развиться нарушения кровообращения различной степени тяжести вплоть до критического состояния больных, приводящих к летальному исходу почти в 20 % случаев, если своевременно не будет выполнена операция. Вторая стадия — стадия относительной компенсации, которая обычно наступает в возрасте 2—3 лет и продолжается в течение 20 лет жизни. Она характеризуется длительной гиперволемией малого круга кровообращения, развитием относительного стеноза левого атриовентрику-лярного отверстия, расширением полости левого предсердия, умеренным возрастанием давления в легочных венах, что в свою очередь обусловливает повышение давления в легочной артерии и вызывает систолическую перегрузку правого желудочка [Vernant P. et al., 1955]. Сосудистое сопротивление в легких остается в норме или слегка повышается в результате спазма артери-ол. При дальнейшем естественном течении заболевания наступает перестройка мелких сосудов легких, артериол вплоть до необратимых склеротических изменений. Все это приводит к росту периферического сосудистого сопротивления легких, уменьшению с последующей инверсией сброса крови. Объемная нагрузка на левый желудочек уменьшается и возрастает систолическая
627
перегрузка правого желудочка. Так возникает третья стадия — стадия вторичных склеротических изменений легочных сосудов, при которой постепенно исчезают характерные признаки порока, и начинают преобладать симптомы легочной ги-пертензии.
Классификация. Существует ряд классификаций порока, основанных на различных принципах. В настоящее время широко распространена классификация пороков сердца с возросшим легочным кровотоком, основанная на трех главных гемодинамических показателях:
отношение систолического давления в легочной артерии к системному давлению в артериальном русле;
отношение сосудистого сопротивления малого и большого круге кровообращения;
величина сброса слева направо. В соответствии с этой классификацией больных с ОАП по величине и характеру легочной гипертензии подразделяют на 4 группы (табл.5.4).
В 1988 г. F.Krichenkoи соавт. разработали ангиографическую классификацию протоков соответственно их анатомическому строению.
Тип А — наиболее узкое место протока — его легочная часть, имеется хорошо дифференцированная аортальная ампула.
Тип В — короткий проток наиболее узкий в аортальной части. Относительно расположения легочного конца протоков при типах А и В к трахее в каждой группе выделе-
но три подгруппы: 1-я — легочное отверстие протока расположено правее трахеи; 2-я — посередине трахеальной тени; 3-я — левее трахеи.
Тип С соответствует тубулярно-му строению протока без сужения.
Тип Dхарактеризуется протоком, имеющим множественные сужения.
Тип Е — трудноопределяемая конфигурация удлиненного конического типа со стенозированной частью, находящейся на удалении от предшествующего края трахеи.
Клиническая симптоматика и течение заболевания варьируют в зависимости от степени нарушения гемодинамики. У новорожденных, имеющих проток большого диаметра, с первых дней жизни развивается нарушение кровообращения, возможны повторные пневмонии. Все это утяжеляет течение заболевания и приводит к летальному исходу в течение 1-го года жизни почти в 20 % случаев. У больных, имеющих проток небольшого размера, признаки заболевания развиваются медленнее. Наиболее грозное осложнение, проявляющееся в более старшем возрасте, — легочная гипертензия, которая, по данным R.Zeachmanи соавт. (1971), у 14 % имеет склеротическую природу. Бактериальный эндокардит и энд-артериит встречаются примерно в 5 % случаев [Бухарин В.А., 1975]. Еще более редким осложнением ес-
Таблица 5.4. Классификация ОАП в зависимости от степени ЛГ
|
Группа |
Отношение Spa/Sao, % |
Сброс крови к МОМК, % |
Отношение общелегочного и общесистемного сопротивления, % |
|
IA |
30 |
<30 |
30 |
|
IB |
>30 |
>30 |
30 |
|
II |
70 |
50—60 |
30 |
|
IIIA |
>70 |
>40 |
<60 |
|
IIIB |
<100 |
<40 |
>60 |
|
IV |
100 |
R—L |
100 |
628
тественного течения порока является аневризма протока с последующим его разрывом. M.Falkone и со-авт. (1972) описали всего 60 наблюдений спонтанного разрыва аневризмы протока. Средняя продолжительность жизни больных с ОАП не превышает 25 лет [Abbott M., 1936]. В 1968 г. Campbell сообщил о большей продолжительности жизни у пациентов с ОАП. У 60 % пациентов, доживших до 60 лет, зафиксирован относительно небольшой сброс слева направо, что способствовало небольшому изменению гемодинамики и таким образом не перегружало легочное сосудистое русло. Спонтанное закрытие ОАП возможно крайне редко, в литературе описаны лишь единичные наблюдения [Campbell M., 1955; Mark H., Joung D., 1963].
Жалобы больных (наиболее частые из них быстрая утомляемость, отдышка при нагрузке) при ОАП неспецифичны. Дети нередко отстают в физическом развитии. Кожные покровы бледные, но у детей раннего возраста при крике, на-туживании может появиться цианоз, который отчетливее выражен на нижней половине туловища, особенно на нижних конечностях. Характерно, что цианоз исчезает тотчас после прекращения нагрузки. Нередко можно выявить деформацию грудной клетки в виде «сердечного горба» и усиленную, хорошо видимую на глаз пульсацию грудной клетки в проекции верхушки сердца в пятом — шестом меж-реберье слева от грудины. При пальпации грудной клетки определяется систолодиастолическое или систолическое дрожание в проекции основания сердца. Границы сердца расширены, но их количественная характеристика различна. Специфическую диагностическую информацию дает исследование пульса и АД. В типичных случаях при большом артериовенозном сбросе крови пульс быстрый, высокий.
При измерении АД выявляют большую пульсовую амплитуду за счет снижения диастолического давления, которое может быть снижено до нуля. Этот клинический признак имеет особо важное диагностическое значение при обследовании детей раннего возраста [Чернова М.П., 1969].
При аускультации диагностируют основной клинический диагностический признак порока — грубый, «машинный» систолодиастоличе-ский шум во втором межреберье слева от грудины. Шум хорошо выслушивается в межлопаточном пространстве и на сосудах шеи. Диа-столический компонент лучше прослушивается при форсированной задержке дыхания (проба Вальсаль-вы), однако столь характерный шум определяется при большом артериовенозном сбросе. По мере уменьшения сброса из-за развития легочной гипертензии вначале снижается интенсивность шума; в последующем может выслушиваться лишь короткий систолический шум. У больных с одинаковым давлением в большом и малом круге порок практически «афоничен», однако в этой стадии развития заболевания возникает недостаточность клапанов легочной артерии, которая аус-культативно проявляется специфическим диастолическим шумом Грехема—Стилла. Тоны сердца ясные: диагностическое значение имеет усиление II тона над легочной артерией. В большинстве случаев тон не только усилен, но и расщеплен. Причем второй, легочный его компонент особенно акцентирован. По интенсивности его усиления можно представить степень легочной гипертензии. Иногда над верхушкой сердца аускультиру-ется мезодиастолический шум относительной недостаточности митрального клапана. Иногда он сочетается с III тоном. В типичных случаях на ФКГ над легочной артерией регистрируют ромбовидной фор-
629
мы систол одиастолический шум. Осцилляции шума с возрастающей амплитудой начинаются сразу или с небольшим интервалом после I тона. Ко II тону они достигают максимума, а затем уменьшаются. На верхушке фиксируется систолический шум ромбовидной формы с пиком в середине систолы — шум относительной митральной недостаточности и реже короткий мезо-диастолический шум ромбовидной или веретенообразной формы, средней или малой амплитуды — шум относительного митрального стеноза. При выраженной легочной гипертензии (IIIа группа), но при наличии сброса крови в фазу систолы и диастолы сохраняется оба компонента шума, но меньшей амплитуды. Редко диагностируют систолический тон изгнания и низко-или среднеамплитудный противо-диастолический шум недостаточности клапанов легочной артерии. На ЭКГ специфических изменений нет. Обнаруживаемые изменения отражают тип и величину перегрузки сердца в зависимости от стадии нарушения гемодинамики. Электрическая ось сердца может быть расположена нормально или отклонена влево. При умеренной легочной гипертензии регистрируют гипертрофию обоих желудочков. С уменьшением артериовенозного сброса крови более выражена гипертрофия правого желудочка. При склеротической форме легочной гипертензии фиксируется право-грамма, изолированная гипертрофия правого желудочка. У небольшого числа больных неполная блокада левой ножки пучка Гиса [Keith J., 1958].
У взрослых спектр проявлений порока более разнообразен: от бессимптомного систолодиастоличе-ского шума до выраженной легочной гипертензии, наджелудочковых аритмий и явлений бакэндокардита.
При рентгенологическом исследовании выявляют усиление сосу-
630
дистого рисунка в легких. Интенсивность выраженности его дает качественное представление о величине артериовенозного сброса крови. С развитием рентгеновской техники и внедрением в широкую клиническую практику компьютерной томографии, ЭМРТ, возможностью трехмерной мультипланарной реконструкции изображения появилась возможность визуализировать ход и строение сердца, внутрисер-дечных структур, в том числе расположение, анатомические особенности, внутренний диаметр протока с помощью рентгеновских методов обследования больного.
Катетеризация позволяет выявить ряд диагностических признаков порока. Диагностика порока абсолютна, если во время зондирования удается провести зонд из легочной артерии в нисходящую аорту.
В настоящее время наиболее доступный и безопасный метод диагностики открытого артериального протока — трансторакальная эхо-кардиография, которая в подавляющем числе случаев с высокой степенью достоверности позволяет ставить правильный диагноз. Следует отметить, что визуализация ОАП при трансторакальной ЭхоКГ затруднена из-за анатомического расположения протока. Диагностика основывается на косвенных признаках, таких как расширение ствола легочной артерии и наличие положительного диастолического потока в стволе легочной артерии или в начальном сегменте левой легочной артерии. Последний признак почти со 100 % вероятностью обусловлен наличием ОАП. С развитием медицинской техники и появлением современных методик, компьютерной обработки полученных результатов, применением допплеров-ского эффекта возможности ЭхоКГ многократно умножились. Если раньше визуализировать внутрисер-дечные потоки крови не представ-
лилось возможным, то в настоящее время цветное допплеровское исследование позволяет это сделать. Дальнейшим развитием методик ЭхоКГ явилось внедрение в клиническую практику транспищеводной эхо кардиографии. Допплеровское изображение с цветным потоком демонстрирует мозаичный турбулентный поток между аортой и легочной артерией (ЛА), идентифицируя ОАП. При этом можно измерить внутренний диаметр протока. Мозаичный поток при мультипла-нарной ТПЭхоКГ обнаруживают в области нисходящей аорты, входящий в легочную артерию через проток. Мозаичный поток, представленный ускорением потока крови внутри протока, легко выявляет ТПЭхоКГ в нисходящей аорте. Дальнейшее манипулирование датчиком показывает вхождение потока в легочную артерию через проток. У всех пациентов фиксируют непрерывный высокий поток крови.
Допплеровское отображение с цветным потоком свидетельствует о дискретной, мозаичной высокоскоростной струе, которая идет от бифуркации ствола легочной артерии к средней части ствола ЛА.
ОАП необходимо дифференцировать от таких врожденных пороков сердца, как дефект аортолегочной перегородки, свищи коронарных артерий, синдром Лаубри—Пецци. При дефекте аортолегочной перегородки аускультативно максимум систолодиастолического шума выявляют выше и он смещен к левому краю грудины, в то время как при ОАП максимум шума смещен ко второму межреберью слева по сред-неключичной линии. Свищи коронарных артерий также дают систо-лодиастолический шум, однако шум локализован, как правило, ниже и амплитуда его меньше. При ЭхоКГ левоправый сброс регистрируют в полостях сердца, в то время как при ОАП — на уровне аорты и
легочной артерии. Для синдрома Лаубри— Пецци характерны аортальная недостаточность с соответствующей шумовой симптоматикой, систолический и диастоличе-ский шум, причем диастолический выслушивается во втором межребе-рье справа. Отчетливо слышен второй тон на клапане ЛА. Во всех сомнительных случаях и больным легочной гипертензией показано зондирование полостей сердца, которое дает точную информацию о виде порока.
Консервативное лечение. Терапия индометацином, ингибирующим синтез простагландинов, начатая в первые дни после выявления порока, у новорожденных приводит к уменьшению и даже закрытию протока. При энтеральном применении закрытие происходит в 18—20 % случаев, а при внутривенном введении — в 88—90 % случаев. Индоме-тацин вводят внутривенно из расчета 0,2 мг/кг-сут) в течение 2— 3 дней, не позднее 1-й недели жизни ребенка. Противопоказаниями являются почечная недостаточность, энтероколит, нарушение свертывающей системы крови и би-лирубинемия свыше 0,1 г/л.
Хирургическое лечение порока разработано хорошо. При установлении диагноза ОАП показания к операции абсолютны. Оптимальный возраст для операции 2—5 лет, однако при осложненном течении возраст не является противопоказанием к операции. При легочной ги-пертензии операция показана больным 2—За степени, а при легочной гипертензии 36 степени ранее она считалась противопоказанной. Однако в последнее время это положение пересмотрено. Перевязка протока у таких больных не приводит к выздоровлению, но останавливает дальнейшее развитие склеротических процессов в сосудах легких. ОАП, осложненный бактериальным эндокардитом и эндарте-риитом или сердечной недостаточ-
631
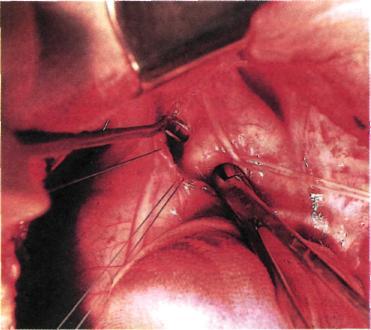
Рис. 5.48. Бранши диссектора подведены под открытый артериальный проток.
ностью, оперируют после соответствующего лечения. Наиболее распространенные доступы — левосторонний переднебоковой, боковой и заднебоковой по третьему или четвертому межреберью, чаще по третьему с резекцией или без резекции ребра. Последнему отдается предпочтение. Проток закрывают, перевязывая его двойной лигатурой либо его пересечением с последующим ушиванием обоих концов. В
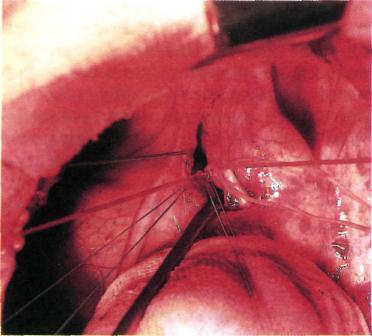
Рис. 5.49. Прошивание протока между лигатурами.
настоящее время большинство хирургов используют метод перевязки протока двойной лигатурой. Этот метод прост, безопасен и дает хорошие результаты.
Техника операции: проводят левостороннюю заднебоковую торакотомию по ходу третьего или четвертого межре-берья. Под медиастинальную плеврувводят 30—40 мл 0,25 % раствора новокаина. Затем рассекают отслоенную раствором медиастинальную плевру вертикальным разрезом, начиная от верхнего края дуги аорты по направлению к корню легкого. Разрез продолжают вверх до устья подключичной артерии. Ориентиром для направления разреза медиастинальной плевры служит промежуток между расположенными на передней поверхности дуги аорты диафрагмальным и блуждающим нервами. На края рассеченной плевры накладывают 2—3 держалки. Левыйn.vagusберут на держалку и мягко отводят в сторону. Ориентируясь по ходу блуждающего нерва, находят место от-хождения от него возвратного нерва (n.laringeusrecurrens). Отделяя кпереди от возвратного нерва жировую клетчатку, подходят к передней поверхности ОАП. Тупым путем выделяют нижний и верхний полюсы протока, при этом возвратный нерв отводят в сторону. Под освобожденный проток подводят диссектор (рис. 5.48). Осторожно раскрывая бранши диссектора, подводят две лавсановые лигатуры № 5. Сначала перевязывают аортальный конец протока, затем легочный, стараясь при этом оставить промежуток между лигатурами. Дополнительно прошивают проток между двумя лигатурами (рис. 5.49). После перевязки пальпаторно проверяют, есть ли дрожание над легочной артерией. При хорошем лигиро-вании дрожание исчезает. Заканчивают операцию установкой дренажа в левой плевральной полости.
Наиболее типичными осложнениями после операции по-прежнему остаются травма возвратного нерва и кровотечение из поврежденных сосудов. Последнее встречается чаще у больных с выраженной легочной гипертензией и перенесших бакэндокардит. В связи с
632
этим операцию дополняют проведением под аортой выше и ниже протока тесемок, которые берут в турникет. Проток выделяют, отводя за тесемки аорту и следя за тем, чтобы не повредить грудной лимфатический проток.
Разработаны новые малотравматичные методы закрытия ОАП. В 1967 г. W.Postman предложил метод внутрисосудистого закрытия ОАП без торакотомии, положив тем самым начало новому направлению в лечении этой врожденной аномалии. Хотя до него уже в 1903 г. G.Golt изобрел первое окклюзиру-ющее устройство для чрескожного закрытия ОАП, сделанное в виде зонтика из скрепленных металлических проволок. В нашей стране этот метод был внедрен проф. Ю.Ф.Некласовым в 1978 г. В 1987 г. W.J.Rashkind и соавт. разработали новый окклюдер «Двойной зонтик», который до сих пор используют для закрытия ОАП и ДМПП в мировой кардиологической практике. Однако этот метод имеет ограничения, касающиеся размера протока. Доставляющее устройство имеет размеры от 12 до 27F. При диаметре протока менее 2,5 мм методика окллюзии по способу Rash-kind должна быть дополнена техникой Benson, предполагающей баллонную ангиопластику для расширения ОАП. К сожалению, некоторые типы протоков не могут быть закрыты по этой методике, особенно реканализированные протоки после хирургической перевязки. Повышается риск разрыва ОАП, особенно если в прошлом был бо-таллит и стенки протока истончены. В 1981 г. В.С.Савельев и соавт. разработали оригинальный метод окклюзии ОАП, осуществляющийся трансвенозным введением в проток специального боталлоокклюде-ра (рис. 5.50) из пористого полиуретана, армированного металлическим каркасом. Он представляет собой коническую полиуретановую

Рис. 5.50. Боталлоокклюдер Прокубов-ского (А) и его укладка (Б).
1 — пробка; 2 — крючок; 3 — втулка; 4 — стилет; 5 — цанга; 6 — гайка; 7 — стилет; 8 — боталлоокклюдер; 9 — кран; а — заход-ный конус крана; б — приемное отверстие крана; в — закрытое положение ручки крана.
пробку, закрепленную на металлическом каркасе из 6—8 пружин, фиксированных во втулке с резьбой. На свободных концах пружин
633
имеются Г-образные крючки. Для доставки боталлоокклюдера применяют систему телескопических катетеров и проводников длиной 2,5—3 м, стилета с цанговым зажимом крана с воронкой. Боталлоок-клюдеры выпускаются 4 диаметров: 8,5; 10,5; 12,5; 14,5 мм. Размеры доставляющих устройств 10F, 12F, 14F, 16F [Савельев B.C., Прокубов-ский В.И., 1994]. В дальнейшем свои устройства предложил E.Side-ris (1993). D.Ridel и соавт. разработали боталлоокклюдеры на основе спирального принципа. При использовании большинства вышеописанных приспособлений для окклюзии ОАП резидуальный сброс крови определялся в 3—38 % случаев [Hijazi Z., Seggei R., 1944]. Размер доставляющих устройств варьировал от 7 до 16F, что делало проблематичным их использование при протоках небольшого диаметра и у маленьких детей. С 1993 г. T.Lloyd и соавт., а затем в 1994 г. J.Moore и соавт. впервые успешно провели транскатетерные окклюзии ОАП спиралями Gianturco. При применении этих устройств внутренний диаметр протока не должен превышать 2,5—2,2 мм и морфологическая конфигурация протока предполагает наличие аортальной ампулы и суженного аортального конца. Диаметр спиралей в 2 раза или более превышал минимальный диаметр протока, а длина была достаточна для образования 3 витков или более.
Разработано несколько методик проведения рентгенэндоваскуляр-ной окклюзии ОАП. Трансартериальная — доставка окклюзирующего устройства происходит через бедренную артерию (чаще правую) и далее через аорту к артериальному концу протока. Трансвенозная, предполагающая доставку окклюде-ра через систему нижней полой вены, правых полостей сердца, легочную артерию к легочному концу артериального протока. Каждая из
методик имеет свои преимущества и специфические для этой методики осложнения. После установки в бедренной артерии интрадьюсера выполняют аортографию в стандартной боковой проекции, при этом катетер Pig tail устанавливают области перешейка аорты, несколько выше уровня отхождения протока. Осуществляют катетеризацию легочной артерии через ОАП с измерением давления в ней. Определяют точные размеры и конфигурацию протока. Спирали доставляют трансартериально. В качестве ориентира служит трахеальная тень. Доставляющее устройство устанавливают в легочной артерии. Спираль продвигается с помощью проводника до выведения из катера 2/3 спирального витка. После этого катетер оттягивают назад до полного выведения витка спирали у легочного отверстия протока. Далее катетер выводят через проток в нисходящую аорту. При этом прото-ковая и аортальная порции выводящейся из катетера спирали выпрямляются. При расстыковке с доставляющим устройством спираль формирует не менее 2 полных витков внутри аортальной ампулы. Доставка считается завершенной, если один полный виток спирали удерживается, примыкая к легочному отверстию ОАП, остальные спиральные витки располагаются в ампуле аорты. Через 10 мин выполняют контрольную аортографию. Для закрытия протока требуется 1, реже 2 спирали. При этой методике нередки случаи, когда при контрольном обследовании определялся резидуальный сброс через проток, а часть спирали располагалась в левой легочной артерии. В этих случаях проводят повторное вмешательство с установкой новой спирали. Наиболее эффективна эта методика при А-типе протока, наименее — при типах Е, D и С по A.Krichenko. При типах В с внутренним диаметром от 4 до 10 мм наиболее пред-
634
почтительна окклюзия артериальными боталлоокклюдерами, разработанными В.С.Савельевым или «пуговичным» устройством Sideris. При протоках цилиндрической формы диаметром более 10 мм и длиной менее 0,8 см для методики рентгенэндоваскулярной окклюзии резко возрастает риск миграции бо-таллоокклюдера в систему легочной артерии с последующей ее эмболией. В связи с этим при типах С, D и Е предпочтение следует отдавать обычному хирургическому вмешательству. При анализе неудач такого рода вмешательств разные авторы отмечают прежде всего миграцию окклюдеров в систему легочной артерии как наиболее грозное осложнение. Чаще, чем при обычной методике, наступает реканали-зация протока. Зафиксировано возникновение тромбозов и стенозов артерий, используемых для доступа к ОАП (от 7 до 24 %, по данным различных авторов), чаще всего это бедренные артерии. При изучении отдаленных результатов установлено, что через 12 мес полиуретано-вая пробка замещается зрелой соединительной тканью, богатой элас-тикой и тесно связанной со стенкой протока. Так, по данным ИССХ им. А.Н.Бакулева, у 292 (94,2 %) из 310 пациентов, у которых был применен боталлоокклю-дер, диагностировано полное разобщение аорты и легочной артерии. В 9 (2,9 %) наблюдениях проток был перекрыт частично, еще у 9 (2,9 %) окклюзия протока не состоялась из-за возникших осложнений — миграции боталлоокклюдера в легочную артерию (3) и аорту (6). Все 6 окклюдеров из аорты были удалены хирургически. Летальных исходов не было. По данным Ч.Е. Маллинза (Техас, США, 1981 г.), полное разобщение протока было лишь в 89 % случаев; успешная имплантация — в 98 % (анализ операций 200 больных). В.И.Прокубовский и соавт. (1994)
также дают сходные цифры возможного использования рентгенэн-доваскулярного метода: в 85— 87 % случаев обнаружен открытый артериальный проток. Анализ осложнений и неудач свидетельствует о том, что наиболее частыми причинами были погрешность в методике проведения окклюзии; технические неисправности в отдельных звеньях окклюзирующего устройства и инструментов имплантации, а также неоправданное расширение показаний к окклюзии ОАП. Осложнения и неудачи обусловлены недостаточным опытом оператора. Тем не менее следует указать на ряд преимуществ: малая травматичность, отсутствие необходимости в интуба-ционном наркозе и торакотомии, которые способствуют все более широкому распространению этого метода в различных клиниках.
В середине 90-х годов появились сообщения об успешном применении видеоэндоскопических технологий в хирургии ОАП. Операцию выполняют в условиях комбинированного наркоза и высокочастотной ИВЛ, под контролем транспищеводной ЭхоКГ. Через 3 прокола: третье межреберье по задней подмышечной линии; четвертое межреберье по средней подмышечной линии и третье межреберье по передней подмышечной линии — вводят торакоскоп, клипатор и инструменты для диссекции ткани, ретрактор для легкого. Впервые успешная операция проведена в институте сердечно-сосудистой хирургии им.А.Н.Бакулева в 1997 г. Две мини-торакотомии выполнены в левом гемитораксе — 5-миллиметровый разрез в шестом межреберном промежутке по средней ак-силлярной линии для последующего дренирования плевральной полости и 5-миллиметровый разрез в третьем межреберье по задней ак-силлярной линии для видеоторако-скопа. 3,5—4,0 см разрез делают через переднюю часть третьего меж-
635
реберного промежутка для манипулирования приборами. Проток перевязывают нитью Ethibon 2—0 с тампонами из тефлона спереди и сзади вокруг протока. Еще 2 лигатуры с тампонами из тефлона добавляют для лигирования возможного остаточного сброса после первой перевязки. После лигирования ОАП легкое раздувают, ставят дренаж в плевральную полость. Послеоперационная летальность 0—3 %. При высокой легочной гипертензии она возрастает до 5—7 % при обычной методике. Отдаленные результаты свидетельствуют о том, что своевременно проведенная операция позволяет добиться полного выздоровления. При высокой легочной гипертензии выздоровления, как правило, не наступает, но улучшение гемодинамических показателей подтверждает эффективность операции.
Литература
Архангельская И. В., Шаповалова В.Я. К вопросу о гипертонии малого круга кровообращения//Грудная хир. — 1966. — № 3. - С. 16-22.
Бухарин В.А., Люде М.Н., Пронина МЛ., Чуева Л. Ф. Лечение открытого артериального протока, осложненного бактериальным эндокардитом и эндартериитом// Грудная хир. - 1975. - № 3. - С. 22-27.
Anderson R.C. Causative factors underling congenital heart malformations; patenr duc-tuc arteriosus. — Pediatrics, 1954.
Christie A. Normal closing time of the foramen ovale and ductus arteriosus: an anatomic and statistical study//Am.J.Dis.Child. — 1930. - 40, 3231930.
Campbell M. The natural histori of persistent ductus arteriosus//Br.Heart J. — 1968, 30, 4.
Edwards et al. Congenital Heart diasease. — Philadelphia. — London, 1965.
Gasul B. et al. Heart disease in children. — Philadelphia, 1966.
