
- •5.3.4. Естественное течение
- •5.3.5. Кардиальные проявления синдрома Марфана (клиника, диагностика и хирургическое лечение)
- •5.3.5.2. Аневризма восходящей аорты
- •5.3.6. Общие вопросы хирургии аневризм восходящей аорты
- •5.3.6.1. Открытая техника формирования дистального анастомоза
- •5.3.7. Частные вопросы хирургии аневризм восходящей аорты
- •5.3.7.1. Имплантация клапансодержащего кондуита
- •5.3.7.2. Клапансохраняющие операции
- •5.3.7.3. Протезирование дуги аорты
- •5.3.8. Осложнения
- •5.3.9. Результаты операций
- •5.3.10. Синдром Марфана у детей
- •5.3.11. Особенности кардиологического мониторинга у пациентов с синдромом Марфана
- •5.4. Врожденные деформации дуги аорты
- •5.5. Коарктация аорты
- •5.6. Открытый артериальный проток
- •5.7. Аневризмы грудного отдела аорты
- •5.7.1. Аневризмы грудной аорты
- •5.7.2. Отдельные нозологические формы, вызывающие развитие аневризм грудной аорты
5.3.6.1. Открытая техника формирования дистального анастомоза
При стандартной методике формирования дистального анастомоза, когда аорту пережимают проксима-льнее брахиоцефального ствола и все манипуляции осуществляют в непосредственной близости от аортального зажима, не всегда существуют оптимальные условия для работы в этой области. В ряде ситуаций, а именно при очень больших размерах аневризмы, большом количестве тромбов в ложном просвете аорты или распространении аневризмы на область дуги аорты, наложение зажима на восходящую аорту в типичном месте (прокси-мальнее уровня отхождения брахиоцефального ствола) может быть опасным или технически сложным. С учетом указанных причин может быть использована «открытая» техника формирования дистального анастомоза в условиях гипотер-мической остановки кровообращения и защиты головного мозга (ГМ).
В этом случае для подключения ИК производят канюляцию общей бедренной артерии. С целью медикаментозной протекции центральной нервной системы после начала ИК и охлаждения пациента рекомендуют вводить метилпредни-
569
золон (7 мг/кг) и тиопентал (7— 15 мг/кг). Перед остановкой кровообращения для профилактики дисфункции почек применяют ман-нитол (0,3—0,4 г/кг) и фуросемид (100 мг). Уровень гликемии поддерживают инсулином ниже 10 ммоль/л. На этом этапе целесообразен мониторинг электроэнцефалограммы.
Во время охлаждения и остановки кровообращения осуществляют защиту миокарда и, если удается пережать аорту, выполняют основные манипуляции в проксимальной части восходящей аорты. Как только температура в носоглотке достигнет 12—14 °С или в прямой кишке 18—20 °С, а на электроэнцефалограмме появится изолиния на протяжении не менее 5 мин, кровообращение прекращают.
Важным моментом при остановке кровообращения является защита ГМ от ишемического повреждения. На сегодняшний день в клинике используют 3 основных метода защиты ГМ, среди которых:
общая глубокая гипотермия в чистом виде;
общая глубокая гипотермия в сочетании с антеградной перфузией ГМ (АПГМ);
общая глубокая гипотермия в сочетании с ретроградной перфузией ГМ (РПГМ).
Преимущества и недостатки каждого из методов представлены в табл. 5.3.
Глубокая гипотермия в «чистом виде». C.Barnard и V.Schrire в 1963 г. и H.Borst и соавт. в 1964 г. впервые сообщили о спорадическом использовании глубокой гипотермии при необходимости остановки кровообращения для вмешательств на дуге аорты, однако лишь после более поздних работ R.Griepp и соавт., D.Ott и соавт. и E.Crawford метод привлек внимание многих кардиохирургов и получил широкое распространение в клинике.
Метод гипотермической остановки кровообращения основан на том факте, что мозговой метаболизм уменьшается до 23 % от уровня нормотермии при 20 °С и до 17 % при 15 °С. Это предопределяет безопасные периоды остановки кровообращения у животных по крайней мере до 30 мин при 20 °С и увеличение этого интервала до 1 ч и более при более глубокой гипотермии. Степень уменьшения метаболических потребностей мозга при предельно низкой температуре сглаживается.
В отличие от исследований, проводимых на животных, допустимый период остановки кровообращения у пациентов оценить труднее. L.Svensson и соавт. проводили мультивариантный анализ факторов риска повреждения мозга на самом большом количестве пациентов, перенесших операцию на дуге аорты в условиях глубокой гипотермии. Они выяснили, что частота неврологических осложнений составляет 4,0; 7,5 и 10,7 % за периоды ишемии 30; 45 и 60 мин соответственно. Другие исследователи отметили подобное незначительное увеличение частоты осложнений при сравнении остановки кровообращения на 45 и 60 мин при 18 °С. Степень повреждения мозга относительно времени остановки кровообращения также изучалась в клинике M.Ergin и соавт., которые отметили временную дисфункцию при остановке кровообращения на время от 40 до 50 мин, в то время как стойкие повреждения ГМ могли бы развиться после более длительных периодов.
L.Edmunds рекомендует следующую схему ведения больных при использовании общей глубокой гипотермии без дополнительной перфузии ГМ. После остановки кровообращения пациента укладывают в положение Тренделенбурга (головой вниз), затягивают турникет над верхней полой веной и пережимают
570
Таблица 5.3. Сравнительная характеристика методов защиты головного мозга при остановке кровообращения
|
Преимущества |
Глубокая общая гипотермия |
Гипотермия + АПГМ |
Гипотермия + РПГМ |
|
Теоретические (экспериментальные) | |||
|
|
1. Физиологическое направ ление кровотока. 2. Высокая объемная ско рость истинно мозгового кровотока, а следователь но, и более эффективный транспорт. 3. Поддержание равномер ного охлаждения и посто янства температурного ре жима головного мозга в пе риод гипотермии. |
1. Поддержание относи тельного постоянства ох лаждения головного моз га в период гипотермии. 2. Вымывание потенциаль ных материальных и воз душных эмболов из ма гистральных сосудов го ловы, что проявляется в малой вероятности развития эмболических осложнений со стороны головного мозга. | |
|
Клинические | |||
|
1. Самый простой способ защиты мозга, не требующий дополнительных мероприятий. |
1. Возможность продолжи тельной безопасной оста новки кровообращения на период до 2—2,5 ч. 2. Отсутствие необходимо сти в глубокой гипотермии. |
1. Простота метода (подоб но изолированной гипо термии); практически не требуются дополнитель ные действия со стороны хирурга. 2. Пролонгирование безо пасного периода оста новки кровообращения по сравнению с изолиро ванной гипотермией. | |
|
Недостатки |
Теоретические (экспериментальные) | ||
|
|
|
1. Нефизиологическое на правление кровотока. 2. Высокообъемная РПГМ (> 600 мл/мин) способст вует отеку головного мозга. | |
|
Клинические | |||
|
1. Необходимость охлаж дения до низких темпе ратур: 11—15°С. 2. Строгий лимит времени, связанный с аноксией ГМ и соответствующий глубине гипотермии (обычно до 30—50 мин). 3. Относительно высокая частота неврологиче ских осложнений. |
1. Относительно высокая ча стота неврологических осложнений после опера ций с АПГМ (по материа лам разных авторов 2— 10 %, в среднем — 5— 7 %). 2. Техническая сложность методики, требующая под готовки и дополнительного времени проведения. |
1. Временной лимит, свя занный с гипоксией ГМ и соответствующий глуби не гипотермии (обычно до 50—60 мин). 2. Необходимость охлаж дения до низких темпе ратур: 11—15°С. | |
канюлю верхней полой вены. Увеличивающееся при этом центральное венозное давление препятствует подсасыванию воздуха в систему плечеголовных сосудов во время манипуляций на аорте. Затем вскрывают просвет аорты и формируют дистальный анастомоз. По за-
вершении этого этапа в верхнюю полую вену с помощью аппарата ИК нагнетают охлажденную кровь. При этом скорость потока составляет около 300—500 мл/мин, а ЦВД — 20—30 мм рт.ст. Описанный маневр необходим для удаления воздуха и тканевых частиц из
571
брахиоцефальных артерий. Одновременно переставляют артериальную канюлю из бедренной артерии в подшитый аортальный протез проксимальнее линии дистального анастомоза. Затем начинают медленную антеградную перфузию. Для эвакуации воздуха и других потенциальных эмболов полезен аккуратный массаж плечеголовных сосудов. После наложения на протез зажима проксимальнее места канюляции объемную скорость перфузии доводят до расчетных величин. Восстановление антеградно-го кровотока уменьшает риск эмболии сосудистой системы головы, поскольку тромбы могут вымыться в нисходящую аорту. В последующем больного согревают и выполняют имплантацию клапансодержа-щего кондуита, который анастомо-зируют с аортальным сосудистым протезом проксимальнее аортального зажима. После окончательного согревания ИК прекращают.
В ситуациях, когда аорта была пережата на этапе охлаждения и все манипуляции в проксимальном отделе были выполнены до остановки кровообращения, по завершении дистального анастомоза больному придают положение Тренделенбур-га, канюлируют специальной иглой или дренажем сосудистый протез и медленно возобновляют перфузию, отсасывая воздух из аорты через указанный дренаж.
Таким образом, глубокая гипотермия в чистом виде является простым методом защиты ГМ при необходимости остановки кровообращения, однако возможности этого метода ограничены временными рамками. Так, по данным J.McCul-lough и соавт., безопасный период для изолированной гипотермиче-ской остановки кровообращения гораздо менее продолжителен, чем это считалось ранее, и составляет при температуре 15 °С около 30 мин. В связи с этим при необходимости остановки кровообраще-
ния на сроки более 30 мин целесообразно сочетание глубокой гипотермии с селективной перфузией сосудов ГМ.
Необходимо отметить, что вышеупомянутые значения безопасной остановки кровообращения при глубокой гипотермии не могут точно отражать допустимое время ишемии ГМ в индивидуальных случаях, потому что другие важные факторы, включающие возраст, наличие до операции поражений сосудов ГМ, материальную и воздушную эмболию, вносят значительный вклад в риск поражения мозга. В связи с этим всем пациентам, у которых не исключается возможность остановки кровообращения для вмешательств на дуге аорты, необходимо проводить неврологическое исследование, включающее, по мнению H.Borst, полное клиническое обследование, электроэнцефалографию, магнитно-резонансную томографию ГМ, а также доп-плеровское исследование каротид-ных артерий. У пациентов с поражением мозговых сосудов в анамнезе обязательно выполняют артериальную ангиографию.
Селективная мозговая перфузия. Учитывая накопленный опыт ряда авторов по использованию селективной перфузии ГМ, все большее число кардиохирургов предпочитают применять этот метод вместо простого прерывания мозгового кровотока. Метод селективной перфузии ГМ хорошо показал себя в экспериментах на животных. Например, L.Fox и соавт. сохраняли жизнеспособность мозга обезьян в течение 2 ч, перфузируя голову потоком крови в объеме 500 мл/мин при 20 °С. K.Miyamoto и соавт., изучая мозговой метаболизм у собак при такой же температуре, доказали, что для сохранения мозга достаточен поток 30 мл/кг. По мнению C.Mezrow, перфузия с низким потоком специфически предотвращает патологически увеличенное
572
мозговое сосудистое сопротивление и понижает уязвимость мозга в первые 8 ч после ишемии, которая отмечается при остановке кровообращения.
В клинических условиях селективная антеградная перфузия ГМ через безымянную и левую сонную артерии достигается или через отвод от артериальной линии с использованием Y-образной канюли, или одним либо парой дополнительных насосов, в линию которых может быть включен теплообменник. Некоторые авторы высказываются за перфузию только безымянной артерии, если дооперационные исследования показали адекватность артериального круга мозга. Рекомендуемая величина мозгового кровотока колеблется от 250 до 1000 мл/мин, при этом давление в правой лучевой или височных артериях должно оставаться в пределах от 50 до 70 мм рт.ст. Следует отметить, что потоки от 700 до 1000 мл/мин у взрослых соответствуют требованиям мозга при нор-мотермии и могут быть чрезмерными или даже опасными при гипотермии.
H.Borst рекомендует закрывать левую подключичную артерию и проксимальную нисходящую аорту соответственно катетером Фогарти и специальным катетером с раздуваемым баллончиком на конце (Ва-kelite Company, Tokyo, Japan). Профилактику воздушной эмболии перед восстановлением ИК осуществляют по одной из описанных выше методик.
В качестве альтернативы непрерывной мозговой перфузии в условиях гипотермии J.Bachet и соавт. предлагали использовать прерывистую холодную мозговую перфузию, однако метод не получил признания.
Более простым и перспективным методом защиты ГМ является ретроградная перфузия ГМ (РПГМ), которая впервые была описана
Y.Ueda и соавт. и проводится через канюлю верхней полой вены при пережатой зажимом канюле нижней полой вены в условиях гипо-термической остановки кровообращения.
В настоящее время нет единой концепции оптимальных условий техники РПГМ, поскольку клинические результаты и данные многочисленных экспериментов весьма противоречивы. Не существует также единого подхода к расположению катетера для мониторинга пер-фузионного давления во время РПГМ, так как возможны варианты измерения давления в верхней полой вене, во внутренней или наружной яремных венах. Цифры перфузионного давления в зависимости от положения катетера у одного и того же пациента при неизменных условиях перфузии могут существенно различаться. Поскольку качество защиты ГМ зависит от адекватности его перфузии, информация о реальном уровне перфузионного давления приобретает особое значение.
В соответствии с экспериментальными работами на животных, посвященными этой проблеме, оптимальным показателем считается перфузионное давление, измеренное в «бесклапанных» отделах венозной системы головы и шеи (наружная или внутренняя яремная вена, сагиттальный синус), при этом уровень давления не должен быть менее 20 и более 30 мм рт.ст. Чрезмерно высокое или низкое давление ухудшает протективные свойства РПГМ. Для поддержания давления в указанных пределах объемная скорость РПГМ не должна превышать 500 мл/мин.
В техническом аспекте РПГМ предусматривает необходимость несложной модификации экстракорпорального контура введением дополнительного шунта, соединяющего артериальную магистраль с венозной (рис. 5.24). На этапе ИК
573
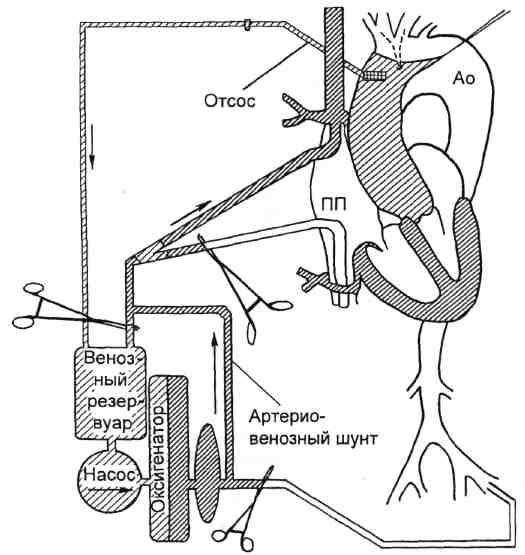
шунт находится в пассивном (пережатом) состоянии. После остановки ИК снимают зажим с шунта и пережимают артериальную и венозную магистрали таким образом, чтобы кровь, нагнетаемая насосом, попадала через венозную магистраль в верхнюю полую вену.
Наиболее вероятными протек-тивными свойствами РПГМ можно считать следующие:
препятствие согреванию головного мозга после остановки кровообращения (поддержание относительного постоянства гипотермии мозга);
вымывание потенциальных материальных и воздушных эмболов из магистральных сосудов головы;
транспортная функция в мозговой ткани (доставка кислорода и субстратов, а также удаление углекислоты и продуктов метаболизма).
Казалось бы, наличие более физиологичных и эффективных методик защиты головного мозга, осно-
ванных на антеградной перфузии, должно оттеснить РПГМ на второй план. Однако камнем преткновения для них становятся техническая сложность, большая продолжительность подготовки, а также риск сопутствующих этим методикам тяжелых осложнений, главным образом эмболического характера.
РПГМ впервые в России была внедрена в 1994 г. в НИИТ и ИО, к концу 2000 г. использована у 20 пациентов в возрасте от 16 до 65 лет, без них у 17 — с целью оптимизации условий для формирования ди-стального анастомоза при протезировании расслоенной восходящей аорты или вмешательствах на дуге аорты.
РПГМ проводили по описанной выше низкопоточной методике через канюлю верхней полой вены в условиях глубокой гипотермии (11,6—18,0 °С) со средней продолжительностью 55 мин (24—74 мин). У всех пациентов на этапе РПГМ
574
использовали наружное охлаждение головы.
В первые сутки после операции умер 60-летний пациент, которому по экстренным показаниям на фоне тяжелого исходного состояния были выполнены операция Бенталла—Де Боно и шунтирование правой коронарной артерии сосудистым протезом. Операция была технически сложной и травматичной с четьгрехчасовым ИК. Причиной смерти явилась острая сердечная недостаточность.
В остальных наблюдениях неврологический дефицит после операции не отмечен. Больные приходили в сознание на операционном столе или в ближайшие часы после операции, что позволяло проводить экстубацию трахеи в течение первых суток.
5.3.6.2. Открытая и закрытая техника в хирургии восходящей аорты и ее дуги
Улучшение хирургической техники и появление эластичных сосудистых протезов, непроницаемых для крови, позволяют имплантировать сосудистый протез или кондуит без создания вокруг него дополнительного каркаса из собственных тканей организма (открытая методика). Альтернативой является закрытая методика, при которой для дополнительной профилактики кровотечения протез имплантируют внутрь патологически измененного участка аорты. После завершения всех анастомозов над протезом сшивают остатки аневризматиче-ского мешка, в результате чего протез оказывается плотно окутанным стенкой аорты.
По мнению L.Edmunds, более предпочтительной является открытая техника, при которой все аортальные и коронарные анастомозы с протезом осуществляют через всю толщу стенки аорты. Анализ результатов операций с использованием
закрытой техники позволяет сделать вывод о том, что частота псевдоаневризм по линиям аортальных и коронарных анастомозов после таких операций существенно выше. Постоянное сообщение между парапротезным пространством и просветом сосуда вызывает натяжение линий швов. Нередко эти швы расходятся, что приводит к образованию псевдоаневризм и компрессии аортального протеза. При использовании открытой техники частота развития псевдоаневризм и соответственно необходимость повторных операций существенно ниже.
