
- •3.10.3.7. Неврологические осложнения
- •3.10.3.8. Острая почечная недостаточность
- •3.10.4. Особенности ведения больных при различных оперативных вмешательствах
- •3.10.4.1. Операции по поводу аневризм восходящего, грудного и торакоабдоминалъного отделов аорты
- •3.10.4.2. Операции при коарктации аорты
- •3.10.4.3. Каротидная эндартерэктомия
- •3.10.4.4. Операции по поводу ишемической болезни сердца
- •3.10.4.5. Реконструктивные операции на почечных артериях
- •3.10.4.6. Операции на брюшном отделе аорты и аортобедренное шунтирование
- •3.10.4.7. Операции реваскуляризации артерий нижних конечностей
- •3.11. Диспансеризация больных с сосудистыми заболеваниями в условиях поликлиники
- •3.11.1. Физиотерапевтическое лечение
- •3.11.2. Хроническая венозная недостаточность нижних конечностей
- •3.11.3. Лимфедема
- •Глава 4
- •4.1. Транслюминальная баллонная ангиопластика
- •4.2.1. Имплантация кава-фильтров
- •4.2.2. Транскатетерная тромбоэмболэктомия
- •4.2.3. Лечение обструкций полых и других крупных вен
- •4.2.4. Баллонная ангиопластика и стентирование обструкций при артериовенозных фистулах у пациентов, находящихся на гемодиализе
- •Глава 5
- •5.1.1. Стабильная стенокардия напряжения
- •5.1.2. Нестабильная стенокардия
- •5.2. Аортокоронарное шунтирование
- •5.2.1. Техника аортокоронарного шунтирования с искусственным кровообращением
- •5.2.2. Техника маммарокоронарного шунтирования в условиях искусственного кровообращения
- •5.2.3. Операции прямой реваскуляризации миокарда на работающем сердце без искусственного кровообращения — малоинвазивная коронарная хирургия
- •5.2.4. Трансмиокардиалышя реваскуляризация миокарда
- •5.3. Синдром Марфана
- •5.3.1. Этиология (генетические предпосылки развития синдрома Марфана)
- •5.3.2. Патогенез и патоморфология
- •5.3.3. Диагностические критерии
- •Диагностические критерии синдрома Марфана
- •Диагностические критерии синдрома Марфана
- •Диагностический указатель
- •Костно-суставная система
- •Орган зрения
- •Сердечно-сосудистая система
- •Респираторная система
- •Кожа и наружные покровы
- •Твердая мозговая оболочка (dura mater)
- •Семейный/Генетический анамнез
5.2.1. Техника аортокоронарного шунтирования с искусственным кровообращением
Первоначальный этап операции АКШ — выполнение стернотомии, которая является стандартным доступом ко всем отделам сердца (рис. 5.1). После выполнения доступа и продольного вскрытия перикарда производят канюляцию аорты в ее восходящей части и раздельную канюляцию верхней и нижней полых вен. Ряд кардиохирургов предпочитают использовать одну венозную канюлю, которую вводят в правое предсердие. Затем подключают искусственное кровообращение, пережимают аорту ниже аортальной канюли, выполняют фармакохолодовую защиту миокарда и добиваются общей гипотермии до 28—30 °С с гемодилю-цией до 24 %. Некоторые авторы предпочитают использовать ретроградное введение кардиоплегиче-ского раствора через коронарный синус. В настоящее время отдают предпочтение использованию кровяной кардиоплегии, что позволяет значительно уменьшить риск отека миокарда. Как правило, помимо холодного кардиоплегического рас-
532
твора, применяют наружное охлаждение сердца ледяной «кашей» (замороженный изотонический раствор натрия хлорида). Такая методика позволяет накладывать диста-льные анастомозы на остановленном сердце и сухом операционном поле.
Одновременно осуществляют забор и подготовку аутовенозных трансплантатов. Оптимальность методики забора, обработки и подготовки аутовенозных трансплантатов заключается в предотвращении факторов, способствующих нарушению целости их интимы. Даже незначительное повреждение целости внутрених структур аутовены в виде слущивания клеток эндотелия может явиться причиной пристеночного тромбоза с последующей окклюзией шунта. Как правило, забор трансплантата всегда сопровождается спазмом вены, просвет которой резко уменьшается, кровоток по ней прекращается, а после извлечения вены из раны отмечается сокращение ее длины на 15— 20 %. При этом для дальнейшего использования спазмированной вены необходимо восстановить ее просвет и проверить герметичность, для чего применяют гидравлическую обработку с давлением 300 мм рт.ст.
Чтобы предотвратить выраженный спазм аутовенозного трансплантата и избежать повреждения его интимального слоя, рекомендуется использовать футлярную пери-вазальную обработку вены in situ раствором папаверина, а также его внутрипросветное введение в дис-тальный конец пересеченной вены. Метод гидравлической препаровки способствует четкому контурирова-нию вены, облегчает ее выделение из подкожной клетчатки и обнаружение боковых ветвей, что в конечном итоге уменьшает риск механической травматизации вены, исключает ее спазм и сокращение по длине.
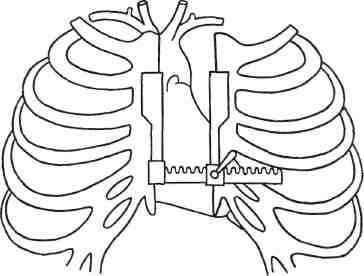
Рис. 5.1. Срединная стернотомия.
Оптимальным соотношением
диаметров просвета вены и коронарной артерии следует считать 1,26:1, что позволяет добиться высокой линейной скорости кровотока по шунту.
Важным моментом при наложении дистального анастомоза с коронарной артерией являются правильная экспозиция сердца и выбор участка коронарной артерии для наложения анастомоза. В настоящее время используют непрерывный обвивной шов, что сокращает время наложения анастомоза и обеспечивает его герметичность.
После выполнения дистальных анастомозов поперечный зажим с аорты снимают и восстанавливают естественный кровоток по коронарным артериям. На пристеночно отжатой аорте выполняют проксимальные анастомозы, важным условием надежного функционирования которых является адекватность их расположения на аорте. При ре-васкуляризации системы ЛКА анастомоз должен располагаться на левой, а при реваскуляризации системы ПКА — на правой боковой поверхности восходящей части аорты (рис. 5.2). По завершении основного этапа операции, восстановлении сердечной деятельности производят остановку АИК, удаляют артериальные и венозные канюли.
533
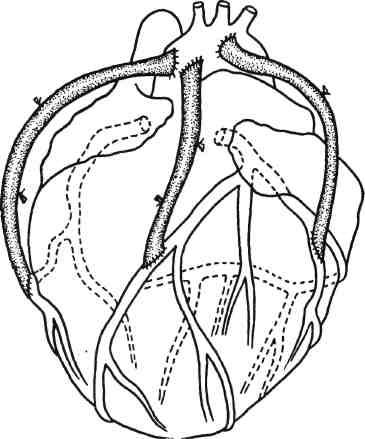
Рис. 5.2. Множественное аутовенозное аортокоронарное шунтирование.
