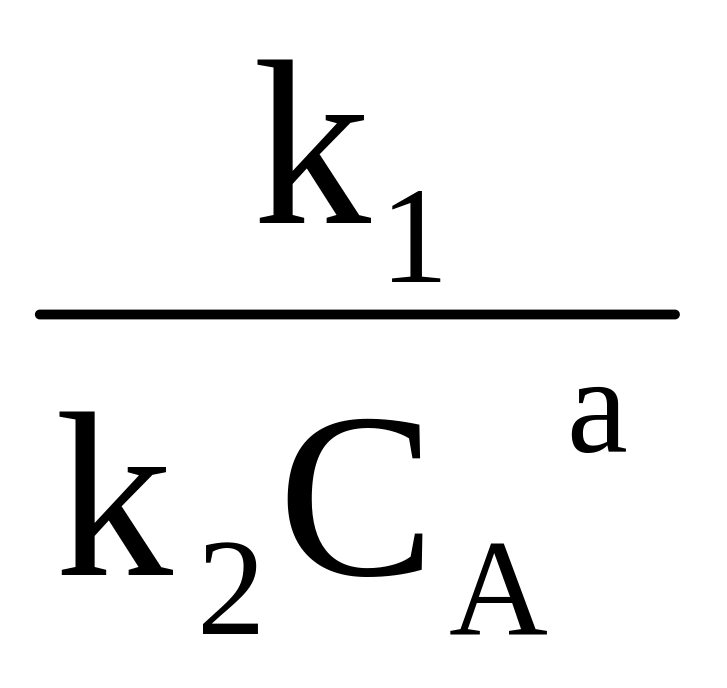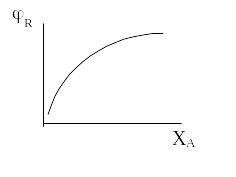- •С.В. Іванов, п.С. Борсук, н.М. Манчук загальна хімічна технологія
- •Передмова
- •Теоретичні основи хімічної технології вступ
- •1. Основи хіміко-технологічних процесів
- •1.1 Хіміко-технологічний процес і його зміст
- •1.2. Класифікація хімічних реакцій, які покладені в основу промислових хіміко-технологічних процесів.
- •1.3. Технологічні критерії ефективності хіміко-технологічного процесу
- •2. Структура хімічного виробництва
- •3. Хіміко-технологічні системи
- •3.1. Поняття хіміко-технологічної системи (хтс)
- •3.2. Моделі хіміко-технологічних систем
- •3.3. Технологічні зв'язки в хтс
- •4. Поняття про синтез хіміко-
- •4.1. Texнологічні концепції створення хтс
- •4.2. Аналіз хтс
- •5. Матеріальні і теплові баланси хіміко-технологічних систем
- •5.1. Баланс співвідношень
- •5.1.2. Приклади розрахунку балансів
- •5.2 Основні поняття ексергетичного аналізу хтс
- •6. Термодинамічні розрахунки хіміко-технологічних процесів
- •6.1. Рівновага хімічних реакцій
- •6.2. Константа рівноваги й енергія Гіббса. Рівняння ізотерми Вант-Гоффа
- •6.3. Хімічна рівновага в гетерогенних реакціях
- •7. Вибір технологічних режимів проведення хтп
- •7.1. Способи зміщення рівноваги
- •7.2. Залежність константи рівноваги від температури
- •7.3. Розрахунок рівноваги за термодинамічними даними
- •8. Використання законів хімічної кінетики при виборі технологічного режиму.
- •8. 1. Швидкість гомогенних хімічних реакцій
- •8.2. Залежність швидкості хімічних реакцій від концентрації реагентів; кінетичні рівняння
- •8.3. Способи зміни швидкості простих і складних реакцій
- •9. Кінетика хіміко-технологічних процесів
- •9.1. Вплив різних чинників на швидкість хімічних процесів, які перебігають на мікрорівні
- •9.2. Кінетика хтп, що ґрунтується на оборотних хтп
- •9.3 Швидкість хтп, що ґрунтується на паралельних та послідовних гомогенних реакціях
- •9.3.2. Вплив технологічних параметрів на швидкість гомогенних процесів
- •9.3.3. Методи інтенсифікації гомогенних процесів
- •9.4. Кінетика гетерогенних некаталітичних процесів
- •9.4.2. Швидкість гетерогенних процесів
- •9.4.4. Визначення лімітуючої стадії гетерогенного процесу
- •9.4.5. Способи збільшення швидкості процесу
- •9.5 Типи реакторів для гетерогенних процесів
- •9.5.1 Реактори для проведення реакцій в системах г-т і р-т
- •9.5.2 Реактори для проведення реакцій в системах г—р і р—р
- •10. Каталітичні процеси.
- •10.2. Технологічні характеристики каталізаторів
- •10.3. Гомогенний і гетерогенний каталіз
- •10.4. Властивості твердих каталізаторів і їхнє виготовлення
- •10.5. Апаратурне оформлення каталітичних процесів
- •10.5.3 Апарати зі зваженим (киплячим, псевдокиплячим) шаром каталізатора
- •11. Хімічні реактори
- •11.1 Класифікація реакторів
- •11.2. Вимоги до хімічних реакторів
- •11.3. Структура математичної моделі хімічного реактора
- •10.4. Реактор ідеального змішування періодичний
- •11.5 Реактори безперервної дії
- •11.5.1 Реактор ідеального витіснення (рів)
- •11.5.2. Реактор ідеального змішування безперервний (різ–б)
- •11.5.3 Загальне проектне рівняння реактора
- •11.6 Каскад реакторів ідеального змішання (к-різ)
- •11.7 Графічний метод розрахунку к – різ
- •11.8. Вплив кінетики на вибір типу реактора
- •11.9. Селективність, вихід, ступінь перетворення
- •11.9.2. Залежність селективності від ступеня перетворення
- •11.10. Хімічні реактори з неідеальною структурою потоків
- •11.11. Моделі ректорів з неідеальною структурою потоку
- •11.12. Ячеїста модель.
11.9. Селективність, вихід, ступінь перетворення
Припустимо, що в результаті складного хімічного перетворення утворюється кілька продуктів – цільовий і небажаний (побічний):
аАrR
аАsS
Під селективністю (φ) розуміється відношення цільового продукту R, отриманого в результаті реакції, до кількості перетвореної вихідної речовини А:
![]() ,
,
де NR і NA – кількість молів речовини R і А.
Значення селективності змінюється від 0 до 1.
Вихід визначається як відношення кількості отриманого цільового продукту R до кількості вихідної речовини, завантаженої в реактор
![]() .
.
Вихід може мінятися від 0 до 1.
Ступінь
перетворення
![]() .
.
Одержуємо залежність Ф = φ х .
Повна чи інтегральна селективність φ – це відношення кількості вихідного реагенту, що витрачається на цільову реакцію, до загальної кількості вихідного реагенту, що перетворився в результаті реакції.
Миттєва
чи диференціальна селективність -
відношення швидкості перетворення
вихідних реагентів у цільовий продукт
до сумарної швидкості витрати вихідних
реагентів:![]() .
.
11.9.1. Вплив температури на селективність. Вплив температури на селективність пов'язаний з типом моделі реактора. Так реактори змішування працюють в ізотермічному режимі, а реактори витіснення мають або адіабатичний режим, або політермічний.
Вплив температури виражається рівнянням Арреніуса:
 ,
,
де k0 – передекспоненційний множник;
Е1, Е2 – енергії активації основної і побічної реакції.
Вплив температури на селективність залежить від співвідношення енергій активації паралельних реакцій. Якщо енергія активації основної реакції вище Е1 > Е2 , то при низьких температурах швидкість побічної реакції вище, ніж основної. Тому при низькій температурі селективність мала. Підвищення температури призводить до зростання швидкості і збільшення селективності. Якщо ж Е1 < Е2 , то підвищення температури недоцільне.
У залежності від співвідношення Е1 і Е2 вплив температури на селективність різний. Змінити це співвідношення можна проведенням процесу в присутності селективного каталізатора, що буде знижувати енергію активації цільової реакції і підвищувати вихід за низької температури.
Для РІЗ – Б величини Х, ФR і φ у всьому об’ємі сталі і тому зв'язок між цими параметрами можна виразити рівнянням:
Ф = φ х
Для
РІВ ці ж величини міняються по довжині
реактора, тому для нього застосовують
вираз:
![]()
Графічне зображення цих рівнянь дозволяє установити тип реактора, що забезпечує максимальний вихід цільового продукту.
Для
паралельних реакцій:
![]() ,
,
![]() .
.
Селективність можна виразити рівнянням:
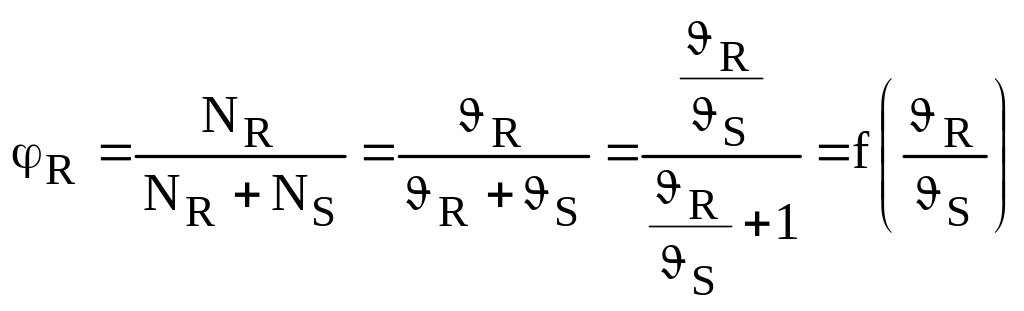 ,
,
тобто селективність є функцією відношення R/ s .
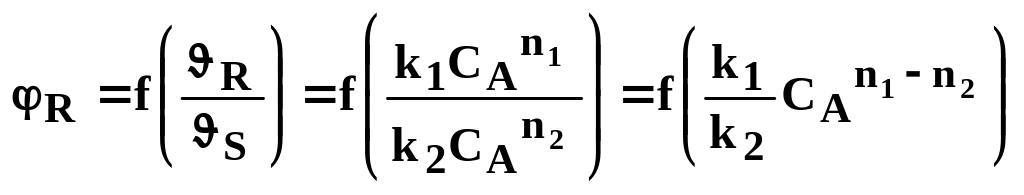
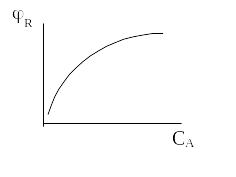
З рівняння випливає, що при сталій температурі в кожному конкретному випадку, коли відомий порядок основної і побічної реакції, селективність залежить тільки від концентрації СA, тому що відношення констант швидкості реакції k1/k2 у цих умовах стале. Тому в залежності від різниці n1 – n2 вплив СA на φR може бути або позитивним, або негативним.
Якщо порядок основної реакції вище порядку побічної реакції, тобто n1 > n2 , отже n1 – n2 = а.
![]()
Тобто при збільшенні концентрації вихідної речовини С А селективність зростає. Отже, для досягнення високої селективності вигідно підтримувати високу концентрацію вихідної речовини, тобто вигідно застосовувати РІВ чи РІЗ–К, тому що в цих реакторах середня концентрація реагенту СА вище, ніж у РІЗ – Б.
Якщо порядок основної реакції нижче порядку побічної реакції, тобто n1 < n2 , отже n1 – n2 = -а, то аналогічно одержимо:
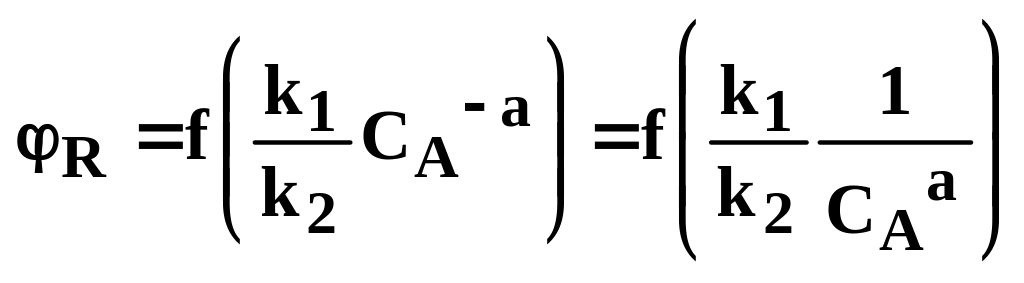
З цього рівняння видно, що при збільшенні СА селективність знижується. При цьому вигідно застосовувати РІЗ – Б, тому що концентрація вихідної речовини в ньому нижче, ніж у РІВ. У даному випадку зміна величини СА здійснює на ці параметри (інтенсивність реактора і селективність процесу). протилежну дію. При зниженні СА інтенсивність зменшується, а селективність зростає. Що краще – можна вирішити техніко – економічним аналізом.
Якщо n1 = n2 , то n1 – n2 = 0
![]() ,
,
тобто селективність не залежить від концентрації вихідного реагенту і тип реактора не впливає на селективність. У цьому випадку змінюють температуру чи застосову ють каталізатор селективної дії, який може змінити співвідношення k1/k2.
Таблиця 11.2
Селективність різних реакцій
n1 і n2 |
R/ S |
φR=f(CA) |
ΦR =f(XA) |
Тип реак тора, що рекомен- дується |
n1 > n2 n1 - n2 = a |
|
|
|
РІВ |
n1 < n2 n1 - n2 = - a |
|
|
|
РІЗ - Б |
n1 = n2 n1 - n2 = 0 |
|
Не залежить від СA і ХA |
Любий |
|
Послідовні реакції
Розглянемо послідовну реакцію:
![]()
Обмежимося випадком реакцій першого порядку, що перебігають без зміни об’єму. Кінетичні рівняння будуть мати вигляд:
![]()
![]()
![]()
Перше рівняння описує швидкість витрати речовини А, друге - результуючу швидкість накопичення продукту R. Якщо цільовий продукт – R, то співвідношення швидкостей утворення R і S буде дорівнювати:
![]() .
.
Рівняння показує, що селективність буде тим більше, чим вище концентрація вихідного реагенту і співвідношення k1/k2 .