
- •С.В. Іванов, п.С. Борсук, н.М. Манчук загальна хімічна технологія
- •Передмова
- •Теоретичні основи хімічної технології вступ
- •1. Основи хіміко-технологічних процесів
- •1.1 Хіміко-технологічний процес і його зміст
- •1.2. Класифікація хімічних реакцій, які покладені в основу промислових хіміко-технологічних процесів.
- •1.3. Технологічні критерії ефективності хіміко-технологічного процесу
- •2. Структура хімічного виробництва
- •3. Хіміко-технологічні системи
- •3.1. Поняття хіміко-технологічної системи (хтс)
- •3.2. Моделі хіміко-технологічних систем
- •3.3. Технологічні зв'язки в хтс
- •4. Поняття про синтез хіміко-
- •4.1. Texнологічні концепції створення хтс
- •4.2. Аналіз хтс
- •5. Матеріальні і теплові баланси хіміко-технологічних систем
- •5.1. Баланс співвідношень
- •5.1.2. Приклади розрахунку балансів
- •5.2 Основні поняття ексергетичного аналізу хтс
- •6. Термодинамічні розрахунки хіміко-технологічних процесів
- •6.1. Рівновага хімічних реакцій
- •6.2. Константа рівноваги й енергія Гіббса. Рівняння ізотерми Вант-Гоффа
- •6.3. Хімічна рівновага в гетерогенних реакціях
- •7. Вибір технологічних режимів проведення хтп
- •7.1. Способи зміщення рівноваги
- •7.2. Залежність константи рівноваги від температури
- •7.3. Розрахунок рівноваги за термодинамічними даними
- •8. Використання законів хімічної кінетики при виборі технологічного режиму.
- •8. 1. Швидкість гомогенних хімічних реакцій
- •8.2. Залежність швидкості хімічних реакцій від концентрації реагентів; кінетичні рівняння
- •8.3. Способи зміни швидкості простих і складних реакцій
- •9. Кінетика хіміко-технологічних процесів
- •9.1. Вплив різних чинників на швидкість хімічних процесів, які перебігають на мікрорівні
- •9.2. Кінетика хтп, що ґрунтується на оборотних хтп
- •9.3 Швидкість хтп, що ґрунтується на паралельних та послідовних гомогенних реакціях
- •9.3.2. Вплив технологічних параметрів на швидкість гомогенних процесів
- •9.3.3. Методи інтенсифікації гомогенних процесів
- •9.4. Кінетика гетерогенних некаталітичних процесів
- •9.4.2. Швидкість гетерогенних процесів
- •9.4.4. Визначення лімітуючої стадії гетерогенного процесу
- •9.4.5. Способи збільшення швидкості процесу
- •9.5 Типи реакторів для гетерогенних процесів
- •9.5.1 Реактори для проведення реакцій в системах г-т і р-т
- •9.5.2 Реактори для проведення реакцій в системах г—р і р—р
- •10. Каталітичні процеси.
- •10.2. Технологічні характеристики каталізаторів
- •10.3. Гомогенний і гетерогенний каталіз
- •10.4. Властивості твердих каталізаторів і їхнє виготовлення
- •10.5. Апаратурне оформлення каталітичних процесів
- •10.5.3 Апарати зі зваженим (киплячим, псевдокиплячим) шаром каталізатора
- •11. Хімічні реактори
- •11.1 Класифікація реакторів
- •11.2. Вимоги до хімічних реакторів
- •11.3. Структура математичної моделі хімічного реактора
- •10.4. Реактор ідеального змішування періодичний
- •11.5 Реактори безперервної дії
- •11.5.1 Реактор ідеального витіснення (рів)
- •11.5.2. Реактор ідеального змішування безперервний (різ–б)
- •11.5.3 Загальне проектне рівняння реактора
- •11.6 Каскад реакторів ідеального змішання (к-різ)
- •11.7 Графічний метод розрахунку к – різ
- •11.8. Вплив кінетики на вибір типу реактора
- •11.9. Селективність, вихід, ступінь перетворення
- •11.9.2. Залежність селективності від ступеня перетворення
- •11.10. Хімічні реактори з неідеальною структурою потоків
- •11.11. Моделі ректорів з неідеальною структурою потоку
- •11.12. Ячеїста модель.
6.3. Хімічна рівновага в гетерогенних реакціях
У хімічних гетерогенних системах, як й у гомогенних, умовою хімічної рівноваги є дотримання за постійних температур й тиску рівностей:
dG=0;
![]() =0 (6.24)
=0 (6.24)
Нехай, наприклад, у реакції компонент В перебуває у твердому або рідкому стані, інші речовини - гази. Тоді:
rμR+sμS-aμA-bμ΄B=0 ,
де μ΄B- на відміну від μR, μS, μA при даній температурі стала величина, тому що є хімічним потенціалом насиченої пари компонента В.
Константу рівноваги реакції можна виразити через відношення парціальних тисків:
Кp=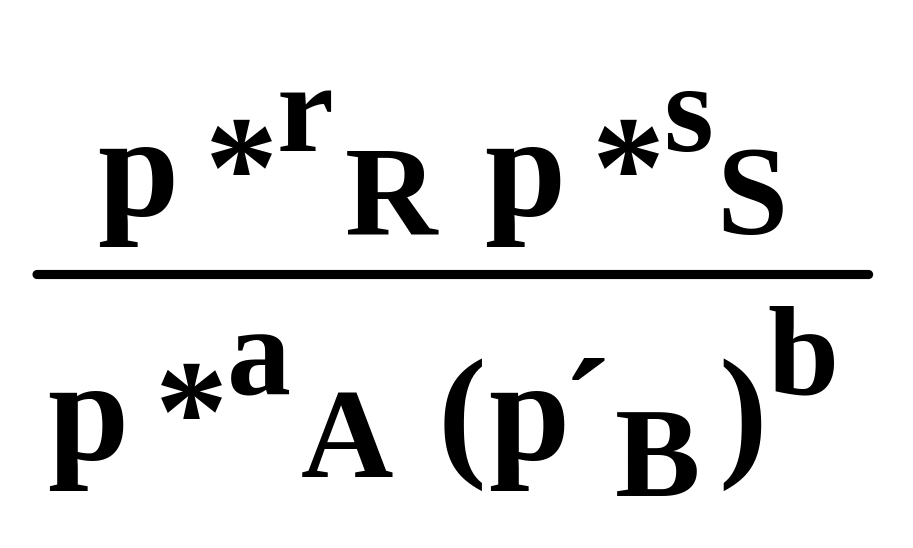 (6.25)
(6.25)
де Р΄в- тиск насиченої пари компонента В, що є сталою величиною.
Якщо ввести нову сталу величину К΄р = Кр(р΄в)в, одержимо вираз для константи рівноваги гетерогенної реакції:
K΄p=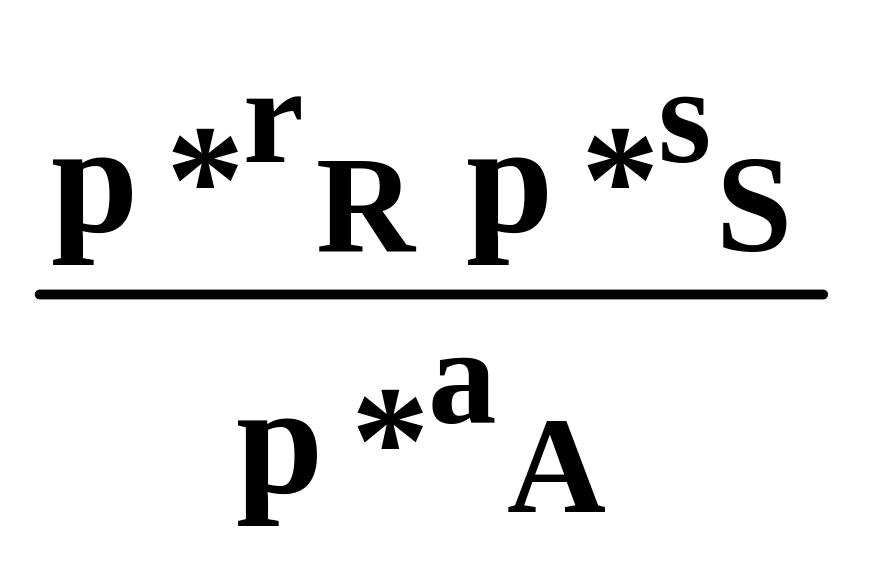 (6.26)
(6.26)
Так,
наприклад, для реакції:FeO(т)+H2(г)=Fe(т)+H2O(г),
константа рівноваги буде дорівнювати
K΄p=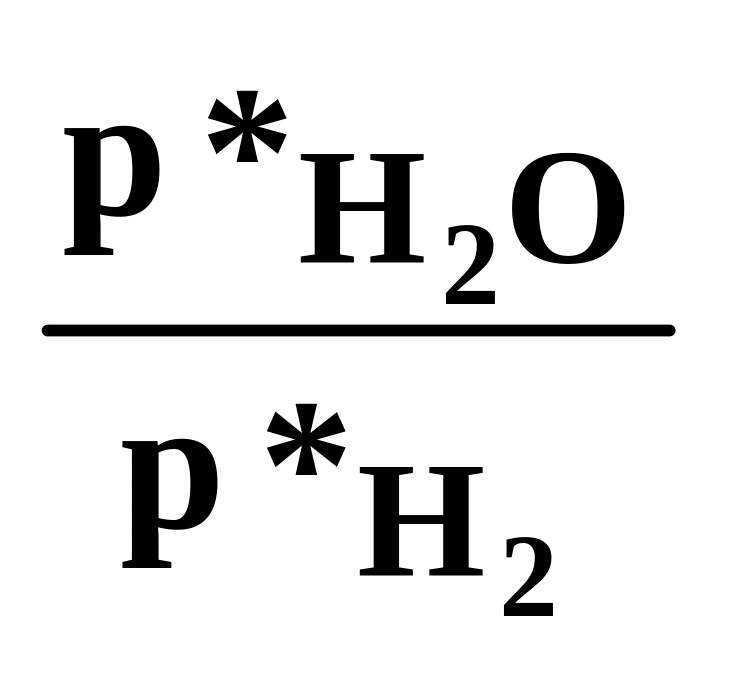 , (6.27)
тобто рівновага досягається при певному
(сталому за даної температури) відношенні
парціальних тисків водяної пари й водню
незалежно від відносних й абсолютних
кількостей оксиду заліза й заліза, тому
що в цій реакції тільки один газоподібний
учасник
, (6.27)
тобто рівновага досягається при певному
(сталому за даної температури) відношенні
парціальних тисків водяної пари й водню
незалежно від відносних й абсолютних
кількостей оксиду заліза й заліза, тому
що в цій реакції тільки один газоподібний
учасник
Для реакції випалення вапняку:
CaCO3(т)
![]() CaO(т)+CO2(г) (6.28)
CaO(т)+CO2(г) (6.28)
рівноважний тиск РСО2 повинний бути для кожної температури величиною сталою, незалежно ні від кількості карбонату кальцію, ні від кількості оксиду кальцію. Він сильно зростає з підвищенням температури й називається тиском дисоціації.
7. Вибір технологічних режимів проведення хтп
7.1. Способи зміщення рівноваги
Положення рівноваги завжди залежить від зовнішніх умов, а тому що зовнішні умови не можуть зберігатися незмінними, то рівновага рано або пізно порушується (зміщається). Вплив зміни зовнішніх умов на положення рівноваги - принцип зміщення рівноваги, який називається у літературі принципом Ле Шательє, можна сформулювати в такий спосіб:
якщо на систему, що перебуває в стійкій рівновазі, впливати ззовні, змінюючи яку-небудь з умов, що визначають положення рівноваги, то в системі підсилиться той напрямок процесу, перебіг якого послабляє вплив зробленого впливу, і положення рівноваги зміститься в тім же напрямку.
Розглянемо реакцію:
aA+bB=rR+sS (7.1)
де реагенти (А, В) і продукти реакції (R,S) - ідеальні гази. При рівновазі справедлива рівність:
ln
=![]() (7.2)
(7.2)
Якщо під зовнішнім впливом зміниться значення одного зі членів рівності ΔG0 /(RT) або prR,e psS,e / (paA,epвВ,e) , то вона порушиться й система вийде зі стану рівноваги. У результаті система буде прагнути до досягнення нового стану рівноваги, який буде характеризуватися новими значеннями рівноважних парціальних тисків реагентів і продуктів.
Так як рівновага характеризується рівністю швидкостей прямої і зворотної реакцій, можна сказати, що зміщення рівноваги відбувається в тому випадку, коли зроблений вплив неоднаково впливає на швидкості прямого й зворотного процесів. Це порушення рівності швидкостей і приводить до переходу системи в новий стан рівноваги, при якому швидкості прямої й зворотної реакцій знову стануть рівними, але будуть відрізнятися від первісних значень.
Вплив тиску. .Характер впливу тиску на рівновагу хімічних реакцій визначається знаком різниці числа молей газоподібних учасників реакції Δn або знаком зміни об'єму ΔV.
Для газових реакцій, у яких число молів продуктів перевищує число молів реагентів, тобто Δn> 0, збільшення тиску небажане. Зміщенню рівноваги реакції праворуч сприяє зниження тиску. Якщо ж реакція перебігає зі зменшенням числа молей (Δn< 0), підвищення тиску доцільно - воно зміщає рівновагу реакції убік утворення продуктів.
Чутливість положення рівноваги до змін тиску чим більше, ніж більшою зміною об'єму ΔV (або Δn) супроводжується той або інший процес. Значні зміни об'єму можуть відбуватися тільки в реакціях, у яких беруть участь гази, або в тих випадках, коли хоча б один з компонентів перебуває в газоподібному стані. Кількісна оцінка впливу тиску на стан рівноваги визначається рівнянням (6.9).
Вплив інертного газу. Введення інертного газу в систему при р= соnst. подібно ефекту зменшення загального тиску. Якщо реакція перебігає зі зменшенням числа молей (Δn < 0), розведення інертним газом зміщує рівновагу реакції у бік вихідних реагентів; при збільшенні числа молей (Δn > 0) рівновага зміщається праворуч. Тому в технологічних процесах, супроводжуваних хімічними реакціями, для яких Δn < 0, прагнуть до зменшення нагромадження інертних газів у системі. Так, якщо в азотоводневоаміачній суміші, взятій за р= 100 МПа, утримувалося б 10% інертного газу, те це рівнозначно зниженню тиску на 25 МПа. З метою підтримки високих виходів аміаку в системі регулярно проводяться „ продування” і додавання свіжого газу. Висновки про вплив інертного газу безпосередньо випливають і з закону Дальтона:
pJ=NJp, (7.3)
з якого видно, що ефект розведення (зменшення NJ) подібний до ефекту зменшення загального тиску р у системі.
Вплив концентрації. Відповідно до принципу Ле Шательє введення в рівноважну систему додаткових кількостей якої-небудь речовини викликає зміщення рівноваги в тім напрямку, при якому концентрація цієї речовини зменшується. Тому введення надлишку вихідних речовин зміщає рівновагу праворуч; введення надлишку продукту викличе зміщення рівноваги ліворуч. Так, надлишок кисню збільшує рівноважний ступінь перетворення SO2 в SO3.
Збільшуючи концентрацію одного з реагентів (створюючи його надлишок), можна підвищити ступінь перетворення іншого. Цим широко користуються в хімічній технології, домагаючись повного перетворення дорогого компонента сировини. У багатьох випадках зміщення рівноваги процесу праворуч можна здійснити й відводом продуктів з реакційної зони - зменшенням концентрації продукту. Так, введення в систему водовіднімаючих засобів (наприклад, H2SO4) дозволяє змістити рівновага реакції етерифікації праворуч:
СН3ОН
+СН3СООН![]() СН3СООСН3+Н2О (7.4)
СН3СООСН3+Н2О (7.4)
Вплив температури. Напрямок зміщення рівноваги за зміни температури залежить від знака теплового ефекту реакції. Підвищення температури завжди допомагає нагромадженню речовин, які утворюються в даній реакції з поглинанням теплоти, тобто підсилює ендотермічний напрямок процесу. Зниження температури діє в протилежну сторону, тобто підсилює екзотермічний напрямок.
За зміни температури процесу рівновага зміщається в напрямку, для якого зміна ентропії має той же знак, що і зміна температури. Наприклад, для розглянутої вище реакції синтезу аміаку ΔS<0, отже, підвищення температури підсилить реакцію дисоціації аміаку, а зниження температури буде сприяти перебігу реакції синтезу зліва праворуч. Облік знака теплового ефекту реакції (ΔН < 0) приводить до того ж висновку: підвищення температури зміщує рівновагу у бік вихідних реагентів (підсилює ендотермічний напрямок реакції), зниження температури діє в протилежному напрямку.
Слід відзначити, що при зміні температури рівновага зміщається тим сильніше, чим більшим тепловим ефектом супроводжується та або інша хімічна реакція.
Отже, застосовуючи принцип Ле Шательє, можна, не роблячи термодинамічних розрахунків, передбачити напрямок хімічних реакцій, тобто якісно судити про стан їхньої рівноваги.
