
- •С.В. Іванов, п.С. Борсук, н.М. Манчук загальна хімічна технологія
- •Передмова
- •Теоретичні основи хімічної технології вступ
- •1. Основи хіміко-технологічних процесів
- •1.1 Хіміко-технологічний процес і його зміст
- •1.2. Класифікація хімічних реакцій, які покладені в основу промислових хіміко-технологічних процесів.
- •1.3. Технологічні критерії ефективності хіміко-технологічного процесу
- •2. Структура хімічного виробництва
- •3. Хіміко-технологічні системи
- •3.1. Поняття хіміко-технологічної системи (хтс)
- •3.2. Моделі хіміко-технологічних систем
- •3.3. Технологічні зв'язки в хтс
- •4. Поняття про синтез хіміко-
- •4.1. Texнологічні концепції створення хтс
- •4.2. Аналіз хтс
- •5. Матеріальні і теплові баланси хіміко-технологічних систем
- •5.1. Баланс співвідношень
- •5.1.2. Приклади розрахунку балансів
- •5.2 Основні поняття ексергетичного аналізу хтс
- •6. Термодинамічні розрахунки хіміко-технологічних процесів
- •6.1. Рівновага хімічних реакцій
- •6.2. Константа рівноваги й енергія Гіббса. Рівняння ізотерми Вант-Гоффа
- •6.3. Хімічна рівновага в гетерогенних реакціях
- •7. Вибір технологічних режимів проведення хтп
- •7.1. Способи зміщення рівноваги
- •7.2. Залежність константи рівноваги від температури
- •7.3. Розрахунок рівноваги за термодинамічними даними
- •8. Використання законів хімічної кінетики при виборі технологічного режиму.
- •8. 1. Швидкість гомогенних хімічних реакцій
- •8.2. Залежність швидкості хімічних реакцій від концентрації реагентів; кінетичні рівняння
- •8.3. Способи зміни швидкості простих і складних реакцій
- •9. Кінетика хіміко-технологічних процесів
- •9.1. Вплив різних чинників на швидкість хімічних процесів, які перебігають на мікрорівні
- •9.2. Кінетика хтп, що ґрунтується на оборотних хтп
- •9.3 Швидкість хтп, що ґрунтується на паралельних та послідовних гомогенних реакціях
- •9.3.2. Вплив технологічних параметрів на швидкість гомогенних процесів
- •9.3.3. Методи інтенсифікації гомогенних процесів
- •9.4. Кінетика гетерогенних некаталітичних процесів
- •9.4.2. Швидкість гетерогенних процесів
- •9.4.4. Визначення лімітуючої стадії гетерогенного процесу
- •9.4.5. Способи збільшення швидкості процесу
- •9.5 Типи реакторів для гетерогенних процесів
- •9.5.1 Реактори для проведення реакцій в системах г-т і р-т
- •9.5.2 Реактори для проведення реакцій в системах г—р і р—р
- •10. Каталітичні процеси.
- •10.2. Технологічні характеристики каталізаторів
- •10.3. Гомогенний і гетерогенний каталіз
- •10.4. Властивості твердих каталізаторів і їхнє виготовлення
- •10.5. Апаратурне оформлення каталітичних процесів
- •10.5.3 Апарати зі зваженим (киплячим, псевдокиплячим) шаром каталізатора
- •11. Хімічні реактори
- •11.1 Класифікація реакторів
- •11.2. Вимоги до хімічних реакторів
- •11.3. Структура математичної моделі хімічного реактора
- •10.4. Реактор ідеального змішування періодичний
- •11.5 Реактори безперервної дії
- •11.5.1 Реактор ідеального витіснення (рів)
- •11.5.2. Реактор ідеального змішування безперервний (різ–б)
- •11.5.3 Загальне проектне рівняння реактора
- •11.6 Каскад реакторів ідеального змішання (к-різ)
- •11.7 Графічний метод розрахунку к – різ
- •11.8. Вплив кінетики на вибір типу реактора
- •11.9. Селективність, вихід, ступінь перетворення
- •11.9.2. Залежність селективності від ступеня перетворення
- •11.10. Хімічні реактори з неідеальною структурою потоків
- •11.11. Моделі ректорів з неідеальною структурою потоку
- •11.12. Ячеїста модель.
9.4. Кінетика гетерогенних некаталітичних процесів
9.4.1. Гетерогенні процеси. Більшість хіміко-технологічних процесів відносяться до гетерогенних; при цьому величезна різноманітність гетерогенних процесів утрудняє їх класифікацію. Механізм гетерогенних процесів складніше за гомогенних, оскільки реагуючі речовини знаходяться в різних фазах і підведення їх до поверхні поділення фаз, де відбувається хімічна взаємодія, а також масообмін між фазами здійснюються в результаті молекулярної і конвективної дифузії, які накладаються на основний хімічний процес. Ускладнення вносять також процеси теплообміну і процеси, обумовлені особливостями гідродинаміки потоку. Тільки з урахуванням всіх чинників, що впливають на технологічний процес, можна встановити умови, що забезпечують максимальну його інтенсивність, і управляти цим процесом. Прикладом гетерогенного процесу може служити процес горіння вугілля, який складається з п'яти стадій (рис. 9. 13):
зовнішня дифузія О2 (через прикордонний газовий шар);
внутрішня дифузія О2 (через шар золи);
хімічна реакція;
внутрішня дифузія СО2 (через шар золи);
зовнішня дифузія СО2 (через прикордонний шар газу).
Горіння вугілля порівняно простий приклад; на практиці звичайно перебігають складніші процеси. Проте в будь-якому гетерогенному хімічному процесі можна виділити три основних одночасно перебігаючих процеси: 1. дифузія реагентів до межі розділення фаз; 2. хімічна реакція; 3. дифузія продуктів реакції із зони реакції.
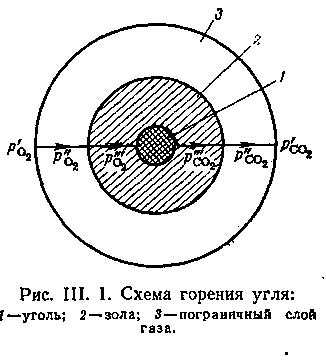
Рис. 9.13. Схема горіння вугілля: 1-вугілля; 2-зола; 3-при-кордонний шар газу
9.4.2. Швидкість гетерогенних процесів
Для встановлення оптимальних параметрів гетерогенних процесів і їх апаратурного оформлення і проектування необхідно перш за все вивчити статику (тобто рівновага) і кінетику (тобто швидкість) цих процесів.
Рівновага в гетерогенних системах залежить від темпера-тури, тиску і концентрації як вихідних реагентів, так і продуктів реакції, швидкість же взаємодії реагентів, що перебувають в різних фазах, залежить не тільки від швидкості хімічної реакції, але і від багатьох інших чинників (як будь-який процес, що перебігає на макрорівні). Тому в загальному вигляді швидкість гетерогенного процесу виражається наступним рівнянням:
=KFΔC, (9.33)
де — швидкість гетерогенного процесу; K— коефіцієнт швидкості процесу; F — поверхня контакту фаз; ΔС — рушійна сила процесу.
Розглянемо вплив різних чинників на кожний з параметрів, що входять в рівняння (8.33), а також способи збільшення загальної швидкості процесу.
9.4.3. Коефіцієнт швидкості процесу. Коефіцієнт включає багато чинників, що впливають на швидкість гетерогенного процесу. У більшості практичних випадків вплив цих факторів неоднаковий. Так, наприклад, хімічний процес звичайно складається з декількох стадій, а його загальна швидкість визначається швидкістю найбільш повільної (лімітуючої) стадії. Тому для інтенсифікації процесу необхідно перш за все визначити, яка з стадій являється найбільш повільною, і прискорити її. Такими найбільш повільними стадіями, кожна з яких може гальмувати весь процес, являються:
1. хімічна реакція;
2. дифузія;
3. одночасно хімічна реакція і дифузія.
У першому випадку, швидкість дифузії велика в порівнянні зі швидкістю хімічної реакції; тоді говорять, що процес перебігає в кінетичній області.
У другому випадку, швидкість хімічної реакції значно більше швидкості дифузії — процес перебігає в дифузійній області (у внутрішній - або внутрішньодифузійній).
У третьому випадку, швидкості окремих стадій зрівнянні, тоді говорять, що процес перебігає в перехідній (змішаній) області.
Після встановлення лімітуючої стадії процесу приймають міри, що забезпечують підвищення швидкості цієї стадії. Так, якщо процес перебігає в кінетичній області, створюють умови, які прискорюють хімічну реакцію; якщо процес перебігає в дифузійній області, то прискорюють процес дифузії; якщо ж процес перебігає в перехідній області, то створюють умови, що підвищують і швидкість хімічної реакції, і швидкість дифузії. Для встановлення лімітуючої стадії процесу існує декілька прийомів. Розглянемо найбільш важливі з них.
Раніше було показано, що температура робить сильний вплив на швидкість хімічних реакцій. Так при збільшенні температури на 10 К швидкість хімічної реакції в деяких випадках зростає в 2—4 рази.
Швидкість дифузії газів залежить від температури в значно в меншому ступені, приблизно ця залежність виражається рівнянням (другий закон Фіка):
D=aT2, (9.34)
де D—коефіцієнт дифузії; а—сталий коефіцієнт.
З рівняння (9.34) слідує, що за підвищення температури на 10 К швидкості дифузії збільшується всього на 3—5%. Цей різний вплив температури використовують для визначення лімітуючої стадії процесу.

Рис. 9.14. Залежність швидкості дифузії, хімічної реакції і загальної швидкості процесу від температури: 1 — швидкість дифузії; 2—швидкість хімічної реакції; 3—загальна швидкість процесу теоретична; 4 — загальна швидкість процесу, яка встановлена експериментально
На рис. 9.14 крива 1 відображає температурну залежність швидкості дифузії вихідного реагенту в зону реакції [ ф=f(Т)] відповідно до рівняння (9.34).
Крива 2 відображає функціональну залежність швидкості хімічної реакції від температури [ х.р.=φ(Т)] відповідно до рівняння Арреніуса. Загальна швидкість відбита на рисунку двома відрізками кривих 3 і 3'.
Крива 3 бере свій початок за температури Тп, коли процес хімічної взаємодії розпочинає перебігати з помітною швидкістю. Потім спостерігається різкий підйом кривої (рис. 9.14).
У
точці А, де перетинаються криві 1 і 2,
швидкість хімічної реакції і швидкість
дифузії рівні
Ф=
х.р.=
.
Надалі величина
рівна
Ф.
Загальна швидкість процесу не може
перевищувати найнижчу складову її
швидкість
ф≥![]() ≤
х.р.
≤
х.р.
Крива 4 побудована за дослідними даними.
У загальному випадку, коли перебігає не одна, а декілька реакцій, залежність коефіцієнта швидкості процесу виражається складнішими рівняннями; у загальному вигляді цю залежність можна виразити так:
для кінетичної області:
Ккін=f(к1, к2, kпоб) (9.35)
де к1,к2, кпоб— константи швидкостей прямої, зворотної і побічних реакцій,
для дифузійної області:
Кдиф=φ(D1, D2,….D1*, D2*,...) (9.36)
де D1, D2—коефіцієнти дифузії вихідних газових речовин в зону реакції;
D1*, D2* — коефіцієнти дифузії продуктів реакції з зони реакції;
для перехідної області:
Kпер = ф(k1, K2, Kпоб, D1., D2,..., D1*, D*2,...) (9.37)
З приведених даних видно, що коефіцієнт швидкості процесу К залежить від багатьох показників, тому способи його зростання встановлюють з урахуванням особливостей кожного хіміко-технологічного процесу.
