
- •С.В. Іванов, п.С. Борсук, н.М. Манчук загальна хімічна технологія
- •Передмова
- •Теоретичні основи хімічної технології вступ
- •1. Основи хіміко-технологічних процесів
- •1.1 Хіміко-технологічний процес і його зміст
- •1.2. Класифікація хімічних реакцій, які покладені в основу промислових хіміко-технологічних процесів.
- •1.3. Технологічні критерії ефективності хіміко-технологічного процесу
- •2. Структура хімічного виробництва
- •3. Хіміко-технологічні системи
- •3.1. Поняття хіміко-технологічної системи (хтс)
- •3.2. Моделі хіміко-технологічних систем
- •3.3. Технологічні зв'язки в хтс
- •4. Поняття про синтез хіміко-
- •4.1. Texнологічні концепції створення хтс
- •4.2. Аналіз хтс
- •5. Матеріальні і теплові баланси хіміко-технологічних систем
- •5.1. Баланс співвідношень
- •5.1.2. Приклади розрахунку балансів
- •5.2 Основні поняття ексергетичного аналізу хтс
- •6. Термодинамічні розрахунки хіміко-технологічних процесів
- •6.1. Рівновага хімічних реакцій
- •6.2. Константа рівноваги й енергія Гіббса. Рівняння ізотерми Вант-Гоффа
- •6.3. Хімічна рівновага в гетерогенних реакціях
- •7. Вибір технологічних режимів проведення хтп
- •7.1. Способи зміщення рівноваги
- •7.2. Залежність константи рівноваги від температури
- •7.3. Розрахунок рівноваги за термодинамічними даними
- •8. Використання законів хімічної кінетики при виборі технологічного режиму.
- •8. 1. Швидкість гомогенних хімічних реакцій
- •8.2. Залежність швидкості хімічних реакцій від концентрації реагентів; кінетичні рівняння
- •8.3. Способи зміни швидкості простих і складних реакцій
- •9. Кінетика хіміко-технологічних процесів
- •9.1. Вплив різних чинників на швидкість хімічних процесів, які перебігають на мікрорівні
- •9.2. Кінетика хтп, що ґрунтується на оборотних хтп
- •9.3 Швидкість хтп, що ґрунтується на паралельних та послідовних гомогенних реакціях
- •9.3.2. Вплив технологічних параметрів на швидкість гомогенних процесів
- •9.3.3. Методи інтенсифікації гомогенних процесів
- •9.4. Кінетика гетерогенних некаталітичних процесів
- •9.4.2. Швидкість гетерогенних процесів
- •9.4.4. Визначення лімітуючої стадії гетерогенного процесу
- •9.4.5. Способи збільшення швидкості процесу
- •9.5 Типи реакторів для гетерогенних процесів
- •9.5.1 Реактори для проведення реакцій в системах г-т і р-т
- •9.5.2 Реактори для проведення реакцій в системах г—р і р—р
- •10. Каталітичні процеси.
- •10.2. Технологічні характеристики каталізаторів
- •10.3. Гомогенний і гетерогенний каталіз
- •10.4. Властивості твердих каталізаторів і їхнє виготовлення
- •10.5. Апаратурне оформлення каталітичних процесів
- •10.5.3 Апарати зі зваженим (киплячим, псевдокиплячим) шаром каталізатора
- •11. Хімічні реактори
- •11.1 Класифікація реакторів
- •11.2. Вимоги до хімічних реакторів
- •11.3. Структура математичної моделі хімічного реактора
- •10.4. Реактор ідеального змішування періодичний
- •11.5 Реактори безперервної дії
- •11.5.1 Реактор ідеального витіснення (рів)
- •11.5.2. Реактор ідеального змішування безперервний (різ–б)
- •11.5.3 Загальне проектне рівняння реактора
- •11.6 Каскад реакторів ідеального змішання (к-різ)
- •11.7 Графічний метод розрахунку к – різ
- •11.8. Вплив кінетики на вибір типу реактора
- •11.9. Селективність, вихід, ступінь перетворення
- •11.9.2. Залежність селективності від ступеня перетворення
- •11.10. Хімічні реактори з неідеальною структурою потоків
- •11.11. Моделі ректорів з неідеальною структурою потоку
- •11.12. Ячеїста модель.
6. Термодинамічні розрахунки хіміко-технологічних процесів
При проектуванні технологічних процесів дуже важливі термодинамічні розрахунки хімічних реакцій. Вони дозволяють зробити висновок про принципову можливість даного хімічного перетворення, попередньо вибрати умови проведення процесу, визначити рівноважний склад продуктів, розрахувати теоретично досяжні ступені перетворення вихідних речовин і виходи продуктів, а також енергетичні ефекти (теплота реакції, теплота зміни агрегатного стану й т. ін.), що необхідно для складання енергетичних балансів і визначення енергетичних витрат.
У самому широкому змісті термодинаміка - це наука про перетворення енергії. Поняття «енергія» невід'ємно від руху матерії. Рух пов'язаний з матерією, будучи формою її існування, a енергія є міра руху матерії. Факт взаємного перетворення різних форм руху матерії при збереженні кількості цього руху є змістом закону збереження й перетворення енергії, названого абсолютним законом природи.
Найбільш важливі поняття термодинаміки - «теплота процесу» й «робота». Перетворення теплоти в роботу або роботи в теплоту здійснюється звичайно в термодинамічному процесі за допомогою робочого тіла. Термодинамічна система називається однорідною, якщо у всіх частинах системи властивості однакові. Сукупність фізичних властивостей робочого тіла (або термодинамічної системи) у розглянутих умовах називається станом тіла (або системи). Величини, що характеризують стан термодинамічної системи, називають термодинамічними параметрами. До них відносять температуру, тиск, питомий об'єм, густину, молярний об'єм, питому внутрішню енергію й ін.
Термодинамічні параметри ділять на екстенсивні й інтенсивні.
Величини, що пропорційні масі (або кількості речовини) розглянутого робочого тіла або термодинамічної системи, називаються екстенсивними; це - об'єм, внутрішня енергія, энтальпія, ентропія й т. ін. Екстенсивні параметри мають властивість адитивності.
Інтенсивні величини не залежать від маси термодинамічної системи, і тільки вони служать термодинамічними параметрами стану. Це-температура, тиск, а також екстенсивні величини, віднесені до одиниці маси, об'єму або кількості речовини. Зміна інтенсивних параметрів з метою прискорення хіміко-технологічних процесів називається інтенсифікацією.
6.1. Рівновага хімічних реакцій
Під впливом підведення або відведення енергії у формі теплоти або роботи відбувається зміна стану термодинамічної системи (значень термодинамічних параметрів), який називають термодинамічним процесом. Процеси, що представляють собою безперервний ряд рівноважних станів, називають рівноважними. При цьому рівноважним вважають стан, у який приходить система за постійних зовнішніх умов, який характеризується незмінністю в часі термодинамічних параметрів і відсутністю в системі потоків речовини й теплоти.
Стійка рівновага характеризується наступними загальними умовами:
I. незмінністю рівноважного стану системи в часі за постійних зовнішніх умов;
2. рухливістю рівноваги (мимовільним відновленням стану рівноваги після зняття зовнішнього впливу, що викликав відхилення системи від положення рівноваги);
3. динамічним характером рівноваги, тобто встановленням і збереженням рівноваги внаслідок рівності швидкостей прямого й зворотного процесів;
4. можливістю підходу до стану рівноваги з двох протилежних сторін;
5. мінімальним значенням енергії Гіббса G в ізобарно-ізотермічних й енергії Гельмгольца F в ізохорно-ізотермічних процесах (dG=0, d2G>0; dF=0, d2F>0).
З цих загальних умов виводяться конкретні умови для хімічної рівноваги.
Хімічні реакції, як правило, оборотні: поряд з хімічною взаємодією між вихідними речовинами (пряма реакція) перебігає взаємодія й між продуктами (зворотна реакція). У міру перебігу процесу швидкість прямої реакції зменшується, a швидкість зворотної реакції збільшується; в якийсь момент часу швидкості прямої і зворотної реакцій стають рівними - наступає стан хімічної рівноваги. Хімічна рівновага характеризується незмінністю числа молекул речовин, що становлять хімічну систему, при незмінних зовнішніх умовах. Тому що умовою рівноваги за постійних Т и Р слугує мінімум енергії Гіббса (dG = 0), то в умовах хімічної рівноваги повинна також дотримуватися рівність:
Σ![]() jdnj=0
(6.1.)
jdnj=0
(6.1.)
де j - хімічний потенціал компонента J; nj - кількість компонента J (моль).
Відомо, що хімічним потенціалом називається величина:
![]() (6.2)
(6.2)
Більша позитивна величина вказує на високу реакційну здатність часток.
Закон діючих мас *. Вперше залежність напрямку хімічного процесу від концентрації реагуючих речовин установив М. М. Бекетов (1865 р.), переконливо обґрунтувавши це положення значним числом дослідів. У математичній формі закон діючих мас був виражений Гульдбергом і Вааге (1867 р.).
aA+bB![]() rR+sS (6.3)
rR+sS (6.3)
Як відомо з курсу загальної хімії, швидкість прямої реакції пропорційна добутку концентрацій реагентів А и В:
υ=k1caAcbB, (6.4)
а швидкість зворотної реакції - добутку концентрацій продуктів R і S:
υ =к2сrRсsS (6.5)
Розглянемо кінетичний висновок закону діючих мас на прикладі гомогенної реакції
Кожна концентрація зведена в ступінь, рівному стехіометричному коефіцієнту компонента в хімічному рівнянні. З умови рівності швидкостей прямої і зворотної реакцій у момент хімічної рівноваги:
k1c*aAc*bB=k2c*rRc*sS (6.6)
одержуємо:
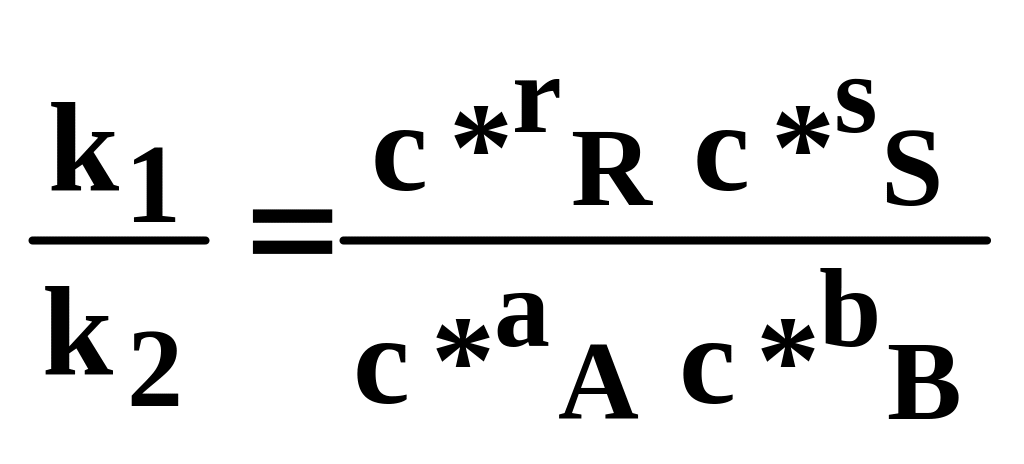 (6.7)
(6.7)
де с А,е, сВ,е, cR,е, cS,е - рівноважні концентрації.
Відношення констант швидкостей, яке називають константою рівноваги, позначимо через Кс. Одержуємо вираз закону діючих мас:
Kc= (6.8)
Як слідує з виразу (5.7), константа рівноваги не залежить від концентрації, тому що зміна концентрації одного з учасників реакції викличе такі ж зміни концентрації всіх інших речовин, і Кс збереже своє числове значення. Таким чином, основне значення закону діючих мас полягає в тому, що він встановлює зв'язок між рівноважними концентраціями всіх peaгуючих речовин.
При аналізі реакцій, що перебігають у газовій фазі, константу рівноваги виражають через парціальні тиски:
Kp=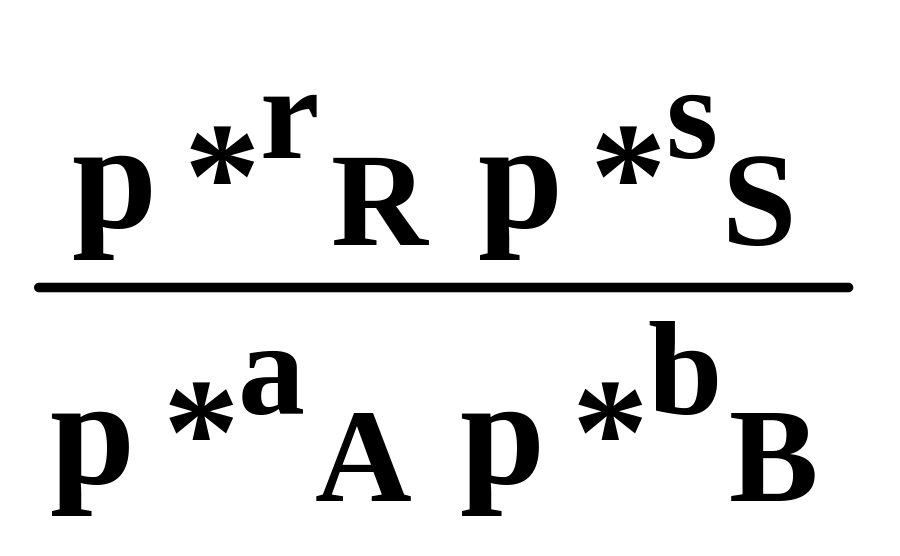 (6.9)
(6.9)
Тому що відповідно до рівняння Менделєєва – Клапейрона:
pj=cjRT, то
Kc=Kp(RT)-Δn (6.10)
де Δn = (r + s - а - b), якщо всі учасники реакції - газоподібні речовини.
Константу рівноваги можна виразити також через відношення молярних часток NJ учасників реакції:
KN=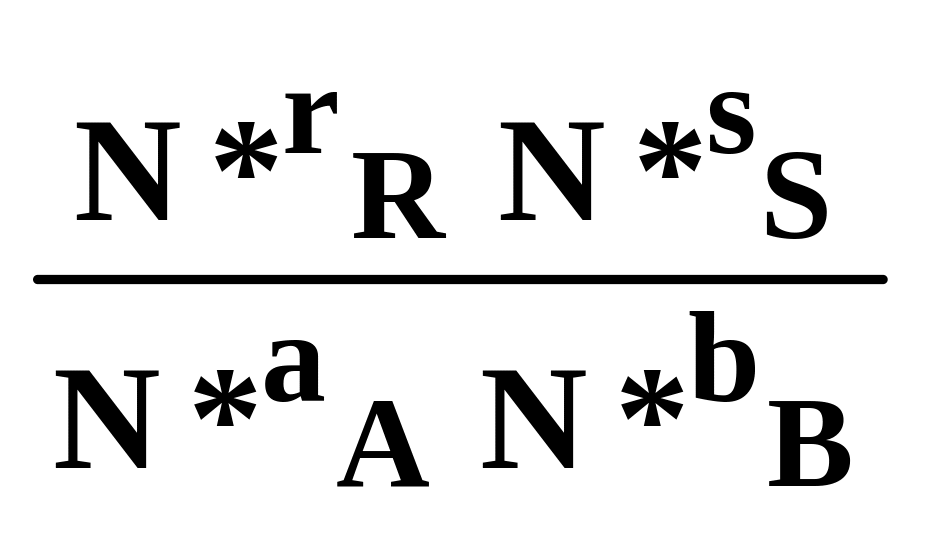 (6.11)
(6.11)
або через кількість компонентів nJ (моль)
KN=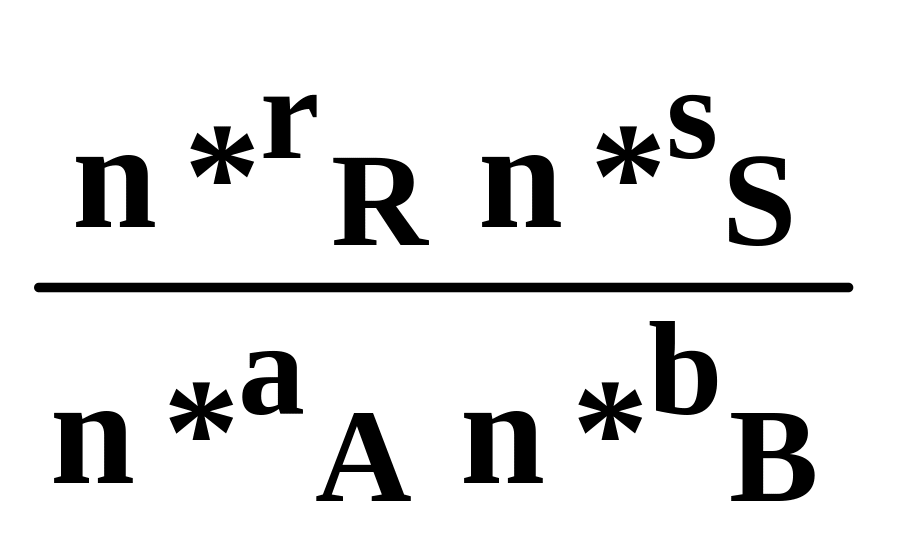 (6.12)
(6.12)
Для реальних систем константу рівноваги виражають через леткість f або активність a. Так, для розглянутої реакції :
Kf=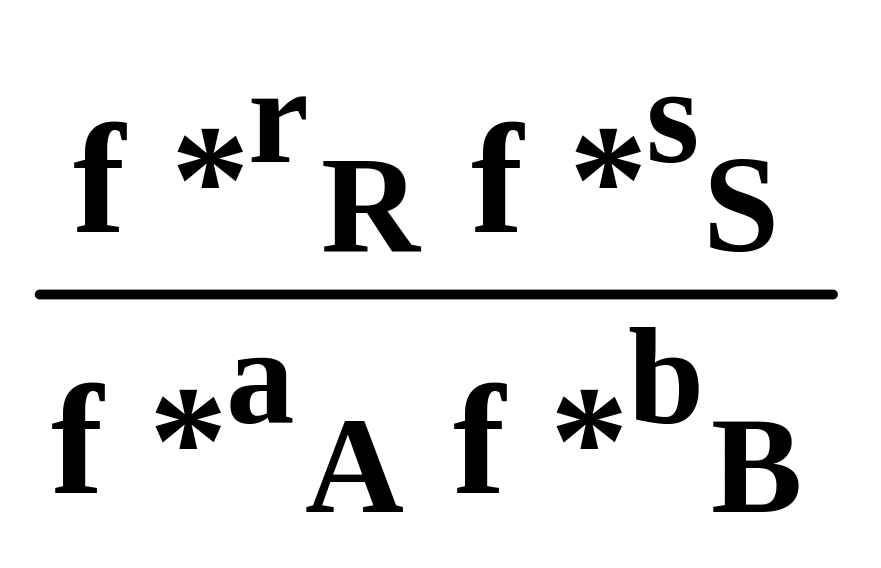 ,
,
Ka= (6.13)
(6.13)
За невеликих тисків практично за будь-яких температур:
Ka=Kf
–
Kp=
KNpΔn=Kn![]() (6.14)
(6.14)
