
- •С.В. Іванов, п.С. Борсук, н.М. Манчук загальна хімічна технологія
- •Передмова
- •Теоретичні основи хімічної технології вступ
- •1. Основи хіміко-технологічних процесів
- •1.1 Хіміко-технологічний процес і його зміст
- •1.2. Класифікація хімічних реакцій, які покладені в основу промислових хіміко-технологічних процесів.
- •1.3. Технологічні критерії ефективності хіміко-технологічного процесу
- •2. Структура хімічного виробництва
- •3. Хіміко-технологічні системи
- •3.1. Поняття хіміко-технологічної системи (хтс)
- •3.2. Моделі хіміко-технологічних систем
- •3.3. Технологічні зв'язки в хтс
- •4. Поняття про синтез хіміко-
- •4.1. Texнологічні концепції створення хтс
- •4.2. Аналіз хтс
- •5. Матеріальні і теплові баланси хіміко-технологічних систем
- •5.1. Баланс співвідношень
- •5.1.2. Приклади розрахунку балансів
- •5.2 Основні поняття ексергетичного аналізу хтс
- •6. Термодинамічні розрахунки хіміко-технологічних процесів
- •6.1. Рівновага хімічних реакцій
- •6.2. Константа рівноваги й енергія Гіббса. Рівняння ізотерми Вант-Гоффа
- •6.3. Хімічна рівновага в гетерогенних реакціях
- •7. Вибір технологічних режимів проведення хтп
- •7.1. Способи зміщення рівноваги
- •7.2. Залежність константи рівноваги від температури
- •7.3. Розрахунок рівноваги за термодинамічними даними
- •8. Використання законів хімічної кінетики при виборі технологічного режиму.
- •8. 1. Швидкість гомогенних хімічних реакцій
- •8.2. Залежність швидкості хімічних реакцій від концентрації реагентів; кінетичні рівняння
- •8.3. Способи зміни швидкості простих і складних реакцій
- •9. Кінетика хіміко-технологічних процесів
- •9.1. Вплив різних чинників на швидкість хімічних процесів, які перебігають на мікрорівні
- •9.2. Кінетика хтп, що ґрунтується на оборотних хтп
- •9.3 Швидкість хтп, що ґрунтується на паралельних та послідовних гомогенних реакціях
- •9.3.2. Вплив технологічних параметрів на швидкість гомогенних процесів
- •9.3.3. Методи інтенсифікації гомогенних процесів
- •9.4. Кінетика гетерогенних некаталітичних процесів
- •9.4.2. Швидкість гетерогенних процесів
- •9.4.4. Визначення лімітуючої стадії гетерогенного процесу
- •9.4.5. Способи збільшення швидкості процесу
- •9.5 Типи реакторів для гетерогенних процесів
- •9.5.1 Реактори для проведення реакцій в системах г-т і р-т
- •9.5.2 Реактори для проведення реакцій в системах г—р і р—р
- •10. Каталітичні процеси.
- •10.2. Технологічні характеристики каталізаторів
- •10.3. Гомогенний і гетерогенний каталіз
- •10.4. Властивості твердих каталізаторів і їхнє виготовлення
- •10.5. Апаратурне оформлення каталітичних процесів
- •10.5.3 Апарати зі зваженим (киплячим, псевдокиплячим) шаром каталізатора
- •11. Хімічні реактори
- •11.1 Класифікація реакторів
- •11.2. Вимоги до хімічних реакторів
- •11.3. Структура математичної моделі хімічного реактора
- •10.4. Реактор ідеального змішування періодичний
- •11.5 Реактори безперервної дії
- •11.5.1 Реактор ідеального витіснення (рів)
- •11.5.2. Реактор ідеального змішування безперервний (різ–б)
- •11.5.3 Загальне проектне рівняння реактора
- •11.6 Каскад реакторів ідеального змішання (к-різ)
- •11.7 Графічний метод розрахунку к – різ
- •11.8. Вплив кінетики на вибір типу реактора
- •11.9. Селективність, вихід, ступінь перетворення
- •11.9.2. Залежність селективності від ступеня перетворення
- •11.10. Хімічні реактори з неідеальною структурою потоків
- •11.11. Моделі ректорів з неідеальною структурою потоку
- •11.12. Ячеїста модель.
9. Кінетика хіміко-технологічних процесів
9.1. Вплив різних чинників на швидкість хімічних процесів, які перебігають на мікрорівні
Процеси, що перебігають в рідинах і в газах, звичайно розглядаються з двох точок зору: процес взаємодії окремих молекул-на мікрорівні і процес взаємодії агрегатів молекул-на макрорівні.
Мета всякого хімічного процесу полягає в тому, щоб одержати цільовий продукт з наявної сировини з можливо нижчою собівартістю. Для цього необхідно забезпечити мінімальні витратні коефіцієнти електроенергії, води, стисненого повітря і всієї сировини, оскільки в більшості випадків сировина є найбільш крупною статтею в собівартості продукції.
Для зниження витратного коефіцієнта сировини технологічний процес необхідно вести так, щоб ступінь перетворення X, вихід цільового продукту Ф і селективність φ (для складних реакцій) були можливо вищими і досягалися в можливо коротший час, тобто швидкість процесу повинна бути можливо вищою. Це пояснюється тим, що швидкість характеризує інтенсивність процесу, а інтенсивність являється одним з основних показників, що визначають економічність хімічного виробництва.
Швидкість хімічної реакції виражається рівнянням:
υ=dC/dτ=kCn (9.1)
де n — порядок реакції.
Але константа швидкості реакції k виражається рівнянням Арреніуса:
k=k0e –E/RT, (9.2
де k0 — передекспоненційний множник; Е — енергія активації.
Підставивши значення k із рівняння (9.2) в рівняння (9.1), знаходимо:
υ=k0e-E/RTCn (9.3)
З рівняння (9.3) виходить, що швидкість реакції залежить від температури і від концентрації реагуючих компонентів.
Для реакції в газовій фазі швидкість залежить від тиску, а для каталітичних процесів — і від активності каталізатора. Таким чином, в загальному випадку υ = f (С, Т, Р, Кат).
Розглянемо способи збільшення швидкості реакції для процесів, що перебігають на мікрорівні. При цьому у всіх випадках встановлюватимемо умови ведення процесу, при яких досягається найбільш високе значення протягом всього даного проміжку часу.
Температура робить сильний вплив на швидкість хімічної реакції, оскільки в рівнянні Арреніусу температура входить в показник ступеня, проте цей вплив неоднаковий для різних типів реакції.
Швидкість простої необоротної реакції А R ± Q описується рівнянням (8.3), з якого виходить, що за С= const і збільшенні температури Т швидкість реакції зростає за експоненціальним законом (рис. 9.1).
Залежність швидкості простої оборотної екзотермічної реакції типу А R + Q від температури виражається складнішим рівнянням, тому що в цьому випадку загальна швидкість реакції залежить від різниці між швидкостями прямої і зворотної реакцій:
υ= υ1-υ2=k1cA-k2cR (9.4)
де υ1,υ2;υ — швидкість відповідно прямої, зворотної і сумарної реакцій; k1, k2 — константи швидкості прямої і зворотних реакцій.
Для аналізу рівняння (9.4) підставимо в нього:
cA=cA![]() (1-xA),
k2=k1/Kc
, cR=
cA
XA,
(1-xA),
k2=k1/Kc
, cR=
cA
XA,
υ=k1
cA
(1-xA)![]() cA
xA,
cA
xA,
υ=k0΄
cA
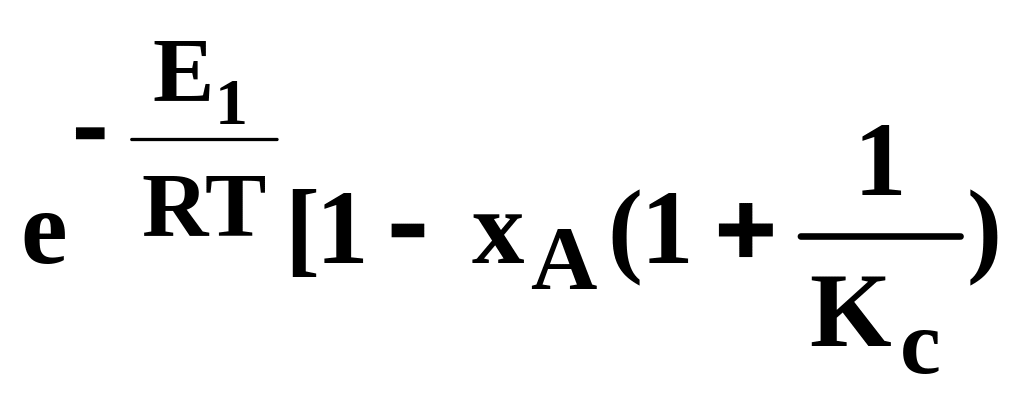 . (9.5)
. (9.5)
З рівняння (9.5) виходить, що для деякої сталої ХА з підвищенням температури сумарна швидкість реакції з одного боку повинна зростати за рахунок збільшення е–E/RT, а з іншого боку знижуватися, оскільки для екзотермічних реакцій константа рівноваги зменшується при підвищенні температури і, отже, зростає член 1/КС і зменшується множник в квадратних дужках. У зв'язку з цим при підвищенні температури швидкість реакції спочатку збільшується (від = О, коли розпочинається реакція), досягає максимального значення, а потім знижується. Таким чином, залежність υ=f(T) проходить через максимум (рис. 9.2).
З рівняння (9.5) виходить також, що при збільшенні Х А (за інших рівних умов) сумарна швидкість реакції знижується. Тому для випадку, коли Х 2>X1 крива залежності υ2=φ(Т) розташується нижче кривої, відповідній X1 (рис. 9.2), а крива залежності υ3 = Ф(Т) (коли Х3>Х2>X1) розташується ще нижче, і т. ін. Крива АВ, що сполучає максимуми отриманих таким чином кривих, являється лінією оптимальних температур (ЛОТ).
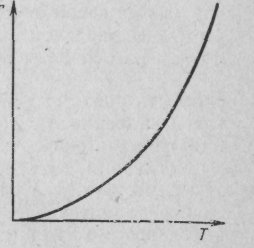
Рис. 9.1. Залежність швидкості реакції від температури Т для простої необоротної реакції
(А![]() R
± Q).
R
± Q).
