
- •Общая и неорганическая химия
- •Часть 2 свойства элементов и их соединений
- •Содержание
- •2.1 Введение.………………………….…..……………….………….30
- •3.1 Введение…………………………………………………………...41
- •4.1 Введение …………………………………………………………..47
- •5.1 Введение…………….….…………….………….….….….………56
- •6.1 Введение.…..…………………….………………………….……..70
- •7.1 Введение…………………………………………………………..77
- •9.1 Введение.…...…..………………………………….…..…….……83
- •Периодическая система химических элементов. Строение атомов и молекул
- •1.1 Введение
- •1.2 Постулаты теории Бора
- •1.3 Квантовомеханическое описание состояния электрона в атоме
- •1.3.1 Элементарные представления о квантовой механике
- •1.3.2 Главное квантовое число
- •1.3.3 Орбитальное квантовое число
- •1.3.4 Магнитное квантовое число
- •1.3.5 Атомные орбитали
- •1.3.6 Спиновое квантовое число
- •1.3.7 Принцип Паули
- •1.4 Периодическая система химических элементов
- •1.4.1 Элементы первого периода (h, He)
- •1 .4.2 Элементы второго периода (Li – Ne)
- •1.4.3 Элементы III периода (Na – Ar)
- •1.4.4 Элементы IV периода (k – Kr)
- •1.4.5 Элементы V, VI и VII периодов
- •1.5 Химическая связь и строение молекул
- •1.5.1 Механизмы образования ковалентной связи
- •1.5.2 Направленность ковалентной связи
- •1.5.3 Гибридизация атомных орбиталей
- •1.5.4 Металлическая связь
- •Комплексные соединения
- •2.1 Введение
- •2.2 Основные положения координационной теории
- •2.3 Природа химической связи в комплексных соединениях
- •2.4 Классификация комплексов
- •2.4.2 Классификация по типу лигандов
- •2.5 Номенклатура комплексных соединений
- •2.6 Диссоциация комплексных соединений в растворах
- •2.7 Образование и разрушение комплексов
- •2.8 Геометрия комплексных ионов
- •2.9 Изомерия комплексных соединений
- •Галогены
- •3.1 Введение
- •3.2 Физические свойства галогенов
- •3.3 Химические свойства галогенов
- •3.4 Получение галогенов
- •3.5 Водородные соединения галогенов
- •3.6 Получение галогеноводородов
- •3.7 Кислородсодержащие соединения галогенов
- •3.8 Применение галогенов
- •4.1 Введение
- •4.2 Кислород
- •4.3 Сера
- •4.3.1 Свойства серы – простого вещества
- •4.3.2 Сероводород, сульфиды, полисульфиды
- •4.3.3 Диоксид серы. Сернистая кислота
- •4.3.4 Триоксид серы. Серная кислота
- •4.3.5 Олеум. Дисерная кислота
- •4.3.6 Мононадсерная и пероксодисерная кислоты
- •4.3.7 Тиосерная кислота и тиосульфаты
- •4.4 Селен. Теллур
- •4.5 Сравнение свойств водородных соединений p-элементов VI группы
- •5.1 Введение
- •5.2 Азот
- •5.2.1 Свойства азота – простого вещества
- •5.2.2 Аммиак и соли аммония. Гидразин. Гидроксиламин
- •5.2.3 Оксиды азота
- •5.2.4 Азотистая кислота и её соли
- •5.2.5 Азотная кислота и её соли
- •5.2.6 «Царская водка»
- •5.3 Фосфор
- •5.3.1 Свойства фосфора – простого вещества
- •5.3.4 Соединение фосфора с водородом
- •5.3.5 Галогениды фосфора
- •5.4 Мышьяк
- •5.5 Сурьма
- •5.6 Висмут
- •6.1 Введение
- •6.2 Углерод и его соединения
- •6.2.1 Свойства углерода – простого вещества
- •6.2.2 Оксид углерода (IV). Угольная кислота и её соли
- •6.2.3 Оксид углерода (II)
- •6.2.4 Карбиды
- •6.2.5 Соединения углерода с азотом
- •6.3 Кремний
- •6.4 Германий. Олово. Свинец
- •7.1 Введение
- •7.3 Алюминий
- •7.4 Индий. Галлий. Таллий
- •Обзор химических свойств соединений d-элементов
- •9.1 Введение
- •9.4 Хром
- •9.5 Марганец
- •9.6 Элементы триады железа
- •9.6.1 Железо
- •9.6.2 Кобальт
- •9.6.3 Никель
- •Литература
- •Часть 2. Свойства элементов и их соединений
1.5 Химическая связь и строение молекул
1.5.1 Механизмы образования ковалентной связи
Теория строения атома явилась предпосылкой для создания теории химической связи. В 1916 году (к этому времени уже стали известны основные черты электронной структуры атомов) немецкий учёный В. Коссель предположил, что при взаимодействии двух атомов один из них отдаёт электроны, а другой принимает; при этом первый атом превращается в положительно заряженный ион, а второй – в отрицательно заряженный. Электростатическое притяжение образовавшихся ионов приводит к образованию устойчивого соединения. Дальнейшее развитие идей Косселя привело к созданию современных представлений об ионной связи.
В том же 1916 году американский физико-химик Дж. Льюис высказал предположение, что химическая связь возникает в результате образования электронной пары, одновременно принадлежащей двум атомам. Эта идея послужила исходным пунктом для разработки современной теории ковалентной связи.
Процесс спаривания электронов при образовании молекулы водорода может быть изображён следующей схемой:
П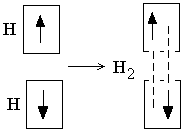 редставления
о механизме образования химической
связи, развитые на примере молекулы
водорода, были распространены и на
более сложные молекулы. Разработанная
на этой основе теория химических связей
получила название метода валентных
связей (метод ВС). В основе метода
валентных связей лежит рассмотренное
выше положение о том, что любая ковалентная
химическая связь возникает в результате
взаимодействия двух электронов с
противоположно направленными спинами,
причём изначально эти электроны
принадлежат различным атомам, а
образующаяся общая электронная пара
– обоим атомам. Такой механизм образования
ковалентной связи называется обменным
механизмом.
Именно по обменному механизму образованы
химические связи в молекулах водорода
и хлороводорода:
редставления
о механизме образования химической
связи, развитые на примере молекулы
водорода, были распространены и на
более сложные молекулы. Разработанная
на этой основе теория химических связей
получила название метода валентных
связей (метод ВС). В основе метода
валентных связей лежит рассмотренное
выше положение о том, что любая ковалентная
химическая связь возникает в результате
взаимодействия двух электронов с
противоположно направленными спинами,
причём изначально эти электроны
принадлежат различным атомам, а
образующаяся общая электронная пара
– обоим атомам. Такой механизм образования
ковалентной связи называется обменным
механизмом.
Именно по обменному механизму образованы
химические связи в молекулах водорода
и хлороводорода:
![]()
Согласно методу ВС ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака.
Таким образом, согласно методу ВС ковалентная связь является двухэлектронной двухцентровой связью, поскольку пара из двух электронов движется в силовом поле, образованном двумя центрами – ядрами двух атомов. Комбинации таких двухэлектронных двухцентровых связей, отражающие электронную структуру молекулы, получили название валентных схем.
К![]() роме
обменного механизма возможен
донорно-акцепторный
механизм
образования ковалентной связи, отличие
которого можно показать на примере
образования иона аммония. Атом азота
в молекуле аммиака связан с тремя
атомами водорода тремя ковалентными
связями, образованными по обменному
механизму (крестиками в формуле аммиака
показаны электроны, изначально
принадлежавшие атомам водорода). Кроме
того, у атома азота есть два спаренных
электрона. Такая пара электронов тоже
может участвовать в образовании
ковалентной связи с другим атомом, если
во внешнем электронном слое этого атома
е
роме
обменного механизма возможен
донорно-акцепторный
механизм
образования ковалентной связи, отличие
которого можно показать на примере
образования иона аммония. Атом азота
в молекуле аммиака связан с тремя
атомами водорода тремя ковалентными
связями, образованными по обменному
механизму (крестиками в формуле аммиака
показаны электроны, изначально
принадлежавшие атомам водорода). Кроме
того, у атома азота есть два спаренных
электрона. Такая пара электронов тоже
может участвовать в образовании
ковалентной связи с другим атомом, если
во внешнем электронном слое этого атома
е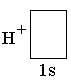 сть
свободная орбиталь. Незаполненная
орбиталь есть у иона водорода. При
взаимодействии молекулы аммиака с
ионом водорода ковалентная связь
возникает вследствие того, что
неподелённая пара электронов атома
азота, перекрываясь со свободной
орбиталью иона H+,
становится общей для обоих атомов. В
результате этого взаимодействия
образуется ион аммония.
сть
свободная орбиталь. Незаполненная
орбиталь есть у иона водорода. При
взаимодействии молекулы аммиака с
ионом водорода ковалентная связь
возникает вследствие того, что
неподелённая пара электронов атома
азота, перекрываясь со свободной
орбиталью иона H+,
становится общей для обоих атомов. В
результате этого взаимодействия
образуется ион аммония.

Следует заметить, что часто встречающийся в литературе термин «донорно-акцепторная связь» не всегда правильно интерпретируется. Важно понимать, что имеет смысл говорить лишь о донорно-акцепторном механизме образования ковалентной связи, поскольку после образования, например, иона аммония NH4+ невозможно определить, какая из ковалентных связей образована по донорно-акцепторному, а какая по обменному механизму. Все четыре ковалентные связи в ионе аммония между атомом азота и атомами водорода абсолютно одинаковы.
