
- •Общая и неорганическая химия
- •Часть 2 свойства элементов и их соединений
- •Содержание
- •2.1 Введение.………………………….…..……………….………….30
- •3.1 Введение…………………………………………………………...41
- •4.1 Введение …………………………………………………………..47
- •5.1 Введение…………….….…………….………….….….….………56
- •6.1 Введение.…..…………………….………………………….……..70
- •7.1 Введение…………………………………………………………..77
- •9.1 Введение.…...…..………………………………….…..…….……83
- •Периодическая система химических элементов. Строение атомов и молекул
- •1.1 Введение
- •1.2 Постулаты теории Бора
- •1.3 Квантовомеханическое описание состояния электрона в атоме
- •1.3.1 Элементарные представления о квантовой механике
- •1.3.2 Главное квантовое число
- •1.3.3 Орбитальное квантовое число
- •1.3.4 Магнитное квантовое число
- •1.3.5 Атомные орбитали
- •1.3.6 Спиновое квантовое число
- •1.3.7 Принцип Паули
- •1.4 Периодическая система химических элементов
- •1.4.1 Элементы первого периода (h, He)
- •1 .4.2 Элементы второго периода (Li – Ne)
- •1.4.3 Элементы III периода (Na – Ar)
- •1.4.4 Элементы IV периода (k – Kr)
- •1.4.5 Элементы V, VI и VII периодов
- •1.5 Химическая связь и строение молекул
- •1.5.1 Механизмы образования ковалентной связи
- •1.5.2 Направленность ковалентной связи
- •1.5.3 Гибридизация атомных орбиталей
- •1.5.4 Металлическая связь
- •Комплексные соединения
- •2.1 Введение
- •2.2 Основные положения координационной теории
- •2.3 Природа химической связи в комплексных соединениях
- •2.4 Классификация комплексов
- •2.4.2 Классификация по типу лигандов
- •2.5 Номенклатура комплексных соединений
- •2.6 Диссоциация комплексных соединений в растворах
- •2.7 Образование и разрушение комплексов
- •2.8 Геометрия комплексных ионов
- •2.9 Изомерия комплексных соединений
- •Галогены
- •3.1 Введение
- •3.2 Физические свойства галогенов
- •3.3 Химические свойства галогенов
- •3.4 Получение галогенов
- •3.5 Водородные соединения галогенов
- •3.6 Получение галогеноводородов
- •3.7 Кислородсодержащие соединения галогенов
- •3.8 Применение галогенов
- •4.1 Введение
- •4.2 Кислород
- •4.3 Сера
- •4.3.1 Свойства серы – простого вещества
- •4.3.2 Сероводород, сульфиды, полисульфиды
- •4.3.3 Диоксид серы. Сернистая кислота
- •4.3.4 Триоксид серы. Серная кислота
- •4.3.5 Олеум. Дисерная кислота
- •4.3.6 Мононадсерная и пероксодисерная кислоты
- •4.3.7 Тиосерная кислота и тиосульфаты
- •4.4 Селен. Теллур
- •4.5 Сравнение свойств водородных соединений p-элементов VI группы
- •5.1 Введение
- •5.2 Азот
- •5.2.1 Свойства азота – простого вещества
- •5.2.2 Аммиак и соли аммония. Гидразин. Гидроксиламин
- •5.2.3 Оксиды азота
- •5.2.4 Азотистая кислота и её соли
- •5.2.5 Азотная кислота и её соли
- •5.2.6 «Царская водка»
- •5.3 Фосфор
- •5.3.1 Свойства фосфора – простого вещества
- •5.3.4 Соединение фосфора с водородом
- •5.3.5 Галогениды фосфора
- •5.4 Мышьяк
- •5.5 Сурьма
- •5.6 Висмут
- •6.1 Введение
- •6.2 Углерод и его соединения
- •6.2.1 Свойства углерода – простого вещества
- •6.2.2 Оксид углерода (IV). Угольная кислота и её соли
- •6.2.3 Оксид углерода (II)
- •6.2.4 Карбиды
- •6.2.5 Соединения углерода с азотом
- •6.3 Кремний
- •6.4 Германий. Олово. Свинец
- •7.1 Введение
- •7.3 Алюминий
- •7.4 Индий. Галлий. Таллий
- •Обзор химических свойств соединений d-элементов
- •9.1 Введение
- •9.4 Хром
- •9.5 Марганец
- •9.6 Элементы триады железа
- •9.6.1 Железо
- •9.6.2 Кобальт
- •9.6.3 Никель
- •Литература
- •Часть 2. Свойства элементов и их соединений
1 .4.2 Элементы второго периода (Li – Ne)
У следующего за гелием элемента – лития (Z = 3) – третий электрон уже не может разместиться на первом энергетическом уровне, так как на одной орбитали не может находиться более двух электронов. Поэтому третий электрон должен располагаться на втором энергетическом уровне n = 2 .
При n = 2 орбитальное квантовое число может принимать два значения: l = 0; 1. Таким образом, второй энергетический уровень образован орбиталями двух типов: одной s-орбиталью и тремя p-орбиталями.
Заполнение орбиталей электронами происходит таким образом, что сначала заполняется более низкая по энергии орбиталь. Поэтому третий электрон в невозбужденном атоме лития располагается на 2s-орбитали, так как 2s-орбиталь имеет более низкую энергию, чем 2p-орбиталь. Полная электронная формула атома лития: 1s22s1. Ниже показана полная электронно-графическая схема невозбуждённого атома лития:
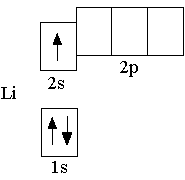
Для понимания химических свойств элемента достаточно рассмотреть электронные формулы и электронно-графические схемы, на которых показаны только валентные электроны (т.е. электроны, участвующие в образовании химических связей). Такие электронные формулы и электронно-графические схемы называют сокращёнными. Для элементов второго периода валентными являются электроны и орбитали внешнего энергетического уровня.
Сокращённая электронная формула атома лития: 2s1.
Ниже показана сокращённая электронно-графическая схема атома лития.
Иногда,
чтобы подчеркнуть наличие в атоме
незаполненных электронами орбиталей,
сокращённую электронную формулу
записывают так: Li
2s12p0.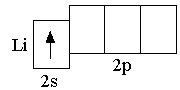
Сокращённая электронно-графическая схема и сокращённая электронная формула следующего за литием атома бериллия (Z = 4) выглядят следующим образом:
Be
2s2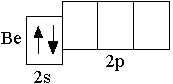
Элементы, в атомах которых электронами заполняются s-орбитали, называются s-элементами (т.е. H, He, Li, Be – это s-элементы). Следует отметить, что все s-элементы, за исключением водорода и гелия, являются металлами.
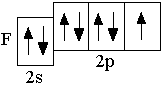
Следующие за бериллием элементы второго периода – бор, углерод, азот, кислород, фтор, неон – являются p-элементами: у них заполняются электронами p-орбитали. Ниже представлены сокращённые электронно-графические схемы и сокращённые электронные формулы этих элементов.
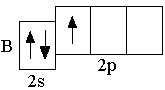
B 2s22p1
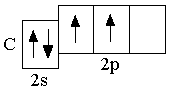
C 2s22p2
N 2s22p3
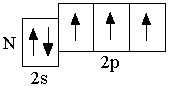
O 2s22p4
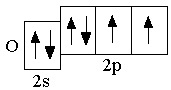
F 2s22p5
Ne 2s22p6
У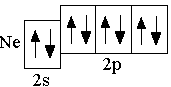 стойчивому
состоянию атома соответствует такое
распределение электронов в пределах
подуровня, при котором абсолютное
значение суммарного спина максимально
(правило Хунда).
Поэтому при заполнении p-орбиталей
атомов углерода и азота каждый электрон
заполняет свободную орбиталь, а не
спаривается с другим электроном.
стойчивому
состоянию атома соответствует такое
распределение электронов в пределах
подуровня, при котором абсолютное
значение суммарного спина максимально
(правило Хунда).
Поэтому при заполнении p-орбиталей
атомов углерода и азота каждый электрон
заполняет свободную орбиталь, а не
спаривается с другим электроном.
Правило Хунда не запрещает другого распределения электронов в пределах подуровня. Оно лишь утверждает, что максимальное абсолютное значение суммарного спина соответствует невозбуждённому состоянию; любое другое распределение электронов в пределах подуровня соответствует возбуждённому состоянию.
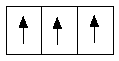
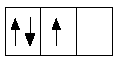
абсолютное значение абсолютное значение
суммарного спина: суммарного спина:
| +1/2 +1/2 +1/2 | = 3/2; | +1/2 – 1/2 + 1/2 | = 1/2;
максимальное значение; не является максимальным;
(невозбуждённое состояние); (возбуждённое состояние).
