
- •Общая и неорганическая химия
- •Часть 2 свойства элементов и их соединений
- •Содержание
- •2.1 Введение.………………………….…..……………….………….30
- •3.1 Введение…………………………………………………………...41
- •4.1 Введение …………………………………………………………..47
- •5.1 Введение…………….….…………….………….….….….………56
- •6.1 Введение.…..…………………….………………………….……..70
- •7.1 Введение…………………………………………………………..77
- •9.1 Введение.…...…..………………………………….…..…….……83
- •Периодическая система химических элементов. Строение атомов и молекул
- •1.1 Введение
- •1.2 Постулаты теории Бора
- •1.3 Квантовомеханическое описание состояния электрона в атоме
- •1.3.1 Элементарные представления о квантовой механике
- •1.3.2 Главное квантовое число
- •1.3.3 Орбитальное квантовое число
- •1.3.4 Магнитное квантовое число
- •1.3.5 Атомные орбитали
- •1.3.6 Спиновое квантовое число
- •1.3.7 Принцип Паули
- •1.4 Периодическая система химических элементов
- •1.4.1 Элементы первого периода (h, He)
- •1 .4.2 Элементы второго периода (Li – Ne)
- •1.4.3 Элементы III периода (Na – Ar)
- •1.4.4 Элементы IV периода (k – Kr)
- •1.4.5 Элементы V, VI и VII периодов
- •1.5 Химическая связь и строение молекул
- •1.5.1 Механизмы образования ковалентной связи
- •1.5.2 Направленность ковалентной связи
- •1.5.3 Гибридизация атомных орбиталей
- •1.5.4 Металлическая связь
- •Комплексные соединения
- •2.1 Введение
- •2.2 Основные положения координационной теории
- •2.3 Природа химической связи в комплексных соединениях
- •2.4 Классификация комплексов
- •2.4.2 Классификация по типу лигандов
- •2.5 Номенклатура комплексных соединений
- •2.6 Диссоциация комплексных соединений в растворах
- •2.7 Образование и разрушение комплексов
- •2.8 Геометрия комплексных ионов
- •2.9 Изомерия комплексных соединений
- •Галогены
- •3.1 Введение
- •3.2 Физические свойства галогенов
- •3.3 Химические свойства галогенов
- •3.4 Получение галогенов
- •3.5 Водородные соединения галогенов
- •3.6 Получение галогеноводородов
- •3.7 Кислородсодержащие соединения галогенов
- •3.8 Применение галогенов
- •4.1 Введение
- •4.2 Кислород
- •4.3 Сера
- •4.3.1 Свойства серы – простого вещества
- •4.3.2 Сероводород, сульфиды, полисульфиды
- •4.3.3 Диоксид серы. Сернистая кислота
- •4.3.4 Триоксид серы. Серная кислота
- •4.3.5 Олеум. Дисерная кислота
- •4.3.6 Мононадсерная и пероксодисерная кислоты
- •4.3.7 Тиосерная кислота и тиосульфаты
- •4.4 Селен. Теллур
- •4.5 Сравнение свойств водородных соединений p-элементов VI группы
- •5.1 Введение
- •5.2 Азот
- •5.2.1 Свойства азота – простого вещества
- •5.2.2 Аммиак и соли аммония. Гидразин. Гидроксиламин
- •5.2.3 Оксиды азота
- •5.2.4 Азотистая кислота и её соли
- •5.2.5 Азотная кислота и её соли
- •5.2.6 «Царская водка»
- •5.3 Фосфор
- •5.3.1 Свойства фосфора – простого вещества
- •5.3.4 Соединение фосфора с водородом
- •5.3.5 Галогениды фосфора
- •5.4 Мышьяк
- •5.5 Сурьма
- •5.6 Висмут
- •6.1 Введение
- •6.2 Углерод и его соединения
- •6.2.1 Свойства углерода – простого вещества
- •6.2.2 Оксид углерода (IV). Угольная кислота и её соли
- •6.2.3 Оксид углерода (II)
- •6.2.4 Карбиды
- •6.2.5 Соединения углерода с азотом
- •6.3 Кремний
- •6.4 Германий. Олово. Свинец
- •7.1 Введение
- •7.3 Алюминий
- •7.4 Индий. Галлий. Таллий
- •Обзор химических свойств соединений d-элементов
- •9.1 Введение
- •9.4 Хром
- •9.5 Марганец
- •9.6 Элементы триады железа
- •9.6.1 Железо
- •9.6.2 Кобальт
- •9.6.3 Никель
- •Литература
- •Часть 2. Свойства элементов и их соединений
1.3.5 Атомные орбитали
Состояние электрона в атоме, характеризующееся тремя квантовыми числами n, l, ml , называется атомной орбиталью. Часто орбиталь также определяют как область пространства, в которой наиболее вероятно нахождение электрона.
Совокупность орбиталей с одним и тем же значением главного квантового числа n образует энергетический уровень. Орбитали некоторого энергетического уровня, характеризующиеся одним и тем же значением орбитального квантового числа l, образуют энергетический подуровень.
О![]() чевидно,
что число орбиталей на подуровне равно
числу значений магнитного квантового
числа ml,
которые оно может принимать при данном
l.
Так, на любом энергетическом уровне
может находиться только одна s-орбиталь;
она и образует s-подуровень. Если
некоторый энергетический уровень
образован также орбиталями другого
типа, то p-орбиталей всегда будет три;
они образуют p-подуровень. d-подуровень
образован пятью d-орбиталями, а семь
f-орбиталей образуют f-подуровень.
чевидно,
что число орбиталей на подуровне равно
числу значений магнитного квантового
числа ml,
которые оно может принимать при данном
l.
Так, на любом энергетическом уровне
может находиться только одна s-орбиталь;
она и образует s-подуровень. Если
некоторый энергетический уровень
образован также орбиталями другого
типа, то p-орбиталей всегда будет три;
они образуют p-подуровень. d-подуровень
образован пятью d-орбиталями, а семь
f-орбиталей образуют f-подуровень.
Графическое изображение орбитали:
Например, показанные ниже орбитали все вместе образуют третий энергетический уровень, так как все они характеризуются одним и тем же значением главного квантового числа n = 3. Третий энергетический уровень делится на три подуровня, несколько различающихся по энергии: s-орбитали имеют более низкую энергию, чем p-орбитали, а p-орбитали, более низкую энергию, чем d-орбитали. Каждый подуровень образован орбиталями с одинаковым значением орбитального квантового числа l.
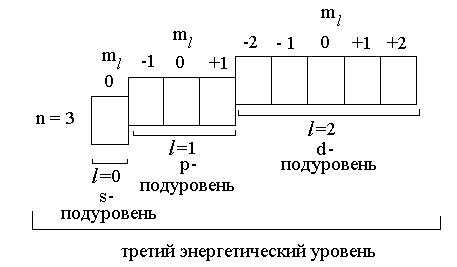
1.3.6 Спиновое квантовое число
Исследование атомных спектров показало, что помимо квантовых чисел n, l, ml, электрон характеризуется ещё одной квантованной величиной, не связанной с движением электрона вокруг ядра, а определяющей его собственное движение. Эта величина получила название спинового квантового числа (ms). У электрона спиновое квантовое число может принимать два значения: ms = +1/2 и ms = -1/2 . Схематическое изображение:
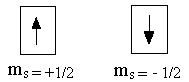
Четыре квантовых числа n, l, ml, ms однозначно определяют состояние электрона в атоме.
1.3.7 Принцип Паули
Согласно принципу Паули в атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковы. Из этого следует, что на каждой атомной орбитали, характеризующейся определёнными значениями n, l, ml , может находиться не более двух электронов, причём спины этих электронов должны быть противоположно направлены (так как только в этом случае спиновые квантовые числа электронов будут отличаться: у одного электрона ms = +1/2, у другого ms = -1/2).
О![]() бозначение
неспаренного электрона на атомной
орбитали:
бозначение
неспаренного электрона на атомной
орбитали:
О![]() бозначение
двух спаренных электронов с противоположными
спинами, находящихся на одной атомной
орбитали:
бозначение
двух спаренных электронов с противоположными
спинами, находящихся на одной атомной
орбитали:
1.4 Периодическая система химических элементов
1.4.1 Элементы первого периода (h, He)
Порядковый номер элемента в периодической таблице равен заряду ядра атома Z, а следовательно, и общему числу электронов в атоме.
Наиболее устойчивое (невозбуждённое) состояние электрона в атоме соответствует минимально возможному значению энергии данного электрона. Любое другое состояние является возбуждённым; из него электрон самопроизвольно переходит в состояние с более низкой энергией.
В невозбуждённом атоме водорода (Z = 1) единственный электрон находится на самом низком из возможных энергетических уровней: n = 1. В этом случае орбитальное квантовое число может принимать только одно значение l = 0. Следовательно, первый энергетический уровень образован единственной s-орбиталью, на которой и находится электрон.
Э![]() лектронно-графическая
схема атома водорода:
лектронно-графическая
схема атома водорода:
Электронная формула атома водорода: 1s1.
В атоме гелия (Z = 2) второй электрон также находится на 1s орбитали. Электронная формула атома гелия: 1s2.
Электронно-графическая схема атома гелия:
