
- •Общая и неорганическая химия
- •Часть 2 свойства элементов и их соединений
- •Содержание
- •2.1 Введение.………………………….…..……………….………….30
- •3.1 Введение…………………………………………………………...41
- •4.1 Введение …………………………………………………………..47
- •5.1 Введение…………….….…………….………….….….….………56
- •6.1 Введение.…..…………………….………………………….……..70
- •7.1 Введение…………………………………………………………..77
- •9.1 Введение.…...…..………………………………….…..…….……83
- •Периодическая система химических элементов. Строение атомов и молекул
- •1.1 Введение
- •1.2 Постулаты теории Бора
- •1.3 Квантовомеханическое описание состояния электрона в атоме
- •1.3.1 Элементарные представления о квантовой механике
- •1.3.2 Главное квантовое число
- •1.3.3 Орбитальное квантовое число
- •1.3.4 Магнитное квантовое число
- •1.3.5 Атомные орбитали
- •1.3.6 Спиновое квантовое число
- •1.3.7 Принцип Паули
- •1.4 Периодическая система химических элементов
- •1.4.1 Элементы первого периода (h, He)
- •1 .4.2 Элементы второго периода (Li – Ne)
- •1.4.3 Элементы III периода (Na – Ar)
- •1.4.4 Элементы IV периода (k – Kr)
- •1.4.5 Элементы V, VI и VII периодов
- •1.5 Химическая связь и строение молекул
- •1.5.1 Механизмы образования ковалентной связи
- •1.5.2 Направленность ковалентной связи
- •1.5.3 Гибридизация атомных орбиталей
- •1.5.4 Металлическая связь
- •Комплексные соединения
- •2.1 Введение
- •2.2 Основные положения координационной теории
- •2.3 Природа химической связи в комплексных соединениях
- •2.4 Классификация комплексов
- •2.4.2 Классификация по типу лигандов
- •2.5 Номенклатура комплексных соединений
- •2.6 Диссоциация комплексных соединений в растворах
- •2.7 Образование и разрушение комплексов
- •2.8 Геометрия комплексных ионов
- •2.9 Изомерия комплексных соединений
- •Галогены
- •3.1 Введение
- •3.2 Физические свойства галогенов
- •3.3 Химические свойства галогенов
- •3.4 Получение галогенов
- •3.5 Водородные соединения галогенов
- •3.6 Получение галогеноводородов
- •3.7 Кислородсодержащие соединения галогенов
- •3.8 Применение галогенов
- •4.1 Введение
- •4.2 Кислород
- •4.3 Сера
- •4.3.1 Свойства серы – простого вещества
- •4.3.2 Сероводород, сульфиды, полисульфиды
- •4.3.3 Диоксид серы. Сернистая кислота
- •4.3.4 Триоксид серы. Серная кислота
- •4.3.5 Олеум. Дисерная кислота
- •4.3.6 Мононадсерная и пероксодисерная кислоты
- •4.3.7 Тиосерная кислота и тиосульфаты
- •4.4 Селен. Теллур
- •4.5 Сравнение свойств водородных соединений p-элементов VI группы
- •5.1 Введение
- •5.2 Азот
- •5.2.1 Свойства азота – простого вещества
- •5.2.2 Аммиак и соли аммония. Гидразин. Гидроксиламин
- •5.2.3 Оксиды азота
- •5.2.4 Азотистая кислота и её соли
- •5.2.5 Азотная кислота и её соли
- •5.2.6 «Царская водка»
- •5.3 Фосфор
- •5.3.1 Свойства фосфора – простого вещества
- •5.3.4 Соединение фосфора с водородом
- •5.3.5 Галогениды фосфора
- •5.4 Мышьяк
- •5.5 Сурьма
- •5.6 Висмут
- •6.1 Введение
- •6.2 Углерод и его соединения
- •6.2.1 Свойства углерода – простого вещества
- •6.2.2 Оксид углерода (IV). Угольная кислота и её соли
- •6.2.3 Оксид углерода (II)
- •6.2.4 Карбиды
- •6.2.5 Соединения углерода с азотом
- •6.3 Кремний
- •6.4 Германий. Олово. Свинец
- •7.1 Введение
- •7.3 Алюминий
- •7.4 Индий. Галлий. Таллий
- •Обзор химических свойств соединений d-элементов
- •9.1 Введение
- •9.4 Хром
- •9.5 Марганец
- •9.6 Элементы триады железа
- •9.6.1 Железо
- •9.6.2 Кобальт
- •9.6.3 Никель
- •Литература
- •Часть 2. Свойства элементов и их соединений
9.6.2 Кобальт
Электронная конфигурация невозбуждённого атома кобальта выражается формулой 3d74s2. Наиболее характерна для кобальта степень окисления +2.
Соединения кобальта в степени окисления +3 устойчивы только в комплексных формах.
Соли кобальта (II) в безводном состоянии обычно синего цвета, а их водные растворы и кристаллогидраты имеют розовую окраску, характерную для аквакомплексов [Co(H2O)6]2+. Фильтровальная бумага, пропитанная раствором хлорида кобальта и затем высушенная, может служить грубым гигрометром (указателем влажности), так как в зависимости от содержания влаги в воздухе принимает разные оттенки цветов – от синего до розового.
Гидроксид кобальта (II) существует в виде синей и розовой модификаций. Синяя модификация получается при действии щелочей на соли кобальта (II):
Co2+ + 2 OH– Co(OH)2.
При нагревании в кипящей воде синяя модификация переходит в розовую; при прокаливании Co(OH)2 образуются серо-зелёные кристаллы оксида кобальта (II).
Процесс окисления 4 Co(OH)2 + O2 + 2 H2O 4 Co(OH)3
протекает гораздо медленнее, чем аналогичное превращение Fe(OH)2 в Fe(OH)3. Однако в присутствии сильных окислителей в щелочной среде окисление гидроксида кобальта (II) в чёрно-бурый гидроксид кобальта (III) протекает быстро:
2 Co(OH)2 + Cl2 + 2 NaOH 2 Co(OH)3 + 2 NaCl.
Катионы
кобальта
(III)
– очень
сильные
окислители (![]() =
+ 1,84 В).
Они способны окислять даже воду
(
=
+ 1,84 В).
Они способны окислять даже воду
(![]() =
+ 1,23 В). Поэтому при действии на гидроксид
кобальта (III)
растворов кислородсодержащих
кислот соли кобальта (III)
не образуются, а
выделяется кислород, и получаются
соли
кобальта (II):
4 Co(OH)3
+ 4 H2SO4
4 CoSO4
+ O2
+ 10 H2O.
=
+ 1,23 В). Поэтому при действии на гидроксид
кобальта (III)
растворов кислородсодержащих
кислот соли кобальта (III)
не образуются, а
выделяется кислород, и получаются
соли
кобальта (II):
4 Co(OH)3
+ 4 H2SO4
4 CoSO4
+ O2
+ 10 H2O.
Из соляной кислоты Co+3 выделяет хлор:
2 Co(OH)3 + 6 HCl 2 CoCl2 + Cl2 + 6 H2O.
Степень окисления +3 стабилизируется в многочисленных комплексных соединениях кобальта: например, ионы [Co(NH3)6]3+ в водных растворах достаточно устойчивы и воду не разлагают. Комплексные соединения кобальта +2 известны, но они менее устойчивы, чем комплексы кобальта +3. Например, амминокомплексы кобальта (II) легко окисляются даже молекулярным кислородом:
4 [Co(NH3)6]2+ + O2 + 2 H2O 4 [Co(NH3)6]3+ + 4 OH– .
9.6.3 Никель
Электронная конфигурация невозбуждённого атома никеля выражается формулой 3d84s2. Соединения никеля сходны с соединениями кобальта. Как и для кобальта, для никеля известны гидроксиды Ni(OH)2 и Ni(OH)3 и соответствующие им оксиды. Однако известен только один ряд солей никеля, в которых он находится в степени окисления +2.
В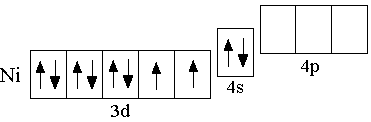 одные
растворы солей никеля окрашены в зелёный
цвет; при действии на них щелочей
выпадает светло-зелёный осадок гидроксида
никеля (II):
одные
растворы солей никеля окрашены в зелёный
цвет; при действии на них щелочей
выпадает светло-зелёный осадок гидроксида
никеля (II):
Ni2+ + 2 OH– Ni(OH)2.
В отличие от гидроксидов железа (II) и кобальта (II), гидроксид никеля кислородом воздуха не окисляется. Однако действием сильных окислителей в щелочной среде на Ni(OH)2 можно получить гидроксид никеля (III) чёрно-бурого цвета:
2 Ni(OH)2 + Cl2 + 2 NaOH 2 Ni(OH)3 + 2 NaCl.
Ионы Ni3+ обладают ещё более ярко выраженной окислительной активностью, чем ионы Co3+.
Таким образом, в ряду Fe – Co – Ni отчётливо прослеживается уменьшение устойчивости степени окисления +3, и усиление окислительной активности соединений железа, кобальта и никеля в этой степени окисления.
Ион Ni2+ – типичный комплексообразователь; известно большое число комплексных соединений никеля (II), окрашенных в характерные цвета (аквакомплексы, амминокомплексы, цианидные комплексы):
Ni2+ + 6 H2O [Ni(H2O)6]2+ (зелёная окраска);
Ni2+ + 6 NH3 [Ni(NH3)6]2+ (фиолетовая окраска);
Ni2+ + 4 CN– [Ni(CN)4]2– (жёлтая окраска).
Известны также галогенидные комплексы никеля и комплексы с органическими лигандами, например, диметилглиоксимом. Диметилглиоксим образует с ионами никеля осадок комплексного соединения красного цвета. Эта реакция применяется в аналитической химии для обнаружения и количественного определения никеля.
