
- •Общая и неорганическая химия
- •Часть 2 свойства элементов и их соединений
- •Содержание
- •2.1 Введение.………………………….…..……………….………….30
- •3.1 Введение…………………………………………………………...41
- •4.1 Введение …………………………………………………………..47
- •5.1 Введение…………….….…………….………….….….….………56
- •6.1 Введение.…..…………………….………………………….……..70
- •7.1 Введение…………………………………………………………..77
- •9.1 Введение.…...…..………………………………….…..…….……83
- •Периодическая система химических элементов. Строение атомов и молекул
- •1.1 Введение
- •1.2 Постулаты теории Бора
- •1.3 Квантовомеханическое описание состояния электрона в атоме
- •1.3.1 Элементарные представления о квантовой механике
- •1.3.2 Главное квантовое число
- •1.3.3 Орбитальное квантовое число
- •1.3.4 Магнитное квантовое число
- •1.3.5 Атомные орбитали
- •1.3.6 Спиновое квантовое число
- •1.3.7 Принцип Паули
- •1.4 Периодическая система химических элементов
- •1.4.1 Элементы первого периода (h, He)
- •1 .4.2 Элементы второго периода (Li – Ne)
- •1.4.3 Элементы III периода (Na – Ar)
- •1.4.4 Элементы IV периода (k – Kr)
- •1.4.5 Элементы V, VI и VII периодов
- •1.5 Химическая связь и строение молекул
- •1.5.1 Механизмы образования ковалентной связи
- •1.5.2 Направленность ковалентной связи
- •1.5.3 Гибридизация атомных орбиталей
- •1.5.4 Металлическая связь
- •Комплексные соединения
- •2.1 Введение
- •2.2 Основные положения координационной теории
- •2.3 Природа химической связи в комплексных соединениях
- •2.4 Классификация комплексов
- •2.4.2 Классификация по типу лигандов
- •2.5 Номенклатура комплексных соединений
- •2.6 Диссоциация комплексных соединений в растворах
- •2.7 Образование и разрушение комплексов
- •2.8 Геометрия комплексных ионов
- •2.9 Изомерия комплексных соединений
- •Галогены
- •3.1 Введение
- •3.2 Физические свойства галогенов
- •3.3 Химические свойства галогенов
- •3.4 Получение галогенов
- •3.5 Водородные соединения галогенов
- •3.6 Получение галогеноводородов
- •3.7 Кислородсодержащие соединения галогенов
- •3.8 Применение галогенов
- •4.1 Введение
- •4.2 Кислород
- •4.3 Сера
- •4.3.1 Свойства серы – простого вещества
- •4.3.2 Сероводород, сульфиды, полисульфиды
- •4.3.3 Диоксид серы. Сернистая кислота
- •4.3.4 Триоксид серы. Серная кислота
- •4.3.5 Олеум. Дисерная кислота
- •4.3.6 Мононадсерная и пероксодисерная кислоты
- •4.3.7 Тиосерная кислота и тиосульфаты
- •4.4 Селен. Теллур
- •4.5 Сравнение свойств водородных соединений p-элементов VI группы
- •5.1 Введение
- •5.2 Азот
- •5.2.1 Свойства азота – простого вещества
- •5.2.2 Аммиак и соли аммония. Гидразин. Гидроксиламин
- •5.2.3 Оксиды азота
- •5.2.4 Азотистая кислота и её соли
- •5.2.5 Азотная кислота и её соли
- •5.2.6 «Царская водка»
- •5.3 Фосфор
- •5.3.1 Свойства фосфора – простого вещества
- •5.3.4 Соединение фосфора с водородом
- •5.3.5 Галогениды фосфора
- •5.4 Мышьяк
- •5.5 Сурьма
- •5.6 Висмут
- •6.1 Введение
- •6.2 Углерод и его соединения
- •6.2.1 Свойства углерода – простого вещества
- •6.2.2 Оксид углерода (IV). Угольная кислота и её соли
- •6.2.3 Оксид углерода (II)
- •6.2.4 Карбиды
- •6.2.5 Соединения углерода с азотом
- •6.3 Кремний
- •6.4 Германий. Олово. Свинец
- •7.1 Введение
- •7.3 Алюминий
- •7.4 Индий. Галлий. Таллий
- •Обзор химических свойств соединений d-элементов
- •9.1 Введение
- •9.4 Хром
- •9.5 Марганец
- •9.6 Элементы триады железа
- •9.6.1 Железо
- •9.6.2 Кобальт
- •9.6.3 Никель
- •Литература
- •Часть 2. Свойства элементов и их соединений
9.4 Хром
Э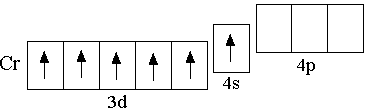 лектронная
конфигурация невозбуждённого атома
хрома – 3d54s1.
лектронная
конфигурация невозбуждённого атома
хрома – 3d54s1.
Для хрома в соединениях наиболее характерны степени окисления +2, +3 и +6.
Хром – металл, находящийся в ряду напряжений до водорода; поэтому металлический хром восстанавливает водород из разбавленных растворов HCl и H2SO4 . В холодной концентрированной азотной кислоте хром нерастворим и после обработки ею становится пассивным.
Хром образует три оксида: основной CrO, амфотерный Cr2O3, кислотный CrO3.
Соли двухвалентного хрома образуются при растворении металлического хрома в соляной или разбавленной серной кислотах. При добавлении к раствору соли хрома (II) выпадает жёлтый осадок гидроксида хрома (II), обладающего основными свойствами: Cr2+ + 2 OH– Cr(OH)2 .
Соединения хрома (II) неустойчивы, являются сильными восстановителями, окисляясь до соединений хрома (III), которые окрашены в различные тона зелёного цвета: 4 Cr(OH)2 + O2 + 2H2O 4Cr(OH)3 .
Соли
хрома (II) способны вытеснять водород
из кислот (![]() =
–0,41 В;
=
–0,41 В;
![]() =
0 В), а также постепенно разлагать воду
при отсутстствии другого окислителя
(
=
0 В), а также постепенно разлагать воду
при отсутстствии другого окислителя
(![]() =
–0,41 В при pH
= 7):
=
–0,41 В при pH
= 7):
2 CrCl2 + 2 HCl 2 CrCl3 + H2↑
2 CrCl2 + 2 H2O ⇆ 2 CrOHCl2 + H2↑ .
Таким образом, хлорид хрома (II), образующийся при растворении металлического хрома в соляной кислоте, можно рассматривать как промежуточное соединение, которое окисляется ионами водорода до хлорида хрома (III):
Cr + 2 HCl CrCl2 + H2
2 CrCl2 + 2 HCl 2 CrCl3 + H2;
суммарное уравнение:
2 Cr + 6 HCl 2 CrCl3 + 3 H2 .
Степень окисления хрома +3 является самой устойчивой, поэтому соединения хрома (III) не проявляют ярко выраженных окислительных или восстановительных свойств. Для восстановления соединений хрома (III) в соединения хрома (II) необходим сильный восстановитель, например, атомарный водород в момент выделения, который является промежуточным продуктом взаимодействия цинка с соляной кислотой:
2
HCl CrCl3
+ Zn
· 2 CrCl2
+ ZnCl2
.
CrCl3
+ Zn
· 2 CrCl2
+ ZnCl2
.
Сильные окислители (хлор, бром, пероксид водорода) окисляют в щелочной среде соединения хрома (III) до соединений хрома (VI):
2 Cr(OH)3 + 3 H2O2 + 4 NaOH 2 Na2CrO4 + 8 H2O .
Оксид и гидроксид хрома (III) – амфотерные соединения, поэтому они взаимодействуют со щелочами, образуя при сплавлении метахромиты, а в водном растворе – гидроксокомплексы: Cr2O3 + 2 NaOH 2 NaCrO2 + H2O;
Cr(OH)3 + 3 NaOH Na3[Cr(OH)6] .
Важнейшие соединения хрома (VI) – триоксид хрома, или хромовый ангидрид, и соли соответствующих ему кислот: хромовой H2CrO4 (хроматы) и дихромовой H2Cr2O7 (дихроматы). Сами кислоты существуют только в растворе и при попытке их выделения распадаются на ангидрид и воду. Хроматы окрашены в жёлтый цвет, дихроматы – в оранжевый. Хромат-ионы неустойчивы в кислой среде и превращаются при подкислении раствора в дихромат-ионы:
2CrO42– + 2H+ Cr2O72– + H2O 2K2CrO4 + H2SO4 K2Cr2O7 + K2SO4 + H2O
При этом жёлтая окраска раствора изменяется на оранжевую. Напротив, дихромат-ионы неустойчивы в щелочной среде и при подщелачивании раствора превращаются в хромат-ионы, вследствие чего оранжевый цвет раствора изменяется на жёлтый:
Cr2O72– + 2 OH– 2 CrO42– + H2O K2Cr2O7 + 2 KOH 2K2CrO4 + H2O
Дихроматы
в кислой среде проявляют сильные
окислительные свойства (![]() = + 1,33 В) и восстанавливаются до солей
хрома (III):
= + 1,33 В) и восстанавливаются до солей
хрома (III):
Cr2O72– + 14 H+ + 6 e– 2 Cr3+ + 7 H2O;
K2Cr2O7 + 14 HCl (конц.) 2 CrCl3 + 3 Cl2 + 2 KCl + 7 H2O;
K2Cr2O7 + 3 Na2SO3 + 4 H2SO4 Cr2(SO4)3 + 3 Na2SO4 + K2SO4 + 4 H2O.
