
- •Общая и неорганическая химия
- •Часть 2 свойства элементов и их соединений
- •Содержание
- •2.1 Введение.………………………….…..……………….………….30
- •3.1 Введение…………………………………………………………...41
- •4.1 Введение …………………………………………………………..47
- •5.1 Введение…………….….…………….………….….….….………56
- •6.1 Введение.…..…………………….………………………….……..70
- •7.1 Введение…………………………………………………………..77
- •9.1 Введение.…...…..………………………………….…..…….……83
- •Периодическая система химических элементов. Строение атомов и молекул
- •1.1 Введение
- •1.2 Постулаты теории Бора
- •1.3 Квантовомеханическое описание состояния электрона в атоме
- •1.3.1 Элементарные представления о квантовой механике
- •1.3.2 Главное квантовое число
- •1.3.3 Орбитальное квантовое число
- •1.3.4 Магнитное квантовое число
- •1.3.5 Атомные орбитали
- •1.3.6 Спиновое квантовое число
- •1.3.7 Принцип Паули
- •1.4 Периодическая система химических элементов
- •1.4.1 Элементы первого периода (h, He)
- •1 .4.2 Элементы второго периода (Li – Ne)
- •1.4.3 Элементы III периода (Na – Ar)
- •1.4.4 Элементы IV периода (k – Kr)
- •1.4.5 Элементы V, VI и VII периодов
- •1.5 Химическая связь и строение молекул
- •1.5.1 Механизмы образования ковалентной связи
- •1.5.2 Направленность ковалентной связи
- •1.5.3 Гибридизация атомных орбиталей
- •1.5.4 Металлическая связь
- •Комплексные соединения
- •2.1 Введение
- •2.2 Основные положения координационной теории
- •2.3 Природа химической связи в комплексных соединениях
- •2.4 Классификация комплексов
- •2.4.2 Классификация по типу лигандов
- •2.5 Номенклатура комплексных соединений
- •2.6 Диссоциация комплексных соединений в растворах
- •2.7 Образование и разрушение комплексов
- •2.8 Геометрия комплексных ионов
- •2.9 Изомерия комплексных соединений
- •Галогены
- •3.1 Введение
- •3.2 Физические свойства галогенов
- •3.3 Химические свойства галогенов
- •3.4 Получение галогенов
- •3.5 Водородные соединения галогенов
- •3.6 Получение галогеноводородов
- •3.7 Кислородсодержащие соединения галогенов
- •3.8 Применение галогенов
- •4.1 Введение
- •4.2 Кислород
- •4.3 Сера
- •4.3.1 Свойства серы – простого вещества
- •4.3.2 Сероводород, сульфиды, полисульфиды
- •4.3.3 Диоксид серы. Сернистая кислота
- •4.3.4 Триоксид серы. Серная кислота
- •4.3.5 Олеум. Дисерная кислота
- •4.3.6 Мононадсерная и пероксодисерная кислоты
- •4.3.7 Тиосерная кислота и тиосульфаты
- •4.4 Селен. Теллур
- •4.5 Сравнение свойств водородных соединений p-элементов VI группы
- •5.1 Введение
- •5.2 Азот
- •5.2.1 Свойства азота – простого вещества
- •5.2.2 Аммиак и соли аммония. Гидразин. Гидроксиламин
- •5.2.3 Оксиды азота
- •5.2.4 Азотистая кислота и её соли
- •5.2.5 Азотная кислота и её соли
- •5.2.6 «Царская водка»
- •5.3 Фосфор
- •5.3.1 Свойства фосфора – простого вещества
- •5.3.4 Соединение фосфора с водородом
- •5.3.5 Галогениды фосфора
- •5.4 Мышьяк
- •5.5 Сурьма
- •5.6 Висмут
- •6.1 Введение
- •6.2 Углерод и его соединения
- •6.2.1 Свойства углерода – простого вещества
- •6.2.2 Оксид углерода (IV). Угольная кислота и её соли
- •6.2.3 Оксид углерода (II)
- •6.2.4 Карбиды
- •6.2.5 Соединения углерода с азотом
- •6.3 Кремний
- •6.4 Германий. Олово. Свинец
- •7.1 Введение
- •7.3 Алюминий
- •7.4 Индий. Галлий. Таллий
- •Обзор химических свойств соединений d-элементов
- •9.1 Введение
- •9.4 Хром
- •9.5 Марганец
- •9.6 Элементы триады железа
- •9.6.1 Железо
- •9.6.2 Кобальт
- •9.6.3 Никель
- •Литература
- •Часть 2. Свойства элементов и их соединений
Обзор химических свойств соединений d-элементов
9.1 Введение
D-элементы, входящие в одну и ту же группу, образуют побочную подгруппу. Одна из особенностей химии элементов побочных подгрупп, заключается в том, что все d-элементы – металлы.
Как уже было показано в разделе 1.4.6 «Прогнозирование свойств элементов по положению в периодической таблице» лекции 1, при переходе от d-элементов IV периода к d-элементам V периода увеличение радиуса атома меньшее, чем у элементов главных подгрупп. При переходе от d-элементов V периода к d-элементам VI периода радиус атома практически не изменяется или даже уменьшается. Такой характер изменения радиусов атомов в побочных подгруппах при одновременном увеличении заряда ядра приводит к увеличению энергии ионизации. Поэтому в побочных подгруппах с увеличением порядкового номера элемента уменьшаются металлические свойства, и ослабляются основные свойства оксидов и их гидратных форм. В отличие от главных подгрупп, в побочных подгруппах с увеличением порядкового номера элемента увеличивается устойчивость высшей степени окисления.
9.2 D-металлы I группы
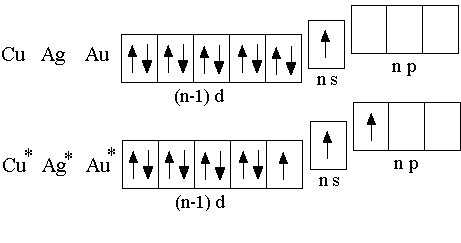 Электронная
конфигурация атомов меди, серебра и
золота в невозбуждённом состоянии –
(n–1)d10ns1,
в возбуждённом – (n–1)d9ns1np1.
Поэтому теоретически возможны
степени окисления +1, +2 или +3 рассматриваемых
элементов в соединениях. Однако не все
эти степени окисления являются
устойчивыми.
Электронная
конфигурация атомов меди, серебра и
золота в невозбуждённом состоянии –
(n–1)d10ns1,
в возбуждённом – (n–1)d9ns1np1.
Поэтому теоретически возможны
степени окисления +1, +2 или +3 рассматриваемых
элементов в соединениях. Однако не все
эти степени окисления являются
устойчивыми.
Самой устойчивой степенью окисления меди является +2. Соединения меди в степени окисления +1 проявляют восстановительные свойства и легко окисляются до соединений Cu+2. Соединения трёхвалентной меди неустойчивы.
Для серебра характерна только одна устойчивая степень окисления +1; степени окисления +2 и +3 крайне неустойчивы.
Золото образует соединения, в которых оно одновалентно или трёхвалентно; степень окисления +2 для него нехарактерна. В отличие от меди и серебра, степень окисления +3 для золота наиболее устойчива.
В ряду напряжений медь, серебро и золото стоят после водорода и не восстанавливают водород из соляной и разбавленной серной кислот. Однако, в присутствии кислорода или других окислителей (например, пероксида водорода) медь растворяется в этих кислотах с образованием соответствующих солей двухвалентной меди: 2 Cu + 4 HCl + O2 2 CuCl2 + 2 H2O .
Соединения меди (II) проявляют окислительные свойства, восстанавливаясь до соединений меди (I). Так, кипячением раствора соли меди (II) с металлической медью можно получить соединение одновалентной меди:
CuCl2 + Cu 2 CuCl .
Ион Cu2+ окисляет иодид-ион до свободного йода:
2 CuSO4 + 4 KI 2 CuI + I2 + 2 K2SO4
(![]() =
+0,86 В;
=
+0,86 В;
![]() =
+0,55 В).
=
+0,55 В).
Эта реакция применяется для количественного определения ионов Cu2+.
При восстановлении гидроксида меди (II) формальдегидом образуется оксид меди (I): 4 Cu(OH)2 + HCHO 2 Cu2O + CO2 + 5 H2O .
Соединения меди (I) легко окисляются до соединений меди (II) или диспропорционируют: 4 CuCl + O2 + 4 HCl 4 CuCl2 + 2 H2O ;
Cu2O + H2SO4 Cu + CuSO4 + H2O;
2 CuCl Cu + CuCl2 .
Окислением гидроксида меди (II) в щелочной среде можно получить очень неустойчивые соединения меди (III) – купраты (например, NaCuO2 – купрат натрия): 2 Cu(OH)2 + NaClO + 2 NaOH 2 NaCuO2 + NaCl + 3 H2O.
Купраты – очень сильные окислители и легко восстанавливаются до соединений меди (II): 2 NaCuO2 + 8 HCl 2 CuCl2 + Cl2 + 2 NaCl + 4 H2O.
В отличие от соединений меди, соединения трёхвалентного золота более устойчивы. Поэтому соединения золота (I) легко окисляются до соединений золота (III) или диспропорционируют по схеме:
Au+1 Au0 + Au+3.
Гидроксид золота (III) обладает амфотерными свойствами и легко растворяется в щелочах с образованием гидроксоауратов:
Au(OH)3 + NaOH Na[Au(OH)4] .
Амфотерность же гидроксида меди (II) выражена крайне слабо, и реакция образования гидроксокупратов протекает в незначительной степени в очень концентрированных растворах щелочей: Cu(OH)2 + 2 NaOH ⇆ Na2[Cu(OH)4] .
Большинство солей серебра малорастворимо в воде; хорошо растворим нитрат серебра.
При действии щелочей на растворы солей серебра образуется не гидроксид серебра, а бурый осадок оксида серебра:
2 AgNO3 + 2 NaOH Ag2O + 2 NaNO3 + H2O .
Особенностью d-металлов, в том числе меди, серебра и золота, является их способность к образованию комплексных соединений. Для соединений меди и серебра характерно образование амминокомплексов. При этом многие малорастворимые в воде соединения серебра и меди, например, AgCl, Ag2O, CuCl, Cu(OH)2 могут быть переведены в растворимое состояние:
Ag2O + 4 NH3 + H2O 2 [Ag(NH3)2]OH;
AgCl + 2 NH3 [Ag(NH3)2]Cl;
CuCl + 2 NH4OH [Cu(NH3)2]Cl + 2 H2O .
Cu(OH)2 + 4 NH4OH [Cu(NH3)4](OH)2 + 4 H2O .
Из ацидокомплексов для рассматриваемых элементов характерны галогенидные и цианидные комплексы. Так, нерастворимые в воде AgCl и CuCl заметно растворяются в концентрированном растворе HCl:
CuCl + HCl ⇆ H[CuCl2].
При разбавлении раствора комплекс разрушается, и вновь выпадает осадок галогенида серебра или меди (I).
Концентрированные растворы хлорида меди (II) имеют зелёную окраску, вследствие образования комплексных ионов [CuCl4]2– :
Cu2+ + 4 Cl– ⇆ [CuCl4]2– .
При разбавлении раствора хлоридный комплекс разрушается, и зелёная окраска меняется на голубую, характерную для аквакомплексов меди (II):
[CuCl4]2– + 4 H2O ⇆ [Cu(H2O)4]2+ + 4 Cl– .
Для золота также характерно образование хлоридных комплексов. Например, при растворении золота в «царской водке» также образуется комплексное соединение золота (III) – H[AuCl4] – тетрахлорозолотая кислота (см. раздел 5.2.6 «Царская водка» лекции 5).
Особенно устойчивыми являются цианидные комплексы d-металлов. Нерастворимые в воде CuCN, AgCN, AuCN растворяются в избытке раствора цианида калия или натрия с образованием комплексного соединения:
CuCN + KCN K[Cu(CN)2] .
Цианидные комплексы меди, серебра, и золота характерны для степени окисления +1 этих металлов. Металл в более высокой степени окисления способен окислить цианид-ионы: 2 CuSO4 + 4 KCN 2 CuCN + (CN)2 + 2 K2SO4 .
Металлические медь, серебро и золото способны в присутствии кислорода растворяться в щелочных растворах цианидов:
4 Au + O2 + 8 KCN + 2 H2O 4 K[Au(CN)2] + 4 KOH .
Эта реакция используется для растворения самородного золота и отделения его от пустой породы.
Важная в практическом отношении реакция растворения галогенидов серебра вследствие образования тиосульфатного комплекса применяется в фотографии: AgBr + 2 Na2S2O3 Na3[Ag(S2O3)2] + NaBr .
9.3 D-металлы II группы
D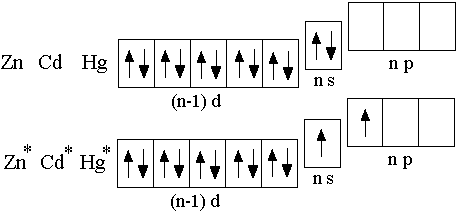 -металлы
II группы – цинк, кадмий, ртуть –
характеризуются наличием двух электронов
в наружном слое атома: электронная
конфигурация – (n–1)d10ns2
, поэтому в своих соединениях эти
элементы двухвалентны.
Цинк
и кадмий имеют постоянную степень
окисления +2. Эта же степень окисления
характерна и для ртути, однако ртуть
может образовывать соединения типа
Cl–Hg–Hg–Cl , в которых она двухвалентна,
но имеет степень окисления +1. Диссоциация
таких соединений в растворе протекает
с образованием иона Hg22+:
-металлы
II группы – цинк, кадмий, ртуть –
характеризуются наличием двух электронов
в наружном слое атома: электронная
конфигурация – (n–1)d10ns2
, поэтому в своих соединениях эти
элементы двухвалентны.
Цинк
и кадмий имеют постоянную степень
окисления +2. Эта же степень окисления
характерна и для ртути, однако ртуть
может образовывать соединения типа
Cl–Hg–Hg–Cl , в которых она двухвалентна,
но имеет степень окисления +1. Диссоциация
таких соединений в растворе протекает
с образованием иона Hg22+:
Hg2(NO3)2 Hg22+ + 2 NO3– .
Цинк и кадмий – активные металлы, стоящие в ряду напряжений до водорода. Цинк и кадмий схожи по своим химическим свойствам, с тем лишь различием, что гидроксид и оксид кадмия не являются амфотерными соединениями. Как и для d-элементов I группы для кадмия и цинка характерны реакции образования амминокомплексов, цианидных комплексов, аквакомплексов, а для цинка ещё и гидроксокомплексов. Цинк как амфотерный металл способен растворяться в растворах щелочей, проявляя свойства сильного восстановителя:
Zn + 2 NaOH + 2 H2O Na2[Zn(OH)4] + H2 .
Порошкообразный цинк восстанавливает нитрат- и нитрит-ионы в щелочном растворе до аммиака (см. также раздел 5.2.4 «Азотистая кислота и её соли» лекции 5): 4 Zn + KNO3 + 7 KOH + 6 H2O NH3 + 4 K2[Zn(OH)4]
3 Zn + KNO2 + 5 KOH + 5 H2O NH3 + 3 K2[Zn(OH)4].
Ртуть – единственный металл, который при обычных условиях находится в жидком состоянии. Ртуть способна растворять в себе многие металлы, образуя с ними сплавы – амальгамы.
Одна из особенностей химии ртути заключается в том, что при действии щелочей на растворы солей ртути, как и в случае серебра, образуются не гидроксиды, а оксиды ртути. Гидроксиды ртути не получены:
Hg22+ + 2 OH– Hg2O + H2O; Hg2+ + 2 OH– HgO + H2O .
Нитрат ртути (I) Hg2(NO3)2 – одна из немногих растворимых солей ртути в степени окисления +1 – получается действием холодной разбавленной азотной кислоты на избыток ртути:
6 Hg + 8 HNO3 (разб.) 3 Hg2(NO3)2 + 2 NO + 4 H2O .
Используя раствор Hg2(NO3)2, можно обменной реакцией получить любую малорастворимую соль ртути (I), например, каломель Hg2Cl2:
Hg22+ + 2 Cl– Hg2Cl2 .
Нитрат ртути (II) образуется при взаимодействии ртути с избытком горячей концентрированной HNO3: Hg + 4 HNO3 (конц.) Hg(NO3)2 + 2 NO2 + 2 H2O .
Хлорид ртути (II), или сулема, образуется при непосредственном взаимодействии простых веществ или нагреванием сульфата ртути (II) с хлоридом натрия; образующаяся сулема сублимируется; от последнего слова она и получила своё название:
H
t
Сулема – одна из немногих солей, которая в водном растворе слабо диссоциирована. Сулема, как и все растворимые соли ртути, – сильный яд.
Соединения Hg22+ в зависимости от условий реакции проявляют как окислительные, так и восстановительные свойства:
Hg2Cl2 + Cl2 2 HgCl2; Hg2Cl2 + SnCl2 2 Hg + SnCl4 .
Соединения ртути в степени окисления +1 склонны к диспропорционированию по схеме: Hg22+ Hg0 + Hg2+.
Соединения ртути (II) обладают окислительными свойствами, например, Hg2Cl2 можно также получить, нагревая металлическую ртуть с сулемой:
HgCl2 + Hg Hg2Cl2 .
Ион ртути Hg2+ является комплексообразователем в реакциях образования ацидокомплексов, из которых наиболее прочными являются цианидные и галогенидные комплексы. Например, малорастворимые в воде осадки цианида и иодида ртути (II) способны растворяться в избытке растворов цианида и иодида калия с образованием комплексных соединений:
Hg(NO3)2 + 2 KCN Hg(CN)2 + 2 KNO3 HgCl2 + 2 KI HgI2 + 2 KCl;
Hg(CN)2 + 2 KCN K2[Hg(CN)4] HgI2 + 2 KI K2[HgI4] .
