
- •Общая и неорганическая химия
- •Часть 2 свойства элементов и их соединений
- •Содержание
- •2.1 Введение.………………………….…..……………….………….30
- •3.1 Введение…………………………………………………………...41
- •4.1 Введение …………………………………………………………..47
- •5.1 Введение…………….….…………….………….….….….………56
- •6.1 Введение.…..…………………….………………………….……..70
- •7.1 Введение…………………………………………………………..77
- •9.1 Введение.…...…..………………………………….…..…….……83
- •Периодическая система химических элементов. Строение атомов и молекул
- •1.1 Введение
- •1.2 Постулаты теории Бора
- •1.3 Квантовомеханическое описание состояния электрона в атоме
- •1.3.1 Элементарные представления о квантовой механике
- •1.3.2 Главное квантовое число
- •1.3.3 Орбитальное квантовое число
- •1.3.4 Магнитное квантовое число
- •1.3.5 Атомные орбитали
- •1.3.6 Спиновое квантовое число
- •1.3.7 Принцип Паули
- •1.4 Периодическая система химических элементов
- •1.4.1 Элементы первого периода (h, He)
- •1 .4.2 Элементы второго периода (Li – Ne)
- •1.4.3 Элементы III периода (Na – Ar)
- •1.4.4 Элементы IV периода (k – Kr)
- •1.4.5 Элементы V, VI и VII периодов
- •1.5 Химическая связь и строение молекул
- •1.5.1 Механизмы образования ковалентной связи
- •1.5.2 Направленность ковалентной связи
- •1.5.3 Гибридизация атомных орбиталей
- •1.5.4 Металлическая связь
- •Комплексные соединения
- •2.1 Введение
- •2.2 Основные положения координационной теории
- •2.3 Природа химической связи в комплексных соединениях
- •2.4 Классификация комплексов
- •2.4.2 Классификация по типу лигандов
- •2.5 Номенклатура комплексных соединений
- •2.6 Диссоциация комплексных соединений в растворах
- •2.7 Образование и разрушение комплексов
- •2.8 Геометрия комплексных ионов
- •2.9 Изомерия комплексных соединений
- •Галогены
- •3.1 Введение
- •3.2 Физические свойства галогенов
- •3.3 Химические свойства галогенов
- •3.4 Получение галогенов
- •3.5 Водородные соединения галогенов
- •3.6 Получение галогеноводородов
- •3.7 Кислородсодержащие соединения галогенов
- •3.8 Применение галогенов
- •4.1 Введение
- •4.2 Кислород
- •4.3 Сера
- •4.3.1 Свойства серы – простого вещества
- •4.3.2 Сероводород, сульфиды, полисульфиды
- •4.3.3 Диоксид серы. Сернистая кислота
- •4.3.4 Триоксид серы. Серная кислота
- •4.3.5 Олеум. Дисерная кислота
- •4.3.6 Мононадсерная и пероксодисерная кислоты
- •4.3.7 Тиосерная кислота и тиосульфаты
- •4.4 Селен. Теллур
- •4.5 Сравнение свойств водородных соединений p-элементов VI группы
- •5.1 Введение
- •5.2 Азот
- •5.2.1 Свойства азота – простого вещества
- •5.2.2 Аммиак и соли аммония. Гидразин. Гидроксиламин
- •5.2.3 Оксиды азота
- •5.2.4 Азотистая кислота и её соли
- •5.2.5 Азотная кислота и её соли
- •5.2.6 «Царская водка»
- •5.3 Фосфор
- •5.3.1 Свойства фосфора – простого вещества
- •5.3.4 Соединение фосфора с водородом
- •5.3.5 Галогениды фосфора
- •5.4 Мышьяк
- •5.5 Сурьма
- •5.6 Висмут
- •6.1 Введение
- •6.2 Углерод и его соединения
- •6.2.1 Свойства углерода – простого вещества
- •6.2.2 Оксид углерода (IV). Угольная кислота и её соли
- •6.2.3 Оксид углерода (II)
- •6.2.4 Карбиды
- •6.2.5 Соединения углерода с азотом
- •6.3 Кремний
- •6.4 Германий. Олово. Свинец
- •7.1 Введение
- •7.3 Алюминий
- •7.4 Индий. Галлий. Таллий
- •Обзор химических свойств соединений d-элементов
- •9.1 Введение
- •9.4 Хром
- •9.5 Марганец
- •9.6 Элементы триады железа
- •9.6.1 Железо
- •9.6.2 Кобальт
- •9.6.3 Никель
- •Литература
- •Часть 2. Свойства элементов и их соединений
7.3 Алюминий
Алюминий – очень активный серебристо-белый металл. Поверхность алюминия покрыта прочной оксидной плёнкой, которая защищает его от дальнейшего окисления. Алюминий, лишённый оксидной плёнки, способен вытеснять водород даже из воды: 2 Al + 6 H2O 2 Al(OH)3 + 3 H2 ,
но реально такие реакции протекают в щелочных средах.
Оксид алюминия Al2O3 и его гидроксид Al(OH)3 растворяются в кислотах с образованием катионов Al3+ и взаимодействуют со щелочами. При сплавлении со щелочами образуются метаалюминаты – производные метаалюминиевой кислоты: Al2O3 + 2 KOH 2 KAlO2 + H2O ;
при взаимодействии с раствором щёлочи образуются гидроксокомплексы Na[Al(OH)4] или Na3[Al(OH)6]:
Al2O3 + 2 NaOH + 3 H2O 2 Na[Al(OH)4];
Al(OH)3 + NaOH Na[Al(OH)4];
Al(OH)3 + 3 NaOH Na3[Al(OH)6] .
Гидроксокомплексы также образуются при окислении металлического алюминия водными растворами щелочей:
2 Al + 2 NaOH + 6 H2O 2 Na[Al(OH)4] + 3 H2.
7.4 Индий. Галлий. Таллий
Индий, галлий и таллий в свободном состоянии представляют собой серебристо-белые металлы с низкими температурами плавления, устойчивые к окислению кислородом воздуха. Воду они не разлагают, но легко растворяются в кислотах, а галлий и индий – также и в щелочах, т.е. химия галлия и индия напоминает химию алюминия.
Таллий отличается тем, что для него более характерны соединения, в которых его степень окисления равна +1.
Соединения таллия (I) сходны, с одной стороны, с соединениями щелочных металлов, с другой – с соединениями серебра. Так, Tl2O энергично соединяется с водой, образуя TlOH – сильное, хорошо растворимое в воде основание. Большинство солей таллия (I) хорошо растворимо в воде, но соли галогеноводородных кислот, как и соответствующие соли серебра, нерастворимы и отличаются светочувствительностью, однако, TlF, как и AgF, хорошо растворим в воде.
Поскольку
в главных подгруппах с увеличением
порядкового номера элемента устойчивость
высшей степени окисления уменьшается,
соединения трёхвалентного таллия, в
отличие от всех остальных элементов
подгруппы, проявляют достаточно сильные
окислительные свойства, превращаясь
в соединения таллия (I): Tl3+
+ 2 e–
Tl+
![]() =
+ 1,25 В .
=
+ 1,25 В .
Л Е К Ц И Я 8
S-МЕТАЛЛЫ I и II ГРУПП
 М
М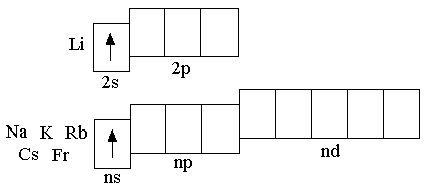 еталлы
главной подгруппы первой группы –
литий, натрий, калий, рубидий, цезий и
франций – называются щелочными
металлами.
Главную
подгруппу второй группы образуют
бериллий, магний, кальций, стронций
барий и радий. Кальций, стронций и барий
имеют исторически сложившееся название
– щелочноземельные металлы. Все эти
элементы обладают ярко выраженными
металлическими свойствами; бериллий
– амфотерный металл.
еталлы
главной подгруппы первой группы –
литий, натрий, калий, рубидий, цезий и
франций – называются щелочными
металлами.
Главную
подгруппу второй группы образуют
бериллий, магний, кальций, стронций
барий и радий. Кальций, стронций и барий
имеют исторически сложившееся название
– щелочноземельные металлы. Все эти
элементы обладают ярко выраженными
металлическими свойствами; бериллий
– амфотерный металл.
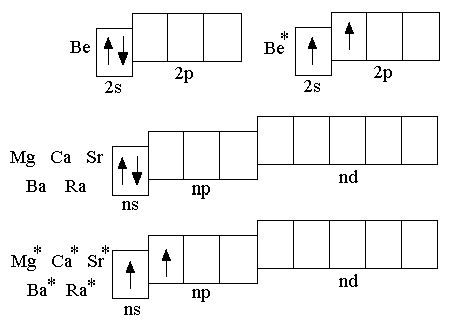
На внешнем энергетическом уровне атомов Li, Na, K, Rb, Cs, Fr на сравнительно большом удалении от ядра находится один электрон, который атомы щелочных металлов довольно легко отдают, превращаясь в однозарядные катионы; этим объясняется очень высокая химическая активность щелочных металлов. Увеличение радиусов атомов с увеличением порядкового номера элементов в главной подгруппе приводит к увеличению химической активности в ряду Li – Na – K – Rb – Cs – Fr. Аналогичное увеличение химической активности s-металлов II группы наблюдается в ряду Be – Mg – Ca – – Sr –Ba – Ra.
Атомы s-металлов II группы имеют на внешнем уровне два электрона и сравнительно легко их теряют, превращаясь в двухзарядные катионы, поэтому в отношении химической активности эти элементы лишь немного уступают щелочным металлам.
Общим способом получения щелочных, щелочноземельных металлов, магния и бериллия является электролиз расплавов их солей (обычно хлоридов).
Щелочные металлы характеризуются незначительной твёрдостью, малой плотностью и низкими температурами плавления. S-металлы второй группы имеют большую, чем щелочные металлы, твёрдость и довольно высокие температуры плавления.
Все щелочные металлы энергично соединяются с кислородом; рубидий и цезий самовоспламеняются на воздухе, калий, натрий и литий загораются при небольшом нагревании. При этом только литий образует оксид:
4 Li + O2 2 Li2O .
Натрий, взаимодействуя с кислородом, образует преимущественно пероксид, а калий, рубидий и цезий надпероксиды:
2 Na + O2 Na2O2 ; K + O2 KO2 .
Восстановлением пероксидов и надпероксидов избытком щелочного металла можно получить оксид: Na2O2 + 2 Na 2 Na2O .
При сжигании щелочноземельных металлов, магния и бериллия образуются оксиды: 2 Ca + O2 2 CaO;
2 Mg + O2 2 MgO.
Оксиды щелочных и щелочноземельных металлов взаимодействуют с водой с образованием гидроксидов: Na2O + H2O 2 NaOH .
Пероксиды и надпероксиды полностью гидролизуются водой с образованием щёлочи: Na2O2 + 2 HOH 2 NaOH + H2O2 ;
2 KO2 + 2 HOH 2 KOH + O2 + H2O2 .
Пероксиды щелочных и щелочноземельных металлов способны взаимодействовать с углекислым газом с выделением кислорода, что позволяет использовать их в системах регенерации воздуха в помещениях с замкнутым объёмом (например, на подводных лодках, в космических кораблях):
2 BaO2 + 2 CO2 2 BaCO3 + O2 .
Щелочные и щелочноземельные металлы также реагируют с другими неметаллами: галогенами, серой, азотом, водородом. При этом образуются соответственно галогениды, сульфиды, нитриды и гидриды.
Щелочноземельные металлы уже при комнатной температуре медленно взаимодействуют с азотом, образуя нитриды. Из щелочных металлов при комнатной температуре нитрид образует литий; нитриды остальных щелочных металлов образуются при нагревании. Водой нитриды полностью гидролизуются с образованием аммиака и соответствующего основания (см. также раздел 5.2.2 «Аммиак и соли аммония. Гидразин. Гидроксиламин» лекции 5).
Легко отдавая в химических реакциях валентные электроны, щелочные металлы являются самыми энергичными восстановителями. Их восстановительная способность настолько велика, что они могут восстанавливать даже атомы водорода, превращая их в отрицательно заряженные ионы H– и образуя при нагревании с водородом гидриды: 2 Na + H2 2 NaH .
Аналогичным образом можно получить и гидриды щелочноземельных металлов. Гидриды магния и бериллия непосредственно из простых веществ не образуются, но их можно получить косвенным путём.
Гидриды полностью разлагаются водой с образованием водорода и гидроксида металла: CaH2 + 2 HOH Ca(OH)2 + 2 H2 .
В ряду напряжений щелочные, щелочноземельные металлы, магний и бериллий стоят далеко впереди водорода и способны восстанавливать водород из воды: 2 Na + 2 HOH 2 NaOH + H2 ; Ca + 2 HOH Ca(OH)2 + H2 .
Взаимодействие бериллия и магния с водой протекает очень медленно вследствие малой растворимости образующихся гидроксидов магния и бериллия.
Be(OH)2 – единственный в подгруппе амфотерный гидроксид. По своим химическим свойствам бериллий в значительной степени сходен с алюминием. Это сходство, носящее название «диагонального», наблюдается не только у бериллия и алюминия, но и у некоторых других элементов. Например, бор по многим химическим свойствам сходен с кремнием, а литий с магнием.
Нерастворимый в воде гидроксид бериллия легко растворяется в растворах щелочей с образованием гидроксокомплексов, а при сплавлении образует безводные бериллаты: Be(OH)2 + 2 NaOH Na2[Be(OH)4] ;
Be(OH)2 + 2 NaOH Na2BeO2 + 2 H2O .
Бериллий способен образовывать и другие комплексные соединения, в которых он имеет координационное число равное 4. Так, при взаимодействии фторида бериллия с фторидами щелочных металлов образуются комплексные фторобериллаты: BeF2 + 2 KF K2[BeF4] .
В водных растворах ион бериллия, по-видимому, находится в виде аквакомплексов [Be(H2O)4]2+ .
Природная вода, которая содержит в растворённом состоянии большое количество солей кальция и магния, называется жёсткой водой в противоположность мягкой воде, содержащей мало солей кальция и магния или совсем не содержащей их. Суммарное содержание ионов Ca2+ и Mg2+ в воде называется общей жёсткостью. Она подразделяется на карбонатную и некарбонатную жёсткость. Карбонатная жёсткость обусловлена присутствием в воде гидрокарбонатов кальция и магния, некарбонатная жёсткость – присутствием солей сильных кислот: MgCl2, CaCl2, MgSO4 и др. При кипячении воды, обладающей карбонатной жёсткостью, гидрокарбонаты разлагаются с образованием осадка нерастворимых карбонатов (накипь): Сa(HCO3)2 СaCO3 + H2O + CO2.
Поэтому карбонатную жёсткость называют также временной (или устранимой), а некарбонатную – постоянной жёсткостью.
Л Е К Ц И Я 9
