
- •Общая и неорганическая химия
- •Часть 2 свойства элементов и их соединений
- •Содержание
- •2.1 Введение.………………………….…..……………….………….30
- •3.1 Введение…………………………………………………………...41
- •4.1 Введение …………………………………………………………..47
- •5.1 Введение…………….….…………….………….….….….………56
- •6.1 Введение.…..…………………….………………………….……..70
- •7.1 Введение…………………………………………………………..77
- •9.1 Введение.…...…..………………………………….…..…….……83
- •Периодическая система химических элементов. Строение атомов и молекул
- •1.1 Введение
- •1.2 Постулаты теории Бора
- •1.3 Квантовомеханическое описание состояния электрона в атоме
- •1.3.1 Элементарные представления о квантовой механике
- •1.3.2 Главное квантовое число
- •1.3.3 Орбитальное квантовое число
- •1.3.4 Магнитное квантовое число
- •1.3.5 Атомные орбитали
- •1.3.6 Спиновое квантовое число
- •1.3.7 Принцип Паули
- •1.4 Периодическая система химических элементов
- •1.4.1 Элементы первого периода (h, He)
- •1 .4.2 Элементы второго периода (Li – Ne)
- •1.4.3 Элементы III периода (Na – Ar)
- •1.4.4 Элементы IV периода (k – Kr)
- •1.4.5 Элементы V, VI и VII периодов
- •1.5 Химическая связь и строение молекул
- •1.5.1 Механизмы образования ковалентной связи
- •1.5.2 Направленность ковалентной связи
- •1.5.3 Гибридизация атомных орбиталей
- •1.5.4 Металлическая связь
- •Комплексные соединения
- •2.1 Введение
- •2.2 Основные положения координационной теории
- •2.3 Природа химической связи в комплексных соединениях
- •2.4 Классификация комплексов
- •2.4.2 Классификация по типу лигандов
- •2.5 Номенклатура комплексных соединений
- •2.6 Диссоциация комплексных соединений в растворах
- •2.7 Образование и разрушение комплексов
- •2.8 Геометрия комплексных ионов
- •2.9 Изомерия комплексных соединений
- •Галогены
- •3.1 Введение
- •3.2 Физические свойства галогенов
- •3.3 Химические свойства галогенов
- •3.4 Получение галогенов
- •3.5 Водородные соединения галогенов
- •3.6 Получение галогеноводородов
- •3.7 Кислородсодержащие соединения галогенов
- •3.8 Применение галогенов
- •4.1 Введение
- •4.2 Кислород
- •4.3 Сера
- •4.3.1 Свойства серы – простого вещества
- •4.3.2 Сероводород, сульфиды, полисульфиды
- •4.3.3 Диоксид серы. Сернистая кислота
- •4.3.4 Триоксид серы. Серная кислота
- •4.3.5 Олеум. Дисерная кислота
- •4.3.6 Мононадсерная и пероксодисерная кислоты
- •4.3.7 Тиосерная кислота и тиосульфаты
- •4.4 Селен. Теллур
- •4.5 Сравнение свойств водородных соединений p-элементов VI группы
- •5.1 Введение
- •5.2 Азот
- •5.2.1 Свойства азота – простого вещества
- •5.2.2 Аммиак и соли аммония. Гидразин. Гидроксиламин
- •5.2.3 Оксиды азота
- •5.2.4 Азотистая кислота и её соли
- •5.2.5 Азотная кислота и её соли
- •5.2.6 «Царская водка»
- •5.3 Фосфор
- •5.3.1 Свойства фосфора – простого вещества
- •5.3.4 Соединение фосфора с водородом
- •5.3.5 Галогениды фосфора
- •5.4 Мышьяк
- •5.5 Сурьма
- •5.6 Висмут
- •6.1 Введение
- •6.2 Углерод и его соединения
- •6.2.1 Свойства углерода – простого вещества
- •6.2.2 Оксид углерода (IV). Угольная кислота и её соли
- •6.2.3 Оксид углерода (II)
- •6.2.4 Карбиды
- •6.2.5 Соединения углерода с азотом
- •6.3 Кремний
- •6.4 Германий. Олово. Свинец
- •7.1 Введение
- •7.3 Алюминий
- •7.4 Индий. Галлий. Таллий
- •Обзор химических свойств соединений d-элементов
- •9.1 Введение
- •9.4 Хром
- •9.5 Марганец
- •9.6 Элементы триады железа
- •9.6.1 Железо
- •9.6.2 Кобальт
- •9.6.3 Никель
- •Литература
- •Часть 2. Свойства элементов и их соединений
7.1 Введение
Э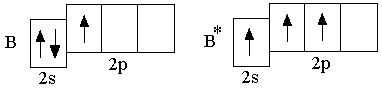 лементы
главной подгруппы третьей группы –
бор, алюминий, индий и таллий –
характеризуются наличием трёх электронов
в наружном электронном слое атома.
Электронная конфигурация атомов в
невозбуждённом состоянии ns2np1.
Поэтому, с теоретической точки зрения,
рассматриваемые элементы могли бы в
своих соединениях проявлять валентность
I и III. Однако для всех этих элементов,
за исключением таллия, наиболее
характерно трёхвалентное состояние;
таллий в соединениях может быть как
трёхвалентен, так и одновалентен.
лементы
главной подгруппы третьей группы –
бор, алюминий, индий и таллий –
характеризуются наличием трёх электронов
в наружном электронном слое атома.
Электронная конфигурация атомов в
невозбуждённом состоянии ns2np1.
Поэтому, с теоретической точки зрения,
рассматриваемые элементы могли бы в
своих соединениях проявлять валентность
I и III. Однако для всех этих элементов,
за исключением таллия, наиболее
характерно трёхвалентное состояние;
таллий в соединениях может быть как
трёхвалентен, так и одновалентен.
В ряду B–Al–Ga–In–Tl усиливаются металлические свойства простых веществ и основные свойства оксидов и их гидратных форм. Из рассматриваемых элементов только бор является неметаллом; B2O3 является кислотным оксидом, ангидридом борной кислоты (H3BO3 – орто-форма; HBO2 – мета-форма борной кислоты).
О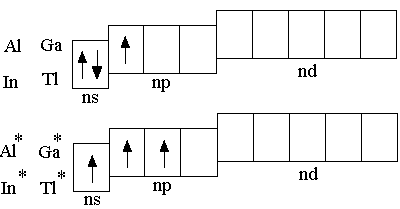 ксиды
алюминия, галлия и индия – амфотерны,
а оксиды таллия имеют основной характер.
ксиды
алюминия, галлия и индия – амфотерны,
а оксиды таллия имеют основной характер.
7.2 Бор
Свободный бор представляет собой кристаллическое вещество чёрного цвета, по твёрдости уступающее лишь алмазу. Бор можно получить в виде аморфного порошка восстановлением борного ангидрида магнием:
B2O3 + 3 Mg 2 B + 3 MgO ,
а также термическим разложением галогенидов и водородных соединений бора.
Бор, как неметалл, при высокой температуре взаимодействует со многими металлами, образуя бориды, например, Mg3B2. При действии соляной кислоты на Mg3B2 получаются различные бороводороды (бораны) B2H6 (газ), B4H10 (жидкость), B10H14 (твёрдое вещество) и другие. Пары тетраборана (B4H10) воспламеняются на воздухе; диборан (B2H6) более устойчив. Водой все бороводороды гидролизуются с образованием водорода и борной кислоты:
B2H6 + 6 H2O 2 H3BO3 + 6 H2 .
Для бора характерны солеобразные соединения типа Li[BH4], Na[BH4] – тетрагидридобораты (другие названия – боргидриды, боранаты). Эти соединения по своему строению аналогичны фтороборатам Li[BF4], Na[BF4]. Водород в анионе [BH4]– имеет степень окисления минус 1, вследствие чего все боргидриды – сильные восстановители.
Оксид бора представляет собой бесцветную, хрупкую, стеклообразную массу; может быть получен непосредственным соединением бора с кислородом или прокаливанием борной кислоты. С водой борный ангидрид взаимодействует с образованием метаборной и ортоборной кислот.
H2O
H2O
B
нагревание
нагревание

При нагревании ортоборная кислота теряет воду, превращаясь в метаборную кислоту и далее – в оксид бора.
H3BO3 – очень слабая кислота (K1 = 610–10 , K2 = 210–13 , K3 = 210–14); она представляет собой белые кристаллы, растворимые в горячей воде.
Особенностью борной кислоты является то, что при её нейтрализации раствором щёлочи образуется соль не ортоборной, а тетраборной кислоты H2B4O7 , являющейся представителем полиборных кислот:
4 H3BO3 + 2 NaOH Na2B4O7 + 7 H2O .
Соли тетраборной кислоты называются тетрабораты. Графическую формулу тетрабората натрия можно представить следующим образом:
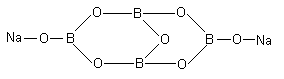
Десятиводный кристаллогидрат тетрабората натрия Na2B4O710H2O называется бура.
При действии на раствор тетрабората натрия серной кислоты образуется ортоборная кислота, которая выпадает в осадок при охлаждении раствора, т.к. малорастворима в холодной воде:
Na2B4O7 + H2SO4 + 5 H2O Na2SO4 + 4 H3BO3 .
Безводные метабораты можно получить сплавлением борного ангидрида или борной кислоты с оксидами металлов: CaO + B2O3 Ca(BO2)2 .
Бура в расплавленном состоянии также растворяет оксиды различных металлов с образованием солей метаборной кислоты, из которых многие окрашены в цвета, характерные для каждого металла. Например, метабораты кобальта (II) окрашены в синий цвет: Na2B4O7 + CoO 2 NaBO2 + Co(BO2)2 .
Эти реакции применяются в качественном анализе. На этом свойстве буры основано также её применение при сварке, резании и паянии металлов, в производстве легкоплавкой глазури для эмалирования различных изделий.
