
- •Общая и неорганическая химия
- •Часть 2 свойства элементов и их соединений
- •Содержание
- •2.1 Введение.………………………….…..……………….………….30
- •3.1 Введение…………………………………………………………...41
- •4.1 Введение …………………………………………………………..47
- •5.1 Введение…………….….…………….………….….….….………56
- •6.1 Введение.…..…………………….………………………….……..70
- •7.1 Введение…………………………………………………………..77
- •9.1 Введение.…...…..………………………………….…..…….……83
- •Периодическая система химических элементов. Строение атомов и молекул
- •1.1 Введение
- •1.2 Постулаты теории Бора
- •1.3 Квантовомеханическое описание состояния электрона в атоме
- •1.3.1 Элементарные представления о квантовой механике
- •1.3.2 Главное квантовое число
- •1.3.3 Орбитальное квантовое число
- •1.3.4 Магнитное квантовое число
- •1.3.5 Атомные орбитали
- •1.3.6 Спиновое квантовое число
- •1.3.7 Принцип Паули
- •1.4 Периодическая система химических элементов
- •1.4.1 Элементы первого периода (h, He)
- •1 .4.2 Элементы второго периода (Li – Ne)
- •1.4.3 Элементы III периода (Na – Ar)
- •1.4.4 Элементы IV периода (k – Kr)
- •1.4.5 Элементы V, VI и VII периодов
- •1.5 Химическая связь и строение молекул
- •1.5.1 Механизмы образования ковалентной связи
- •1.5.2 Направленность ковалентной связи
- •1.5.3 Гибридизация атомных орбиталей
- •1.5.4 Металлическая связь
- •Комплексные соединения
- •2.1 Введение
- •2.2 Основные положения координационной теории
- •2.3 Природа химической связи в комплексных соединениях
- •2.4 Классификация комплексов
- •2.4.2 Классификация по типу лигандов
- •2.5 Номенклатура комплексных соединений
- •2.6 Диссоциация комплексных соединений в растворах
- •2.7 Образование и разрушение комплексов
- •2.8 Геометрия комплексных ионов
- •2.9 Изомерия комплексных соединений
- •Галогены
- •3.1 Введение
- •3.2 Физические свойства галогенов
- •3.3 Химические свойства галогенов
- •3.4 Получение галогенов
- •3.5 Водородные соединения галогенов
- •3.6 Получение галогеноводородов
- •3.7 Кислородсодержащие соединения галогенов
- •3.8 Применение галогенов
- •4.1 Введение
- •4.2 Кислород
- •4.3 Сера
- •4.3.1 Свойства серы – простого вещества
- •4.3.2 Сероводород, сульфиды, полисульфиды
- •4.3.3 Диоксид серы. Сернистая кислота
- •4.3.4 Триоксид серы. Серная кислота
- •4.3.5 Олеум. Дисерная кислота
- •4.3.6 Мононадсерная и пероксодисерная кислоты
- •4.3.7 Тиосерная кислота и тиосульфаты
- •4.4 Селен. Теллур
- •4.5 Сравнение свойств водородных соединений p-элементов VI группы
- •5.1 Введение
- •5.2 Азот
- •5.2.1 Свойства азота – простого вещества
- •5.2.2 Аммиак и соли аммония. Гидразин. Гидроксиламин
- •5.2.3 Оксиды азота
- •5.2.4 Азотистая кислота и её соли
- •5.2.5 Азотная кислота и её соли
- •5.2.6 «Царская водка»
- •5.3 Фосфор
- •5.3.1 Свойства фосфора – простого вещества
- •5.3.4 Соединение фосфора с водородом
- •5.3.5 Галогениды фосфора
- •5.4 Мышьяк
- •5.5 Сурьма
- •5.6 Висмут
- •6.1 Введение
- •6.2 Углерод и его соединения
- •6.2.1 Свойства углерода – простого вещества
- •6.2.2 Оксид углерода (IV). Угольная кислота и её соли
- •6.2.3 Оксид углерода (II)
- •6.2.4 Карбиды
- •6.2.5 Соединения углерода с азотом
- •6.3 Кремний
- •6.4 Германий. Олово. Свинец
- •7.1 Введение
- •7.3 Алюминий
- •7.4 Индий. Галлий. Таллий
- •Обзор химических свойств соединений d-элементов
- •9.1 Введение
- •9.4 Хром
- •9.5 Марганец
- •9.6 Элементы триады железа
- •9.6.1 Железо
- •9.6.2 Кобальт
- •9.6.3 Никель
- •Литература
- •Часть 2. Свойства элементов и их соединений
5.2 Азот
5.2.1 Свойства азота – простого вещества
Молекулярный азот – газ без цвета и запаха, плохо растворимый в воде. Молекулы азота двухатомны (N2). Азот – главная составная часть воздуха (78 % по объёму). В промышленности азот получают ректификацией жидкого воздуха; лабораторный способ – термическое разложение нитрита аммония:
NH4NO2 N2 + 2 H2O .
Азот – малоактивное вещество; это объясняется большой прочностью молекул N2 с тройной связью.
5.2.2 Аммиак и соли аммония. Гидразин. Гидроксиламин
Азот образует несколько соединений с водородом. Важным в практическом отношении водородным соединением азота является аммиак (NH3) – бесцветный газ с резким запахом. При температуре минус 33,4 C и атмосферном давлении аммиак переходит в жидкое состояние.
Атом азота в молекуле аммиака имеет одну неподелённую электронную пару и может участвовать в образовании связи по донорно-акцепторному механизму, например, с ионом водорода, который имеет свободную орбиталь. В результате этого взаимодействия образуется ион аммония (см. раздел 1.5.1 «Механизмы образования ковалентной связи» лекции 1).
Соли аммония образуются при реакции аммиака с кислотами:
NH3 + HCl NH4Cl 2 NH3 + H2SO4 (NH4)2SO4 .
Аммиак хорошо растворяется в воде. Водный раствор аммиака называют нашатырным спиртом. Взаимодействие аммиака с водой приводит к образованию гидроксида аммония; гидроксид аммония – слабое основание (К = 1,810–5):
NH3 + HOH ⇆ NH4OH.
На обратимости этой реакции основан лабораторный способ получения аммиака:
2
t
В промышленности аммиак получают прямым синтезом из азота и водорода:
N2 + 3 H2 ⇆ 2 NH3 .
Синтез ведут при высоких температуре и давлении (500 C; 300 атм.).
Другой промышленный способ получения аммиака – цианамидный – в настоящее время имеет историческое значение. Этот способ основан на способности азота взаимодействовать с карбидом кальция (CaC2) при высокой температуре с образованием цианамида (CaCN2):
CaC2 + N2 CaCN2 + C .
Под действием водяного пара цианамид легко разлагается с образованием аммиака: CaCN2 + 3 H2O CaCO3 + 2 NH3 .
Атом азота в молекуле аммиака имеет низшую степень окисления и поэтому проявляет только восстановительные свойства, окисляясь обычно до свободного азота. Например, аммиак горит в атмосфере кислорода:
4 NH3 + 3 O2 2 N2 + 6 H2O .
В присутствии катализатора (сплавы на основе платины) аммиак окисляется до NO: 4 NH3 + 5O2 4 NO + 6 H2O .
Эта реакция имеет промышленное значение в производстве азотной кислоты.
Атомы водорода в молекуле аммиака находятся в высшей степени окисления и проявляют свои окислительные свойства при взаимодействии аммиака со щелочными металлами: 2 NH3 + 2 Na (расплавленный) 2 NaNH2 + H2.
При замещении на металл одного атома водорода в молекуле NH3 образуются соединения, называемые амидами.
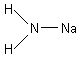
NaNH2 – амид натрия
Соединения, которые можно рассматривать как продукт замещения двух атомов водорода в молекуле NH3 на атомы металла, называются имидами.
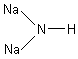 Na2NH
– имид натрия
Na2NH
– имид натрия
При полном замещении атомов водорода в молекуле аммиака атомами металла образуются нитриды.
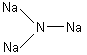
Na3N – нитрид натрия
Нитриды активных металлов (щелочных, щелочноземельных) получают непосредственным взаимодействием металлов и азота при нагревании:
6 Na + N2 2 Na3N .
Амиды, имиды и нитриды наиболее активных металлов полностью гидролизуются водой с образованием аммиака и гидроксида металла:
NaNH2 + HOH NaOH + NH3;
Mg3N2 + 6 HOH 3 Mg(OH)2 + 2 NH3 .
Соли аммония термически неустойчивы и при нагревании они разлагаются; при этом возможны 2 различных типа реакций термического разложения солей аммония.
1) При разложении солей аммония, анион которых не проявляет ярко выраженных окислительных свойств (NH4Cl, (NH4)2SO4, (NH4)3PO4) выделяется аммиак: (NH4)2SO4 NH4HSO4 + NH3 (NH4)3PO4 NH4H2PO4 + 2 NH3.
2) При разложении солей аммония, анион которых проявляет окислительные свойства (NH4NO2, NH4NO3, (NH4)2Cr2O7), протекает реакция внутримолекулярного окисления-восстановления, при этом восстановителем является атом азота в ионе аммония: NH4NO2 N2 + 2 H2O;
NH4NO3 N2O + 2 H2O;
(NH4)2Cr2O7 Cr2O3 + N2 + 4 H2O .
Наибольшее применение соли аммония находят в качестве минеральных удобрений: сульфат, нитрат и фосфаты аммония.
Другими представителями водородсодержащих соединений азота являются гидразин N2H4 и гидроксиламин NH2OH.
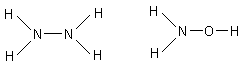
Гидразин – бесцветная жидкость; при взаимодействии с кислотами образует твёрдые вещества – соли гидразония (аналогия – соли аммония). Например, N2H4HCl (или N2H5Cl) – хлорид гидразония; N2H5+ – ион гидразония. Гидразин и его соли являются сильными восстановителями
N2H4
N2
+ 4 H+
+ 4e–
![]() =
– 0,23 В
=
– 0,23 В
N2H4
+ 4 OH–
N2
+ 4 H2O
+ 4e–
![]() =
– 1,16 В
=
– 1,16 В
и окисляются обычно до свободного азота:
N2H4 + 2 I2 N2 + 4 HI.
Гидроксиламин – бесцветное твёрдое вещество, хорошо растворимое в воде. Подобно аммиаку и гидразину образует с кислотами соли гидроксиламмония: NH2OHHCl (или NH3OHCl) – хлорид гидроксиламмония; NH3OH+ – ион гидроксиламмония.
Гидроксиламин обладает окислительно-восстановительной двойственностью; с одной стороны – это сильный восстановитель, который обычно окисляется до свободного азота:
2
NH2OH
N2
+ 2 H2O
+ 2 H+
+ 2 e–
![]() =
– 1,87 В
=
– 1,87 В
2
NH2OH
+ 2 OH–
N2
+ 4 H2O
+ 2 e–
![]() =
– 3,04 В
=
– 3,04 В
10 NH2OH + 2 KMnO4 + 3 H2SO4 5 N2 + 2 MnSO4 + K2SO4 + 18 H2O;
2 NH2OH + I2 + 2 KOH N2 + 2 KI + 4 H2O.
С другой стороны, гидроксиламин в кислой среде проявляет достаточно сильные окислительные свойства, восстанавливаясь при этом до иона аммония:
NH2OH
+ 3 H+
+ 2 e–
NH4+
+ H2O
![]() = + 1,35 В.
= + 1,35 В.
В
кислой среде гидроксиламин способен
окислить соединения железа (II)
до соединений железа (III)
(![]() =
+ 0,77 В):
=
+ 0,77 В):
2 NH2OH + 4 FeSO4 + 3 H2SO4 2 Fe2(SO4)3 + (NH4)2SO4 + 2 H2O.
