
- •Общая и неорганическая химия
- •Часть 2 свойства элементов и их соединений
- •Содержание
- •2.1 Введение.………………………….…..……………….………….30
- •3.1 Введение…………………………………………………………...41
- •4.1 Введение …………………………………………………………..47
- •5.1 Введение…………….….…………….………….….….….………56
- •6.1 Введение.…..…………………….………………………….……..70
- •7.1 Введение…………………………………………………………..77
- •9.1 Введение.…...…..………………………………….…..…….……83
- •Периодическая система химических элементов. Строение атомов и молекул
- •1.1 Введение
- •1.2 Постулаты теории Бора
- •1.3 Квантовомеханическое описание состояния электрона в атоме
- •1.3.1 Элементарные представления о квантовой механике
- •1.3.2 Главное квантовое число
- •1.3.3 Орбитальное квантовое число
- •1.3.4 Магнитное квантовое число
- •1.3.5 Атомные орбитали
- •1.3.6 Спиновое квантовое число
- •1.3.7 Принцип Паули
- •1.4 Периодическая система химических элементов
- •1.4.1 Элементы первого периода (h, He)
- •1 .4.2 Элементы второго периода (Li – Ne)
- •1.4.3 Элементы III периода (Na – Ar)
- •1.4.4 Элементы IV периода (k – Kr)
- •1.4.5 Элементы V, VI и VII периодов
- •1.5 Химическая связь и строение молекул
- •1.5.1 Механизмы образования ковалентной связи
- •1.5.2 Направленность ковалентной связи
- •1.5.3 Гибридизация атомных орбиталей
- •1.5.4 Металлическая связь
- •Комплексные соединения
- •2.1 Введение
- •2.2 Основные положения координационной теории
- •2.3 Природа химической связи в комплексных соединениях
- •2.4 Классификация комплексов
- •2.4.2 Классификация по типу лигандов
- •2.5 Номенклатура комплексных соединений
- •2.6 Диссоциация комплексных соединений в растворах
- •2.7 Образование и разрушение комплексов
- •2.8 Геометрия комплексных ионов
- •2.9 Изомерия комплексных соединений
- •Галогены
- •3.1 Введение
- •3.2 Физические свойства галогенов
- •3.3 Химические свойства галогенов
- •3.4 Получение галогенов
- •3.5 Водородные соединения галогенов
- •3.6 Получение галогеноводородов
- •3.7 Кислородсодержащие соединения галогенов
- •3.8 Применение галогенов
- •4.1 Введение
- •4.2 Кислород
- •4.3 Сера
- •4.3.1 Свойства серы – простого вещества
- •4.3.2 Сероводород, сульфиды, полисульфиды
- •4.3.3 Диоксид серы. Сернистая кислота
- •4.3.4 Триоксид серы. Серная кислота
- •4.3.5 Олеум. Дисерная кислота
- •4.3.6 Мононадсерная и пероксодисерная кислоты
- •4.3.7 Тиосерная кислота и тиосульфаты
- •4.4 Селен. Теллур
- •4.5 Сравнение свойств водородных соединений p-элементов VI группы
- •5.1 Введение
- •5.2 Азот
- •5.2.1 Свойства азота – простого вещества
- •5.2.2 Аммиак и соли аммония. Гидразин. Гидроксиламин
- •5.2.3 Оксиды азота
- •5.2.4 Азотистая кислота и её соли
- •5.2.5 Азотная кислота и её соли
- •5.2.6 «Царская водка»
- •5.3 Фосфор
- •5.3.1 Свойства фосфора – простого вещества
- •5.3.4 Соединение фосфора с водородом
- •5.3.5 Галогениды фосфора
- •5.4 Мышьяк
- •5.5 Сурьма
- •5.6 Висмут
- •6.1 Введение
- •6.2 Углерод и его соединения
- •6.2.1 Свойства углерода – простого вещества
- •6.2.2 Оксид углерода (IV). Угольная кислота и её соли
- •6.2.3 Оксид углерода (II)
- •6.2.4 Карбиды
- •6.2.5 Соединения углерода с азотом
- •6.3 Кремний
- •6.4 Германий. Олово. Свинец
- •7.1 Введение
- •7.3 Алюминий
- •7.4 Индий. Галлий. Таллий
- •Обзор химических свойств соединений d-элементов
- •9.1 Введение
- •9.4 Хром
- •9.5 Марганец
- •9.6 Элементы триады железа
- •9.6.1 Железо
- •9.6.2 Кобальт
- •9.6.3 Никель
- •Литература
- •Часть 2. Свойства элементов и их соединений
4.4 Селен. Теллур
В свободном состоянии селен, подобно сере, образует несколько аллотропных видоизменений, из которых наиболее известны аморфный селен в виде порошка красно-бурого цвета и серый селен, образующий хрупкие кристаллы с металлическим блеском.
Теллур также известен в виде аморфной модификации и в виде кристаллов тёмно-серого цвета, обладающих металлическим блеском.
Селен и теллур, а также селениды и теллуриды некоторых металлов обладают полупроводниковыми свойствами.
SeO2 и TeO2 образуются при сжигании селена и теллура на воздухе или в кислороде. SeO2 и TeO2 – твёрдые вещества – ангидриды селенистой и теллуристой кислот.
В отличие от соединений серы (IV), соединения четырёхвалентных селена и теллура проявляют окислительные свойства, легко восстанавливаясь до простых веществ:
SeO2 + 2 SO2 + 2 H2O Se + 2 H2SO4 .
Лишь действием очень сильных окислителей диоксиды селена и теллура можно перевести в селеновую и теллуровую кислоты.
Безводная селеновая кислота H2SeO4 – кристаллическое вещество. Высшая степень окисления +6 для селена менее устойчива, чем для серы, поэтому селеновая кислота является более сильным окислителем, чем серная. Расплавленная селеновая кислота способна растворять даже золото. Селеновая кислота – сильная кислота, её соли – селенаты – по своим свойствам похожи на сульфаты.
Теллуровая кислота, в отличие от серной и селеновой, – слабая кислота. Она выделяется из раствора в ортоформе H2TeO42H2O, т.е. H6TeO6 и является шестиосновной кислотой. При нагревании ортотеллуровая кислота отщепляет две молекулы воды и переходит в двухосновную кислоту H2TeO4 .
4.5 Сравнение свойств водородных соединений p-элементов VI группы
В ряду H2Te – H2Se – H2S с уменьшением молекулярных масс соединений температуры кипения закономерно уменьшаются; при переходе от H2S к H2O наблюдается аномальное повышение температуры кипения, как и в ряду галогеноводородов (рисунок 4.1; см. также раздел 3.5 «Водородные соединения
галогенов» лекции 3).
В
химическом отношении селеноводород и
теллуроводород похожи на сероводород.
Селеноводород и теллуроводород
представляют собой газы с отвратительным
запахом. Водные растворы H2Se
и H2Te
– это кислоты, несколько более сильные,
чем сероводородная кислота.
Они
обладают сильными восстановительными
свойствами. При нагревании оба газа
разлагаются. При этом H2Te
менее устойчив, чем H2Se:
в ряду H2O
– H2S
– – H2Se
– H2Te
с увеличением р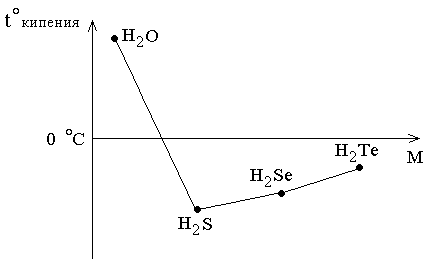 адиусов
атомов элементов уменьшается прочность
химической связи. Селениды и теллуриды
также сходны с сульфидами. Получить
H2Se
и H2Te
можно, действуя на селениды и теллуриды
сильными кислотами.
адиусов
атомов элементов уменьшается прочность
химической связи. Селениды и теллуриды
также сходны с сульфидами. Получить
H2Se
и H2Te
можно, действуя на селениды и теллуриды
сильными кислотами.
Рисунок 4.1 – Зависимость температуры
кипения водородных соединений
p-элементов VI
группы от молекулярной массы
Л Е К Ц И Я 5
P-ЭЛЕМЕНТЫ V ГРУППЫ
5.1 Введение
Главную
подгруппу V группы образуют элементы:
азот, фосфор, мышьяк, сурьма и висмут.
На внешнем энергетическом уровне атомов
этих элементов находятся пять электронов;
сокращённая электронная формула атомов
– ns2np3.
Атом азота отличается от атомов других
p-элементов V группы отсутств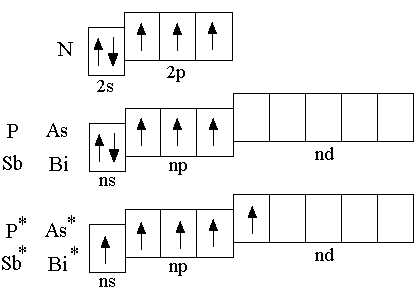 ием
d-подуровня во внешнем электронном
слое, поэтому валентность азота, т.е.
число химических связей не может
превышать 4 (три связи могут быть
образованы по обменному механизму и
одна – по донорно-акцепторному). Атомы
остальных элементов подгруппы могут
образовывать до пяти химических связей.
Высшая положительная степень окисления
у всех элементов подгруппы равна +5.
Низшая – минус 3. Кроме того, для всех
рассматриваемых элементов характерна
также степень окисления +3. Атом азота
может иметь все степени окисления от
минус 3 до +5:
ием
d-подуровня во внешнем электронном
слое, поэтому валентность азота, т.е.
число химических связей не может
превышать 4 (три связи могут быть
образованы по обменному механизму и
одна – по донорно-акцепторному). Атомы
остальных элементов подгруппы могут
образовывать до пяти химических связей.
Высшая положительная степень окисления
у всех элементов подгруппы равна +5.
Низшая – минус 3. Кроме того, для всех
рассматриваемых элементов характерна
также степень окисления +3. Атом азота
может иметь все степени окисления от
минус 3 до +5:
–3; –2; –1; 0; +1; +2; +3; +4; +5.
В подгруппе с увеличением порядкового номера уменьшаются неметаллические свойства и усиливаются металлические. Последние заметны уже у мышьяка; сурьма в равной степени обладает и теми и другими свойствами, а у висмута металлические свойства преобладают над неметаллическими. Поскольку для металлов нехарактерны отрицательные степени окисления, то устойчивость соединений с атомом в низшей степени окисления уменьшается по мере нарастания металлических свойств элементов в ряду N – P – As – Sb – Bi.
