
- •Общая и неорганическая химия
- •Часть 2 свойства элементов и их соединений
- •Содержание
- •2.1 Введение.………………………….…..……………….………….30
- •3.1 Введение…………………………………………………………...41
- •4.1 Введение …………………………………………………………..47
- •5.1 Введение…………….….…………….………….….….….………56
- •6.1 Введение.…..…………………….………………………….……..70
- •7.1 Введение…………………………………………………………..77
- •9.1 Введение.…...…..………………………………….…..…….……83
- •Периодическая система химических элементов. Строение атомов и молекул
- •1.1 Введение
- •1.2 Постулаты теории Бора
- •1.3 Квантовомеханическое описание состояния электрона в атоме
- •1.3.1 Элементарные представления о квантовой механике
- •1.3.2 Главное квантовое число
- •1.3.3 Орбитальное квантовое число
- •1.3.4 Магнитное квантовое число
- •1.3.5 Атомные орбитали
- •1.3.6 Спиновое квантовое число
- •1.3.7 Принцип Паули
- •1.4 Периодическая система химических элементов
- •1.4.1 Элементы первого периода (h, He)
- •1 .4.2 Элементы второго периода (Li – Ne)
- •1.4.3 Элементы III периода (Na – Ar)
- •1.4.4 Элементы IV периода (k – Kr)
- •1.4.5 Элементы V, VI и VII периодов
- •1.5 Химическая связь и строение молекул
- •1.5.1 Механизмы образования ковалентной связи
- •1.5.2 Направленность ковалентной связи
- •1.5.3 Гибридизация атомных орбиталей
- •1.5.4 Металлическая связь
- •Комплексные соединения
- •2.1 Введение
- •2.2 Основные положения координационной теории
- •2.3 Природа химической связи в комплексных соединениях
- •2.4 Классификация комплексов
- •2.4.2 Классификация по типу лигандов
- •2.5 Номенклатура комплексных соединений
- •2.6 Диссоциация комплексных соединений в растворах
- •2.7 Образование и разрушение комплексов
- •2.8 Геометрия комплексных ионов
- •2.9 Изомерия комплексных соединений
- •Галогены
- •3.1 Введение
- •3.2 Физические свойства галогенов
- •3.3 Химические свойства галогенов
- •3.4 Получение галогенов
- •3.5 Водородные соединения галогенов
- •3.6 Получение галогеноводородов
- •3.7 Кислородсодержащие соединения галогенов
- •3.8 Применение галогенов
- •4.1 Введение
- •4.2 Кислород
- •4.3 Сера
- •4.3.1 Свойства серы – простого вещества
- •4.3.2 Сероводород, сульфиды, полисульфиды
- •4.3.3 Диоксид серы. Сернистая кислота
- •4.3.4 Триоксид серы. Серная кислота
- •4.3.5 Олеум. Дисерная кислота
- •4.3.6 Мононадсерная и пероксодисерная кислоты
- •4.3.7 Тиосерная кислота и тиосульфаты
- •4.4 Селен. Теллур
- •4.5 Сравнение свойств водородных соединений p-элементов VI группы
- •5.1 Введение
- •5.2 Азот
- •5.2.1 Свойства азота – простого вещества
- •5.2.2 Аммиак и соли аммония. Гидразин. Гидроксиламин
- •5.2.3 Оксиды азота
- •5.2.4 Азотистая кислота и её соли
- •5.2.5 Азотная кислота и её соли
- •5.2.6 «Царская водка»
- •5.3 Фосфор
- •5.3.1 Свойства фосфора – простого вещества
- •5.3.4 Соединение фосфора с водородом
- •5.3.5 Галогениды фосфора
- •5.4 Мышьяк
- •5.5 Сурьма
- •5.6 Висмут
- •6.1 Введение
- •6.2 Углерод и его соединения
- •6.2.1 Свойства углерода – простого вещества
- •6.2.2 Оксид углерода (IV). Угольная кислота и её соли
- •6.2.3 Оксид углерода (II)
- •6.2.4 Карбиды
- •6.2.5 Соединения углерода с азотом
- •6.3 Кремний
- •6.4 Германий. Олово. Свинец
- •7.1 Введение
- •7.3 Алюминий
- •7.4 Индий. Галлий. Таллий
- •Обзор химических свойств соединений d-элементов
- •9.1 Введение
- •9.4 Хром
- •9.5 Марганец
- •9.6 Элементы триады железа
- •9.6.1 Железо
- •9.6.2 Кобальт
- •9.6.3 Никель
- •Литература
- •Часть 2. Свойства элементов и их соединений
3.4 Получение галогенов
В лаборатории галогены получают окислением галогенид-ионов (как правило, в кислой среде) такими окислителями, как KMnO4, K2Cr2O7, PbO2, MnO2, KСlO3 и другими: MnO2 + 4 HCl (конц.) MnCl2 + Cl2 + 2 H2O;
2 KMnO4 + 16 HCl (конц.) 2 MnCl2 + 5 Cl2 + 2 KCl + 8 H2O
Промышленный способ получения галогенов – электролиз расплавов и растворов солей галогеноводородных кислот.
3.5 Водородные соединения галогенов
Галогены непосредственно соединяются с водородом, при этом фтор реагирует со взрывом; смесь хлора и водорода не взаимодействует в темноте, но взрывается при ультрафиолетовом облучении. Эта реакция имеет цепной механизм.
Cl2 2 Cl
C
hν
H + Cl2 HCl + Cl
Взаимодействие брома и йода с водородом происходит лишь при нагревании; эти реакции обратимы и протекают неполностью. Образующиеся галогеноводороды – бесцветные газообразные вещества, хорошо растворимые в воде. Их водные растворы представляют собой кислоты: HF – фтороводородная (плавиковая) кислота, HCl – хлороводородная (соляная) кислота, HBr – бромоводородная кислота, HI – йодоводородная кислота. С увеличением радиусов атомов галогенов уменьшается прочность связи в молекулах галогеноводородов и увеличивается сила кислот.
В ряду HI – HBr – HCl температуры кипения закономерно уменьшаются с уменьшением молекулярных масс, а при переходе к HF наблюдается увеличение температуры кипения (рисунок 3.1).
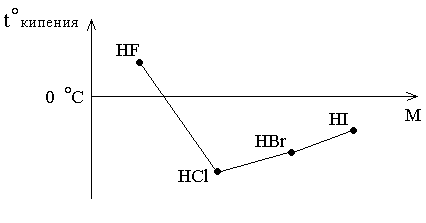
Рисунок
3.1 –
Зависимость температуры кипения
галогеноводородов от молекулярной
массы
Это обусловлено ассоциацией молекул фтороводорода вследствие образования между ними водородных связей. Возникновение водородных связей в первом приближении можно объяснить действием электростатического притяжения между положительно заряженным атомом водорода одной молекулы HF и отрицательно заряженным атомом фтора другой молекулы:
H+– F–H+– F–H+– F–H+– F–H+– F–H+– F–H+– F–
Условием образования водородной связи является высокая электроотрицательность атома, непосредственно связанного с атомом водорода. В этом случае атом водорода практически лишён электронной оболочки и способен внедриться в электронную оболочку другого атома. Именно поэтому водородная связь характерна для соединений водорода с самыми электроотрицательными элементами.
Диссоциация HF требует значительной затраты энергии на разрыв водородных связей. Поэтому фтороводород слабо диссоциирован в водных растворах. Образовавшиеся при диссоциации ионы F– в значительной степени связываются водородными связями с недиссоциированными молекулами HF с образованием ионов HF2– : [F–·····H–F] [F·····H·····F]– .
Поэтому для плавиковой кислоты известны кислые соли, например, KHF2 .
3.6 Получение галогеноводородов
Плавиковую кислоту получают действием концентрированной серной кислоты на фторид кальция (плавиковый шпат), используя для этого аппаратуру из свинца: CaF2 (твёрдый.) + H2SO4 (конц.) 2 HF + CaSO4 .
Плавиковая кислота реагирует с SiO2, входящим в состав стекла, поэтому HF нельзя получать и хранить в стеклянной посуде.
SiO2 + 4 HF(газ) SiF4 + 2 H2O.
В растворе образующийся SiF4 реагирует с избытком HF с образованием гексафторокремниевой кислоты: SiO2 + 4 HF SiF4 + 2 H2O
SiF4 + 2 HF H2[SiF6].
Хлороводород обычно получают сульфатным или синтетическим способами.
Сульфатный способ: H2SO4 (конц.) + NaCl (твёрдый.) NaHSO4 + HCl;
NaHSO4 + NaCl Na2SO4 + HCl.
Первая из этих реакций протекает при небольшом нагревании; вторая стадия процесса требует достаточно сильного нагревания.
Синтетический способ: H2 + Cl2 2 HCl .
Большие количества HCl получают в качестве побочного продукта хлорирования органических соединений:
RH + Cl2 RCl + HCl;
в этой реакции R – органический радикал.
Бромоводородную и йодоводородную кислоты нельзя получить сульфатным методом, так как бромиды и иодиды окисляются концентрированной серной кислотой. Это связано с тем, что в ряду Сl– – Br– – I– значительно усиливаются восстановительные свойства галогенид-ионов:
H2SO4 + 2 HBr Br2 + SO2 + 2 H2O;
H2SO4 + 6 HI 3 I2 + S + 4 H2O;
H2SO4 + 8 HI 4 I2 + H2S + 4 H2O.
HBr и HI получают гидролизом бромидов и иодидов фосфора:
PBr3 + 3 H2O H3PO3 + 3 HBr; PI3 + 3 H2O H3PO3 + 3 HI .
