
- •Общая и неорганическая химия
- •Часть 2 свойства элементов и их соединений
- •Содержание
- •2.1 Введение.………………………….…..……………….………….30
- •3.1 Введение…………………………………………………………...41
- •4.1 Введение …………………………………………………………..47
- •5.1 Введение…………….….…………….………….….….….………56
- •6.1 Введение.…..…………………….………………………….……..70
- •7.1 Введение…………………………………………………………..77
- •9.1 Введение.…...…..………………………………….…..…….……83
- •Периодическая система химических элементов. Строение атомов и молекул
- •1.1 Введение
- •1.2 Постулаты теории Бора
- •1.3 Квантовомеханическое описание состояния электрона в атоме
- •1.3.1 Элементарные представления о квантовой механике
- •1.3.2 Главное квантовое число
- •1.3.3 Орбитальное квантовое число
- •1.3.4 Магнитное квантовое число
- •1.3.5 Атомные орбитали
- •1.3.6 Спиновое квантовое число
- •1.3.7 Принцип Паули
- •1.4 Периодическая система химических элементов
- •1.4.1 Элементы первого периода (h, He)
- •1 .4.2 Элементы второго периода (Li – Ne)
- •1.4.3 Элементы III периода (Na – Ar)
- •1.4.4 Элементы IV периода (k – Kr)
- •1.4.5 Элементы V, VI и VII периодов
- •1.5 Химическая связь и строение молекул
- •1.5.1 Механизмы образования ковалентной связи
- •1.5.2 Направленность ковалентной связи
- •1.5.3 Гибридизация атомных орбиталей
- •1.5.4 Металлическая связь
- •Комплексные соединения
- •2.1 Введение
- •2.2 Основные положения координационной теории
- •2.3 Природа химической связи в комплексных соединениях
- •2.4 Классификация комплексов
- •2.4.2 Классификация по типу лигандов
- •2.5 Номенклатура комплексных соединений
- •2.6 Диссоциация комплексных соединений в растворах
- •2.7 Образование и разрушение комплексов
- •2.8 Геометрия комплексных ионов
- •2.9 Изомерия комплексных соединений
- •Галогены
- •3.1 Введение
- •3.2 Физические свойства галогенов
- •3.3 Химические свойства галогенов
- •3.4 Получение галогенов
- •3.5 Водородные соединения галогенов
- •3.6 Получение галогеноводородов
- •3.7 Кислородсодержащие соединения галогенов
- •3.8 Применение галогенов
- •4.1 Введение
- •4.2 Кислород
- •4.3 Сера
- •4.3.1 Свойства серы – простого вещества
- •4.3.2 Сероводород, сульфиды, полисульфиды
- •4.3.3 Диоксид серы. Сернистая кислота
- •4.3.4 Триоксид серы. Серная кислота
- •4.3.5 Олеум. Дисерная кислота
- •4.3.6 Мононадсерная и пероксодисерная кислоты
- •4.3.7 Тиосерная кислота и тиосульфаты
- •4.4 Селен. Теллур
- •4.5 Сравнение свойств водородных соединений p-элементов VI группы
- •5.1 Введение
- •5.2 Азот
- •5.2.1 Свойства азота – простого вещества
- •5.2.2 Аммиак и соли аммония. Гидразин. Гидроксиламин
- •5.2.3 Оксиды азота
- •5.2.4 Азотистая кислота и её соли
- •5.2.5 Азотная кислота и её соли
- •5.2.6 «Царская водка»
- •5.3 Фосфор
- •5.3.1 Свойства фосфора – простого вещества
- •5.3.4 Соединение фосфора с водородом
- •5.3.5 Галогениды фосфора
- •5.4 Мышьяк
- •5.5 Сурьма
- •5.6 Висмут
- •6.1 Введение
- •6.2 Углерод и его соединения
- •6.2.1 Свойства углерода – простого вещества
- •6.2.2 Оксид углерода (IV). Угольная кислота и её соли
- •6.2.3 Оксид углерода (II)
- •6.2.4 Карбиды
- •6.2.5 Соединения углерода с азотом
- •6.3 Кремний
- •6.4 Германий. Олово. Свинец
- •7.1 Введение
- •7.3 Алюминий
- •7.4 Индий. Галлий. Таллий
- •Обзор химических свойств соединений d-элементов
- •9.1 Введение
- •9.4 Хром
- •9.5 Марганец
- •9.6 Элементы триады железа
- •9.6.1 Железо
- •9.6.2 Кобальт
- •9.6.3 Никель
- •Литература
- •Часть 2. Свойства элементов и их соединений
2.6 Диссоциация комплексных соединений в растворах
Диссоциация комплексного соединения на ионы внешней сферы и комплексный ион, представляющий собой внутреннюю сферу, протекает по типу сильного электролита и называется первичной диссоциацией комплексного соединения:
Na2[Zn(OH)4] 2 Na+ + [Zn(OH)4]2– .
Диссоциация внутренней сферы комплексного соединения протекает по типу слабого электролита, т.е. ступенчато, обратимо и не полностью; этот процесс называется вторичной диссоциацией комплексного соединения. Таким образом, вторичная диссоциация характеризуется наличием равновесия между комплексной частицей, центральным ионом и лигандами:
[Zn(OH)4]2– ⇆ [Zn(OH)3]– + OH–;
[Zn(OH)3]– ⇆ Zn(OH)2 + OH–;
Zn(OH)2 ⇆ ZnOH+ + OH–;
ZnOH+ ⇆ Zn2+ + OH–.
Диссоциация комплексных ионов, как и диссоциация всякого слабого электролита, характеризуется константой равновесия. В рассматриваемом случае эта константа равновесия называется константой нестойкости комплексного соединения. Чем более неустойчив данный комплекс, тем больше константа нестойкости. Равновесие каждой стадии вторичной диссоциации характеризуется своей константой нестойкости.
[Zn(OH)4]2–
⇆
[Zn(OH)3]–
+ OH–

[Zn(OH)3]–
⇆
Zn(OH)2
+ OH–
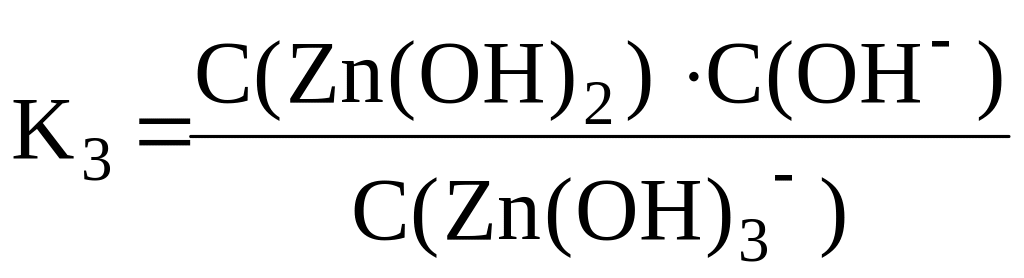
Zn(OH)2
⇆
ZnOH+
+ OH–
![]()
ZnOH+
⇆
Zn2+
+ OH–
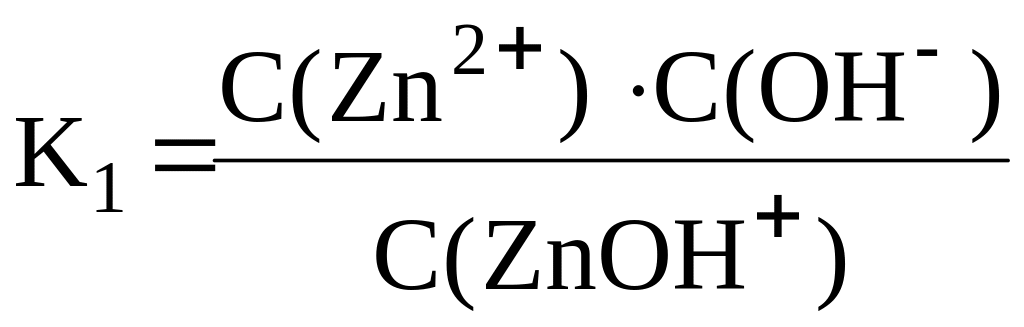
Суммарному
процессу [Zn(OH)4]2–
⇆
Zn2+
+ 4 OH–
соответствует общая константа нестойкости
![]() .
.
Очевидно, что Kобщ. = K1K2K3K4 .
Величина, обратная константе нестойкости, называется константой устойчивости комплекса: Kобщ. уст. = 1/Kобщ. нест. .
K1 уст. = 1/K1 нест. ; K2 уст. = 1/K2 нест. ; K3 уст. = 1/K3 нест. ; K4 уст. = 1/K4 нест. .
Чем более устойчив комплекс, тем больше константа устойчивости. Константы нестойкости и устойчивости являются справочными величинами.
2.7 Образование и разрушение комплексов
Образование аквакомплексов происходит при растворении солей многих металлов в воде:
CuSO4 + 4 H2O [Cu(H2O)4]SO4 ;
Cu2+ + 4 H2O [Cu(H2O)4]2+ .
Соединения многих d-элементов способны взаимодействовать с аммиаком или его водным раствором с образованием амминокомплексов:
Ni(NO3)2 + 6 NH3 [Ni(NH3)6](NO3)2 ;
Ni2+ + 6 NH3 [Ni(NH3)6]2+ ;
Ni(NO3)2 + 6 NH4OH [Ni(NH3)6](NO3)2 + 6 H2O;
Ni2+ + 6 NH4OH [Ni(NH3)6]2+ + 6 H2O.
Гидроксиды амфотерных металлов растворяются в избытке растворов щелочей с образованием гидроксокомплексов:
Cr(OH)3 + 3 KOH K3[Cr(OH)6]; Be(OH)2 + 2 NaOH Na2[Be(OH)4];
Cr(OH)3 + 3 OH– [Cr(OH)6]3– ; Be(OH)2 + 2 OH– [Be(OH)4]2–.
Ацидокомплексы можно получить в результате взаимодействия соединений d-элементов с растворами солей или кислот:
AgCl + 2 NaCN Na[Ag(CN)2] + NaCl; HgI2 + 2 KI K2[HgI4];
AgCl + 2 CN– [Ag(CN)2]– + Cl–; HgI2 + 2 I– [HgI4]2–;
FeCl2 + 6 KCN K4[Fe(CN)6] + 2 KCl; CuCl + HCl H[CuCl2];
Fe2+ + 6 CN– [Fe(CN)6]4–; CuCl + Cl– [CuCl2]–.
Поскольку комплексный ион является малодиссоциирующим соединением, то для его разрушения необходимо, чтобы в качестве продукта реакции образовался ещё более слабый электролит. Например, все гидроксокомплексы устойчивы только в щелочных растворах и разрушаются при добавлении кислот. В данном случае разрушение комплекса происходит вследствие связывания лигандов (ионов OH–) ионами H+ и образования очень слабого электролита – воды.
Na2[Zn(OH)4] + 2HCl Zn(OH)2 + 2NaCl + 2H2O;
[Zn(OH)4]2– + 2H+ Zn(OH)2 + 2H2O.
Na2[Zn(OH)4] + 4HCl ZnCl2 + 2NaCl + 4H2O;
[Zn(OH)4]2– + 4H+ Zn2+ + 4H2O;
Зная численные значения констант нестойкости можно прогнозировать направление протекания реакций, в которых происходит разрушение одного и образование другого комплекса: при сильном различии величин констант нестойкости равновесие реакции смещено в сторону образования более прочного комплекса. Например, равновесие реакции
[Ag(NH3)2]Cl + 2 KCN ⇆ K[Ag(CN)2] + 2 KCl + 2 NH3
[Ag(NH3)2]+ + 2 CN– ⇆ [Ag(CN)2]– + 2 NH3
практически полностью смещено вправо, поскольку цианидный комплекс серебра намного более устойчив, чем амминокомплекс:
Kобщ. нест. [Ag(NH3)2]+ = 6,810–8 >> Kобщ. нест.[Ag(CN)2]– = 110–21.
Примечание – Для галогенидов некоторых p-металлов (например, Al, Ga, In) также характерны реакции образования ацидокомплексов:
AlF3 + 3 KF K3[AlF6]; GaF3 + 3 NaF Na3[GaF6]; InCl3 + 3 KCl K3[InCl6].
Фторидные комплексы известны и для таких неметаллов, как бор и кремний:
BF3 + KF K[BF4]; SiF4 + 2 HF H2[SiF6].
Большинство амминокомплексов разрушается при добавлении избытка кислот, поскольку ионы H+ взаимодействуют с лигандами – молекулами NH3, – и в результате такого взаимодействия образуются ионы [NH4]+. Ион аммония, который также можно рассматривать как комплексный ион, достаточно устойчив: Kнест. [NH4]+ = 5,610–10.
Сказанное относится к амминокомплексам меди (II) (Kобщ. нест. = 2,110–13), цинка (Kобщ. нест. = 3,510–10), никеля (Kобщ. нест. = 1,910–9), серебра (Kобщ. нест. = = 6,810–8), и другим аммиакатам, константы нестойкости которых ненамного отличаются от константы нестойкости иона аммония:
[Ag(NH3)2]NO3 + 2 HNO3 AgNO3 + 2 NH4NO3;
[Ag(NH3)2]+ + 2 H+ Ag+ + 2 [NH4]+;
[Cu(NH3)4]SO4 + 4 HCl CuSO4 + 4 NH4Cl;
[Cu(NH3)4]2+ + 4 H+ Cu2+ + 4 [NH4]+.
Аналогичный же амминокомплекс [Pt(NH3)4]2+, который характеризуется константой нестойкости 510–34 не разрушается при комнатной температуре даже в концентрированной соляной кислоте.
Комплекс можно также разрушить, связав ионы внутренней сферы в малорастворимое соединение. Так, при добавлении иодида калия к раствору нитрата диамминсеребра (I) образуется осадок иодида серебра:
[Ag(NH3)2]NO3 + KI AgI + 2 NH3 + KNO3;
[Ag(NH3)2]+ + I– AgI + 2 NH3 .
Однако, если иодид калия ввести в раствор цианидного комплекса серебра, например, Na[Ag(CN)2], то осадок иодида серебра не образуется. Ион [Ag(CN)2]– настолько прочен (Kобщ. нест.[Ag(CN)2]– = 110–21), что концентрация ионов Ag+, образующихся в результате вторичной диссоциации комплекса, очень мала, для достижения величины произведения растворимости иодида серебра (ПРAgI = 110–16). Аммиачный же комплекс серебра менее устойчив (Kобщ. нест. [Ag(NH3)2]+ = 6,810–8). В результате вторичной диссоциации амминокомплекса серебра образуется гораздо больше ионов Ag+, чем при диссоциации цианокомплекса, и произведение концентраций ионов Ag+ и I– может превысить величину ПРAgI.
Цианидный комплекс серебра можно разрушить, действуя на раствор Na[Ag(CN)2] растворимыми сульфидами (K2S, Na2S):
2 Na[Ag(CN)2] + K2S Ag2S + 2 KCN + 2 NaCN;
2 [Ag(CN)2]– + S2– Ag2S + 4 CN–.
Сульфид серебра настолько малорастворим (ПРAg2S = 210–50), что даже очень малая концентрация ионов Ag+, содержащихся в растворе дицианоаргентата натрия, оказывается достаточной для превышения величины ПРAg2S и выпадения осадка сульфида серебра. Очевидно, что действием сульфида натрия или сульфида калия можно также разрушить и амминокомплекс серебра:
2 [Ag(NH3)2]NO3 + K2S Ag2S + 2 KNO3 + 4 NH3;
2 [Ag(NH3)2]+ + S2– Ag2S + 4 NH3 .
