
- •Общая и неорганическая химия
- •Часть 2 свойства элементов и их соединений
- •Содержание
- •2.1 Введение.………………………….…..……………….………….30
- •3.1 Введение…………………………………………………………...41
- •4.1 Введение …………………………………………………………..47
- •5.1 Введение…………….….…………….………….….….….………56
- •6.1 Введение.…..…………………….………………………….……..70
- •7.1 Введение…………………………………………………………..77
- •9.1 Введение.…...…..………………………………….…..…….……83
- •Периодическая система химических элементов. Строение атомов и молекул
- •1.1 Введение
- •1.2 Постулаты теории Бора
- •1.3 Квантовомеханическое описание состояния электрона в атоме
- •1.3.1 Элементарные представления о квантовой механике
- •1.3.2 Главное квантовое число
- •1.3.3 Орбитальное квантовое число
- •1.3.4 Магнитное квантовое число
- •1.3.5 Атомные орбитали
- •1.3.6 Спиновое квантовое число
- •1.3.7 Принцип Паули
- •1.4 Периодическая система химических элементов
- •1.4.1 Элементы первого периода (h, He)
- •1 .4.2 Элементы второго периода (Li – Ne)
- •1.4.3 Элементы III периода (Na – Ar)
- •1.4.4 Элементы IV периода (k – Kr)
- •1.4.5 Элементы V, VI и VII периодов
- •1.5 Химическая связь и строение молекул
- •1.5.1 Механизмы образования ковалентной связи
- •1.5.2 Направленность ковалентной связи
- •1.5.3 Гибридизация атомных орбиталей
- •1.5.4 Металлическая связь
- •Комплексные соединения
- •2.1 Введение
- •2.2 Основные положения координационной теории
- •2.3 Природа химической связи в комплексных соединениях
- •2.4 Классификация комплексов
- •2.4.2 Классификация по типу лигандов
- •2.5 Номенклатура комплексных соединений
- •2.6 Диссоциация комплексных соединений в растворах
- •2.7 Образование и разрушение комплексов
- •2.8 Геометрия комплексных ионов
- •2.9 Изомерия комплексных соединений
- •Галогены
- •3.1 Введение
- •3.2 Физические свойства галогенов
- •3.3 Химические свойства галогенов
- •3.4 Получение галогенов
- •3.5 Водородные соединения галогенов
- •3.6 Получение галогеноводородов
- •3.7 Кислородсодержащие соединения галогенов
- •3.8 Применение галогенов
- •4.1 Введение
- •4.2 Кислород
- •4.3 Сера
- •4.3.1 Свойства серы – простого вещества
- •4.3.2 Сероводород, сульфиды, полисульфиды
- •4.3.3 Диоксид серы. Сернистая кислота
- •4.3.4 Триоксид серы. Серная кислота
- •4.3.5 Олеум. Дисерная кислота
- •4.3.6 Мононадсерная и пероксодисерная кислоты
- •4.3.7 Тиосерная кислота и тиосульфаты
- •4.4 Селен. Теллур
- •4.5 Сравнение свойств водородных соединений p-элементов VI группы
- •5.1 Введение
- •5.2 Азот
- •5.2.1 Свойства азота – простого вещества
- •5.2.2 Аммиак и соли аммония. Гидразин. Гидроксиламин
- •5.2.3 Оксиды азота
- •5.2.4 Азотистая кислота и её соли
- •5.2.5 Азотная кислота и её соли
- •5.2.6 «Царская водка»
- •5.3 Фосфор
- •5.3.1 Свойства фосфора – простого вещества
- •5.3.4 Соединение фосфора с водородом
- •5.3.5 Галогениды фосфора
- •5.4 Мышьяк
- •5.5 Сурьма
- •5.6 Висмут
- •6.1 Введение
- •6.2 Углерод и его соединения
- •6.2.1 Свойства углерода – простого вещества
- •6.2.2 Оксид углерода (IV). Угольная кислота и её соли
- •6.2.3 Оксид углерода (II)
- •6.2.4 Карбиды
- •6.2.5 Соединения углерода с азотом
- •6.3 Кремний
- •6.4 Германий. Олово. Свинец
- •7.1 Введение
- •7.3 Алюминий
- •7.4 Индий. Галлий. Таллий
- •Обзор химических свойств соединений d-элементов
- •9.1 Введение
- •9.4 Хром
- •9.5 Марганец
- •9.6 Элементы триады железа
- •9.6.1 Железо
- •9.6.2 Кобальт
- •9.6.3 Никель
- •Литература
- •Часть 2. Свойства элементов и их соединений
1.5.4 Металлическая связь
Исследования электронного строения твёрдых металлов показали, что в узлах кристаллической решётки металла находятся ионы металла, а валентные электроны, осуществляющие химическую связь, принадлежат не двум или нескольким определённым атомам (ионам), а всему кристаллу металла. При этом валентные электроны способны свободно перемещаться в объёме кристалла. Образованную подобным образом химическую связь называют металлической связью, а совокупность свободных электронов, находящихся между узлами кристаллической решётки металла – электронным газом. Наличием электронного газа, способного свободно перемещаться по всему кристаллу металла объясняются такие характерные для металлов свойства, как высокие электро- и теплопроводность.
Пластичность металлов также объясняется специфическими свойствами металлической связи. При механическом воздействии на твёрдое тело отдельные слои его кристаллической решётки смещаются друг относительно друга. В кристаллах с атомной структурой в узлах кристаллической решетки находятся атомы, связанные друг с другом ковалентными связями, и такое смещение слоёв приводит к разрыву связей между атомами, принадлежащими различным слоям, и кристалл разрушается. В кристаллах с ионной структурой при взаимном смещении слоёв создаётся такое положение, при котором рядом оказываются одноимённо заряженные ионы; при этом возникают силы электростатического отталкивания, и кристалл также разрушается. В случае же металла при смещении отдельных слоёв его кристаллической решётки происходит лишь некоторое перераспределение электронного газа, связывающего друг с другом атомы (ионы) металла, при этом разрыва химических связей не происходит, металл деформируется, не разрушаясь.
Л Е К Ц И Я 2
Комплексные соединения
2.1 Введение
В самый ранний период развития химической науки были получены вещества, которые как бы состояли из стехиометрических смесей двух или большего числа соединений, каждое из которых способно к независимому существованию. Некоторые из этих соединений, например, Fe(CN)24KCN, AlF33KF, получили название «двойные соли». Другие вещества представлялись «соединениями присоединения», в которых соль металла сочетается с одной или несколькими нейтральными молекулами, например, молекулами аммиака. Так, ещё около 200 лет назад было установлено, что добавление водного раствора аммиака к зелёному раствору NiCl2 вызывает изменение окраски на фиолетовую; из образующегося раствора можно выделить фиолетовые кристаллы состава NiCl26NH3. Аналогичным образом можно получить соединение CuSO44NH3.
Большая заслуга в установлении природы этих соединений принадлежит швейцарскому химику Альфреду Вернеру, который создал координационную теорию, объясняющую многие свойства комплексных (или, как их ещё называют, координационных) соединений, за что и получил Нобелевскую премию по химии.
2.2 Основные положения координационной теории
К концу XIX века накопленные экспериментальные данные свидетельствовали о том, что можно получить пять соединений присоединения аммиака к хлориду платины (IV): 1) PtCl46NH3, 2) PtCl45NH3, 3) PtCl44NH3, 4) PtCl43NH3, 5) PtCl42NH3. Кроме того, было известно, что при добавлении избытка раствора нитрата серебра (реактив на хлорид-ионы) к раствору первого соединения, осаждается 4 моль хлорид-ионов из 1 моль PtCl4·6NH3. Из 1 моль второго соединения осаждается 3 моль ионов Cl– в виде осадка AgCl, из 1 моль третьего соединения осаждается 2 моль хлорид-ионов, из 1 моль четвёртого – только 1 моль хлорид-ионов, из пятого соединения хлорид-ионы не осаждаются вообще.
Вернер предположил, что в рассматриваемом случае катион четырёхвалентной платины Pt+4 может присоединять помимо хлорид-ионов ещё и молекулы аммиака, и счёл необходимым в дополнение к понятию «валентность» ввести ещё одну характеристику – координационное число. Координационное число определяет общее число молекул и отрицательно заряженных ионов, которые могут быть присоединены к данному катиону. Вернер также сделал предположение, что для иона Pt+4 координационное число равно 6. Таким образом, к катиону Pt+4 может быть присоединено 6 частиц, и строение рассматриваемых соединений можно представить следующим образом: 1) [Pt(NH3)6]Cl4, 2) [Pt(NH3)5Cl]Cl3,
3) [Pt(NH3)4Cl2]Cl2, 4) [Pt(NH3)3Cl3]Cl, 5) [Pt(NH3)2Cl4].
Согласно координационной теории в любом комплексном соединении существует ион (обычно положительно заряженный), вокруг которого в непосредственной близости расположены (т.е. координированы) противоположно заряженные ионы и (или) электронейтральные частицы – молекулы. Этот ион, вокруг которого координируются другие частицы, называется комплексообразователем, или центральным ионом (например, Pt+4). Если в роли комплексообразователя выступает нейтральный атом, то его называют центральным атомом.
Частицы – молекулы и ионы, – которые непосредственно присоединены к комплексообразователю, называются лигандами, например, Cl–, NH3. Комплексообразователь вместе с координированными вокруг него лигандами образует внутреннюю сферу комплексного соединения. Остальные ионы, не присоединённые непосредственно к комплексообразователю, т.е. не находящиеся во внутренней сфере, образуют внешнюю сферу. При записи формул комплексных соединений внутренняя сфера заключается в квадратные скобки, ионы внешней сферы записываются за квадратными скобками.
При растворении в воде комплексного соединения внутренняя сфера в значительной степени сохраняет стабильность, а ионы внешней сферы легко отщепляются и существуют в растворе как самостоятельные частицы. Именно этим объясняется тот факт, что при добавлении нитрата серебра к соединениям хлорида платины с аммиаком осаждается различное количество хлорид-ионов.
Лиганды могут соединяться с комплексообразователем посредством одной или нескольких химических связей. По этому признаку различают монодентатные лиганды, которые образуют одну химическую связь с комплексообразователем, бидентатные, образующие две химические связи с центральным ионом, и полидентатные, образующие более двух связей с комплексообразователем.
Примеры монодентатных лигандов: Cl–, F–, Br–, I–, CN–, OH–, NH3, H2O.
К числу бидентатных лигандов относится молекула этилендиамина H2N–CH2–CH2–NH2, которая присоединяется двумя крайними атомами азота к центральному иону.
П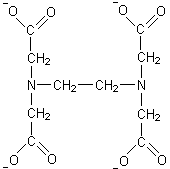 римером
полидентатных лигандов может служить
этилендиаминтетраацетат-ион (ЭДТА):
римером
полидентатных лигандов может служить
этилендиаминтетраацетат-ион (ЭДТА):
Комплексы с полидентатными лигандами называются хелатными. Многие хелатные комплексы широко распространены в природе и играют важную роль в биологических процессах, например, гемоглобин крови (комплексообразователь Fe2+), хлорофилл (комплексообразователь Mg2+).
Число монодентатных лигандов, координированных вокруг центрального иона, называется координационным числом.
Таблица 2.1 – Зависимость координационного числа центрального иона
от степени окисления
-
Степень окисления
центрального иона
+1
+2
+3
+4
Координационное число
2
4; 6
4; 6
6
Проанализировав координационные числа многих комплексообразователей, Вернер пришёл к выводу, что степень окисления центрального иона, является одним из важнейших факторов, влияющих на координационное число (таблица 2.1). Другим фактором, который может оказывать существенное влияние на координационное число комплексообразователя, является размер центрального иона.
Из-за большого разнообразия свойств комплексных соединений нет полного единства в определении понятия «комплексное соединение», и любое определение не является исчерпывающим и применимо лишь в определённых пределах. Одно из возможных определений: комплексными (координационными) соединениями называются соединения, в состав которых входят комплексные (т.е. сложные) ионы или электронейтральные частицы, способные к устойчивому существованию в растворах и состоящие из центрального атома или положительно заряженного иона, вокруг которого координированы лиганды – анионы и (или) молекулы.
