- •Общая и неорганическая химия
- •Часть 2 свойства элементов и их соединений
- •Содержание
- •2.1 Введение.………………………….…..……………….………….30
- •3.1 Введение…………………………………………………………...41
- •4.1 Введение …………………………………………………………..47
- •5.1 Введение…………….….…………….………….….….….………56
- •6.1 Введение.…..…………………….………………………….……..70
- •7.1 Введение…………………………………………………………..77
- •9.1 Введение.…...…..………………………………….…..…….……83
- •Периодическая система химических элементов. Строение атомов и молекул
- •1.1 Введение
- •1.2 Постулаты теории Бора
- •1.3 Квантовомеханическое описание состояния электрона в атоме
- •1.3.1 Элементарные представления о квантовой механике
- •1.3.2 Главное квантовое число
- •1.3.3 Орбитальное квантовое число
- •1.3.4 Магнитное квантовое число
- •1.3.5 Атомные орбитали
- •1.3.6 Спиновое квантовое число
- •1.3.7 Принцип Паули
- •1.4 Периодическая система химических элементов
- •1.4.1 Элементы первого периода (h, He)
- •1 .4.2 Элементы второго периода (Li – Ne)
- •1.4.3 Элементы III периода (Na – Ar)
- •1.4.4 Элементы IV периода (k – Kr)
- •1.4.5 Элементы V, VI и VII периодов
- •1.5 Химическая связь и строение молекул
- •1.5.1 Механизмы образования ковалентной связи
- •1.5.2 Направленность ковалентной связи
- •1.5.3 Гибридизация атомных орбиталей
- •1.5.4 Металлическая связь
- •Комплексные соединения
- •2.1 Введение
- •2.2 Основные положения координационной теории
- •2.3 Природа химической связи в комплексных соединениях
- •2.4 Классификация комплексов
- •2.4.2 Классификация по типу лигандов
- •2.5 Номенклатура комплексных соединений
- •2.6 Диссоциация комплексных соединений в растворах
- •2.7 Образование и разрушение комплексов
- •2.8 Геометрия комплексных ионов
- •2.9 Изомерия комплексных соединений
- •Галогены
- •3.1 Введение
- •3.2 Физические свойства галогенов
- •3.3 Химические свойства галогенов
- •3.4 Получение галогенов
- •3.5 Водородные соединения галогенов
- •3.6 Получение галогеноводородов
- •3.7 Кислородсодержащие соединения галогенов
- •3.8 Применение галогенов
- •4.1 Введение
- •4.2 Кислород
- •4.3 Сера
- •4.3.1 Свойства серы – простого вещества
- •4.3.2 Сероводород, сульфиды, полисульфиды
- •4.3.3 Диоксид серы. Сернистая кислота
- •4.3.4 Триоксид серы. Серная кислота
- •4.3.5 Олеум. Дисерная кислота
- •4.3.6 Мононадсерная и пероксодисерная кислоты
- •4.3.7 Тиосерная кислота и тиосульфаты
- •4.4 Селен. Теллур
- •4.5 Сравнение свойств водородных соединений p-элементов VI группы
- •5.1 Введение
- •5.2 Азот
- •5.2.1 Свойства азота – простого вещества
- •5.2.2 Аммиак и соли аммония. Гидразин. Гидроксиламин
- •5.2.3 Оксиды азота
- •5.2.4 Азотистая кислота и её соли
- •5.2.5 Азотная кислота и её соли
- •5.2.6 «Царская водка»
- •5.3 Фосфор
- •5.3.1 Свойства фосфора – простого вещества
- •5.3.4 Соединение фосфора с водородом
- •5.3.5 Галогениды фосфора
- •5.4 Мышьяк
- •5.5 Сурьма
- •5.6 Висмут
- •6.1 Введение
- •6.2 Углерод и его соединения
- •6.2.1 Свойства углерода – простого вещества
- •6.2.2 Оксид углерода (IV). Угольная кислота и её соли
- •6.2.3 Оксид углерода (II)
- •6.2.4 Карбиды
- •6.2.5 Соединения углерода с азотом
- •6.3 Кремний
- •6.4 Германий. Олово. Свинец
- •7.1 Введение
- •7.3 Алюминий
- •7.4 Индий. Галлий. Таллий
- •Обзор химических свойств соединений d-элементов
- •9.1 Введение
- •9.4 Хром
- •9.5 Марганец
- •9.6 Элементы триады железа
- •9.6.1 Железо
- •9.6.2 Кобальт
- •9.6.3 Никель
- •Литература
- •Часть 2. Свойства элементов и их соединений
1.5.2 Направленность ковалентной связи
Образование ковалентной связи, являющееся результатом перекрывания валентных электронных облаков взаимодействующих атомов, возможно только при определённой взаимной ориентации электронных облаков. При этом область перекрывания располагается в определённом направлении по отношению к взаимодействующим атомам. Иначе говоря, ковалентная связь обладает направленностью.
Представление
о направленности ковалентных связей
позволяет объяснить взаимное расположение
атомов в многоатомных молекулах. Так,
например, при образовании молекулы
воды электронные облака двух неспаренных
2p-электронов
атома кислорода перекрываются с
1s-электронными
облаками двух атомов водорода (рисунок
1.3 а). Поскольку p-электронные
облака атома кислорода расположены
перпендикулярно друг к другу, то молекула
H2O
имеет угловое строение, причём можно
было бы предположить, 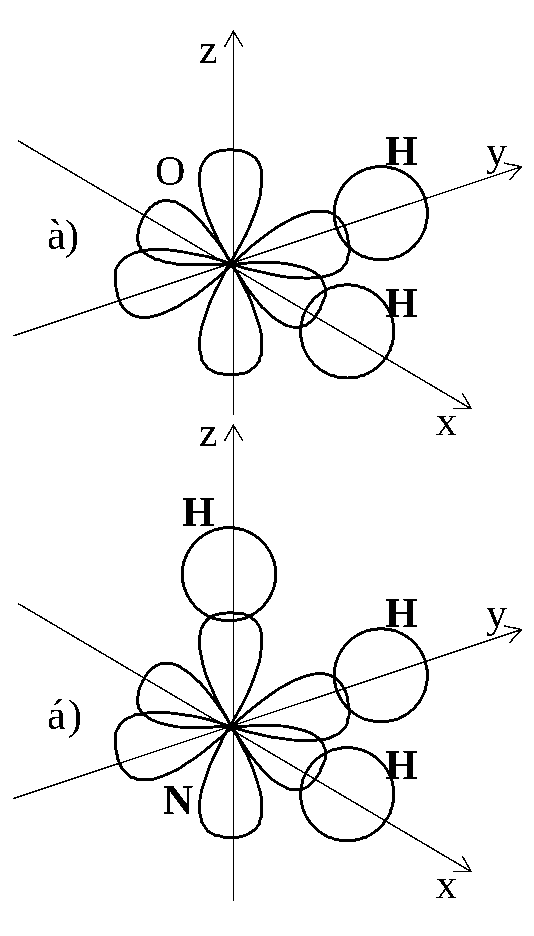 что
угол между связями O–H
должен составлять 90°.
что
угол между связями O–H
должен составлять 90°.
М
Рисунок 1.3 – Схема образования
ковалентных связей: а) в
молекуле воды; б) в
молекуле аммиака
Если область перекрывания электронных облаков находится на оси, соединяющей ядра взаимодействующих атомов (т.е. на оси связи), то такая ковалентная связь называется σ-связью (сигма-связь) (рисунок 1.4 а – в).
При взаимодействии p-электронных облаков, ориентированных перпендикулярно оси связи, образуется не одна, а две области перекрывания, расположенные по обе стороны от этой оси. Такая ковалентная связь называется π-связью (пи-связь) (рисунок 1.4 г).
Рисунок
1.4 –
Образование σ- и π-связей: а)
образование σ-связи при перекрывании
двух s-электронных
облаков; б)
образование σ-связи при перекрывании
s-
и p-электронных
облаков; в)
образование σ-связи при перекрывании
двух p-электронных
облаков; г)
образование π -связи при перекрывании
двух p-электронных
облаков
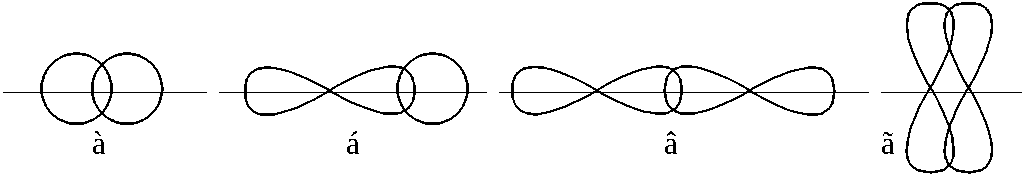
При образовании молекулы азота из атомов, три неспаренных p-электрона одного атома азота и три неспаренных p-электрона другого, образуют одну σ- и две π-связи (рисунок 1.5) .
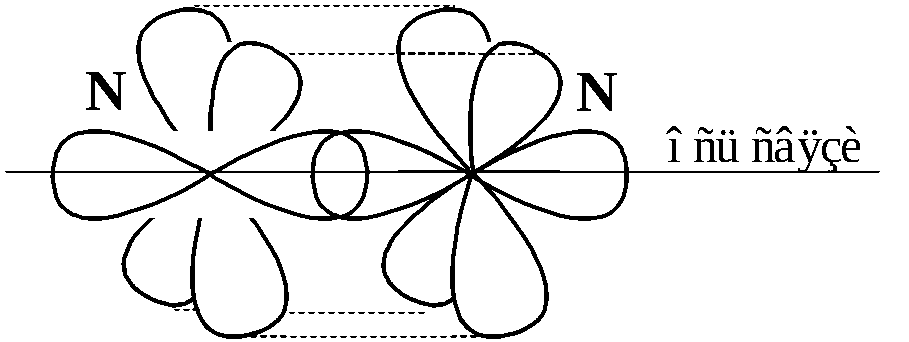
Рисунок
1.5 –
Взаимодействие p-электронных
облаков атомов азота при образовании
молекулы N2
1.5.3 Гибридизация атомных орбиталей
Для объяснения отличия валентных углов в молекулах воды и аммиака от 90° необходимо учесть, что устойчивому состоянию молекулы отвечает такая её геометрия и такое пространственное расположение электронных облаков внешних оболочек атомов, при которых потенциальная энергия соединения будет минимальной. Это приводит к тому, что при образовании соединения формы и взаимное расположение электронных облаков атомов изменяются по сравнению с их формами и взаимным расположением в свободных атомах. В результате достигается более полное перекрывание валентных электронных облаков и, вследствие этого, образование более прочных ковалентных связей. В рамках метода валентных связей такая перестройка электронной структуры атома рассматривается на основе представления о гибридизации атомных орбиталей.
Метод гибридизации атомных орбиталей исходит из предположения, что при образовании соединения вместо исходных атомных s-, p- и d-электронных облаков образуются такие равноценные «смешанные» (т.е. гибридные) электронные облака, которые вытянуты по направлению к соседним атомам, вследствие чего достигается более полное перекрывание с электронными облаками этих атомов. Такое изменение электронных облаков требует затраты энергии, однако более полное перекрывание электронных облаков взаимодействующих атомов приводит к образованию более прочных химических связей и, как следствие, к некоторому выигрышу в энергии. Если этот энергетический выигрыш достаточен, чтобы скомпенсировать затраты энергии на деформацию исходных электронных облаков атомов, то такая гибридизация приводит к уменьшению потенциальной энергии образующейся молекулы и повышению устойчивости молекулы. Далее концепция гибридизации атомных орбиталей рассматривается на конкретных примерах образования молекул BeF2 , BF3 , CH4 , SF6 .
Атом
бериллия в возбуждённом состоянии
имеет два неспаренных электрона,
занимающих 2s-
и 2p-орбитали.
При перекрывании этих орбиталей с
p-э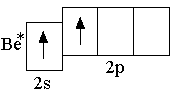 лектронными
облаками двух атомов фтора могли бы
образоваться две ковалентные связи.
Так как s-
и p-орбитали
отличаются по форме и энергии, то
образовавшиеся связи должны были бы
быть неравноценными. Опыт же показывает,
что в молекуле BeF2
обе связи равноценны. Этот факт можно
объяснить с позиций теории гибридизации
атомных орбиталей: вместо одной s-
и одной p-орбиталей
атома бериллия образуются две гибридные
sp-орбитали,
которые расположены под углом 180° друг
к другу (рисунок 1.6). Образование двух
sp-гибридных
орбиталей из одной s-
и одной p-орбиталей
называется sp-гибридизацией.
Перекрывание гибридных sp-электронных
облаков атома бериллия с p-электронными
облаками атомов фтора приводит к
образованию линейной молекулы BeF2
(рисунок 1.6).
лектронными
облаками двух атомов фтора могли бы
образоваться две ковалентные связи.
Так как s-
и p-орбитали
отличаются по форме и энергии, то
образовавшиеся связи должны были бы
быть неравноценными. Опыт же показывает,
что в молекуле BeF2
обе связи равноценны. Этот факт можно
объяснить с позиций теории гибридизации
атомных орбиталей: вместо одной s-
и одной p-орбиталей
атома бериллия образуются две гибридные
sp-орбитали,
которые расположены под углом 180° друг
к другу (рисунок 1.6). Образование двух
sp-гибридных
орбиталей из одной s-
и одной p-орбиталей
называется sp-гибридизацией.
Перекрывание гибридных sp-электронных
облаков атома бериллия с p-электронными
облаками атомов фтора приводит к
образованию линейной молекулы BeF2
(рисунок 1.6).
Рисунок 1.6 – sp-гибридизация
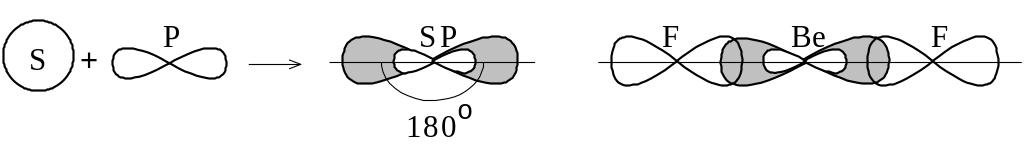
Таким образом, при sp-гибридизации электронных облаков центрального атома образующаяся молекула имеет линейную конфигурацию.
Возможны и другие случаи гибридизации атомных орбиталей, причём число образующихся гибридных орбиталей равно числу исходных атомных орбиталей, участвующих в гибридизации. Например, при гибридизации одной s- и двух p-орбиталей (sp2-гибридизация; читается: «эс-пэ-два») образуются три равноценные sp2-орбитали. В этом случае гибридные электронные облака располагаются под углом 120° друг к другу (рисунок 1.7).
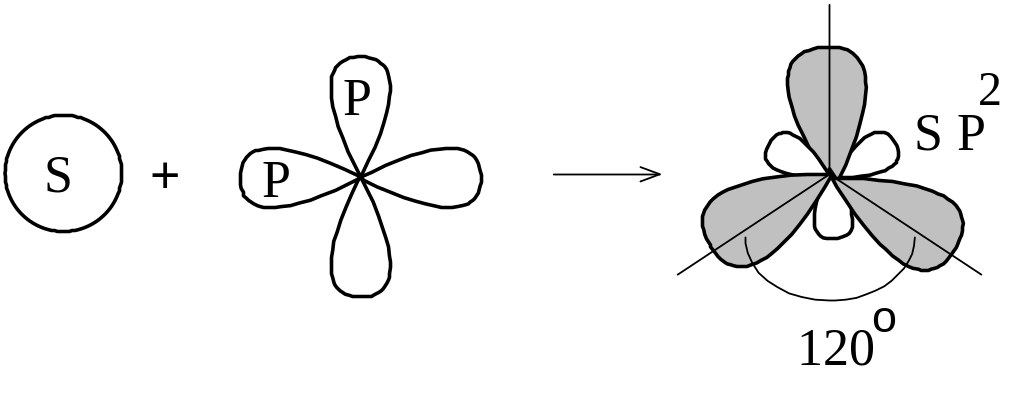
Рисунок
1.7 –
sp2-гибридизация
Этому
типу гибридизации соответствует
образование плоской треугольной
молекулы. Примером такой молекулы
является BF3.
И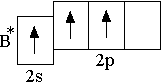 сходные
орбитали атома бора в возбуждённом
состоянии (одна s-
и две p-орбитали)
участвуют в гибридизации с образованием
трёх равноценных sp2-орбиталей.
Поэтому молекула BF3
построена в форме правильного
треугольника, в центре которого находится
атом бора, а в вершинах располагаются
атомы фтора.
сходные
орбитали атома бора в возбуждённом
состоянии (одна s-
и две p-орбитали)
участвуют в гибридизации с образованием
трёх равноценных sp2-орбиталей.
Поэтому молекула BF3
построена в форме правильного
треугольника, в центре которого находится
атом бора, а в вершинах располагаются
атомы фтора.
Если в гибридизации участвует одна s- и три p-орбитали (sp3-гибридизация; читается: «эс-пэ-три»), то в результате образуются четыре гибридные sp3-орбитали, вытянутые по направлению к вершинам тетраэдра, т.е. sp3-электронные облака ориентированы в пространстве под углом 109° 28´ по отношению друг к другу (рисунок 1.8).
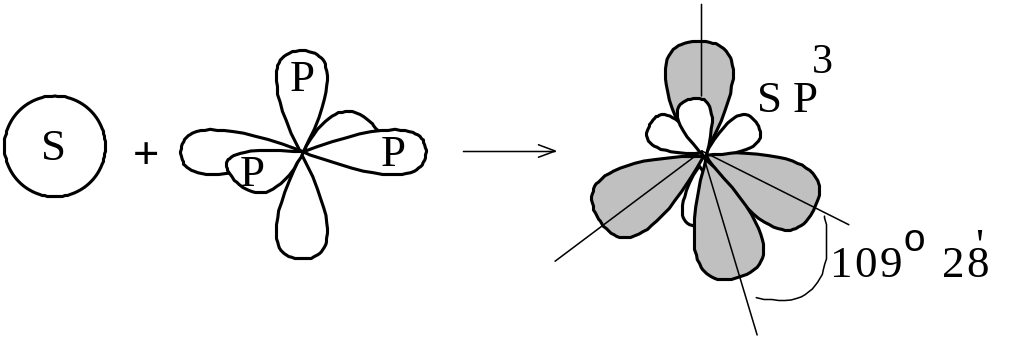
Рисунок
1.8 –
sp3-гибридизация
Этот
тип гибридизации осуществляется в
возбуждённом 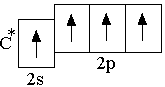 атоме
углерода при образовании молекулы CH4.
Поэтому молекула метана имеет форму
тетраэдра, причём все четыре связи
С–H
в этой молекуле равноценны.
атоме
углерода при образовании молекулы CH4.
Поэтому молекула метана имеет форму
тетраэдра, причём все четыре связи
С–H
в этой молекуле равноценны.
П
Рисунок
1.9 –
Схема образования химических связей: а)
в молекуле воды; б)
в молекуле аммиака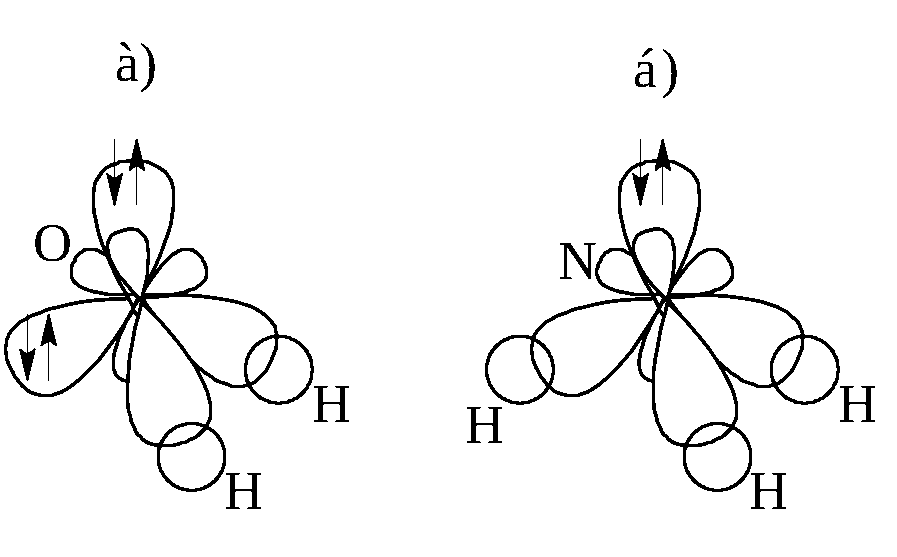 ри
образовании молекул воды и аммиака
также происходит sp3-гибридизация
электронных облаков атомов кислорода
и азота соответственно. Именно поэтому
валентные углы в молекулах воды и
аммиака равны не 90°, а близки к
тетраэдрическим (∠
HOH
= = 104,5°; ∠
HNH
= 107,3°). Некоторое отличие этих углов от
109°28´ объясняется следующим образом.
У атома кислорода из четырёх гибридных
орбиталей только две участвуют в
образовании химических связей с атомами
водорода, а две другие заняты неподелёнными
парами электронов (рисунок 1.9 а). В
молекуле аммиака из четырёх гибридных
sp3-орбиталей
атома азота только три участвуют в
образовании химических связей; одна
гибридная sp3-орбиталь
содержит неподелённую пару электронов
(рисунок 1.9 б). Такая асимметрия в
распределении электронных облаков
вокруг ядер атомов кислорода (в молекулах
воды) и азота (в молекулах аммиака)
приводит к наблюдаемым отклонениям
валентных углов от тетраэдрических,
характерных для случая sp3-гибридизации.
ри
образовании молекул воды и аммиака
также происходит sp3-гибридизация
электронных облаков атомов кислорода
и азота соответственно. Именно поэтому
валентные углы в молекулах воды и
аммиака равны не 90°, а близки к
тетраэдрическим (∠
HOH
= = 104,5°; ∠
HNH
= 107,3°). Некоторое отличие этих углов от
109°28´ объясняется следующим образом.
У атома кислорода из четырёх гибридных
орбиталей только две участвуют в
образовании химических связей с атомами
водорода, а две другие заняты неподелёнными
парами электронов (рисунок 1.9 а). В
молекуле аммиака из четырёх гибридных
sp3-орбиталей
атома азота только три участвуют в
образовании химических связей; одна
гибридная sp3-орбиталь
содержит неподелённую пару электронов
(рисунок 1.9 б). Такая асимметрия в
распределении электронных облаков
вокруг ядер атомов кислорода (в молекулах
воды) и азота (в молекулах аммиака)
приводит к наблюдаемым отклонениям
валентных углов от тетраэдрических,
характерных для случая sp3-гибридизации.
У элементов третьего и последующего периодов в образовании гибридных электронных облаков могут участвовать и d-орбитали. Например, при образовании молекулы SF6 происходит гибридизация одной s-, трёх p- и двух d-орбиталей возбуждённого атома серы (sp3d2-гибридизация).
При sp3d2-гибридизации образуются шесть равноценных гибридных орбиталей, вытянутых к вершинам октаэдра (рисунок 1.10). Именно sp3d2-гибридизацией объясняется октаэдрическая структура молекулы SF6 .
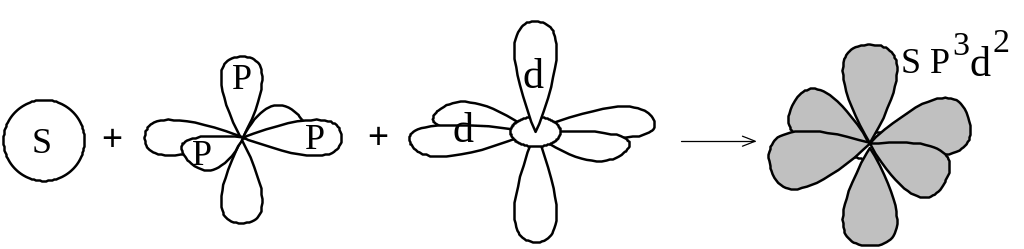
Рисунок
1.10 –
sp3d2-гибридизация
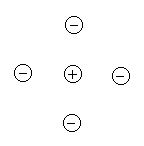
В отличие от ковалентной связи, ионная связь не обладает направленностью, поскольку взаимодействие между ионами осуществляется независимо от направления (рисунок 1.11).
Д
Рисунок
1.11 –
Ненаправленность и ненасыщаемость
ионной связи