
- •1. Основные понятия технической термодинамики
- •2. Параметры состояния рабочего тела, единицы измерения.
- •3. Внутренняя энергия и энтальпия.
- •4. Работа изменения объема рабочего тела.
- •5. Первый закон термодинамики.
- •6. Уравнение состояния идеальных газов
- •7. Основные законы идеальных газов.
- •8. Смеси идеальных газов
- •9. Теплоёмкость идеальных газов
- •Теплоемкости с и ср
- •10. Основные процессы изменения состояния идеальных газов.
- •Адиабатный процесс
- •11. Термодинамическая обратимость процессов
- •12. Оценка эффективности циклов.
- •13. Основные формулировки второго закона термодинамики
- •14. Цикл Карно
- •15.Энтропия и ее изменение энтропии в необратимых процессах
- •16. Физический смысл энтропии.
- •17. Аналитическое выражение второго закона термодинамики
- •18.Водяной пар. Основные понятия
- •19. Парообразование в – диаграмме
- •20.Влажный пар и его параметры
- •22.Влажный воздух. Основные определения
- •24.Термодинамический анализ работы компрессора, многоступенчатое сжатие в компрессорах.
- •25.Термодинамический цикл двс, цикл Отто.
- •26.Термодинамический цикл двс, цикл Дизеля.
- •27.Цикл воздушно холодильной установки.
- •28.Цикл парокомпрессионной холодильной установки.
- •29.Цикл теплового насоса.
- •30.Основные способы передачи тепловой энергии.
- •31.Основные положения теплопроводности. Температурное поле и градиент.
- •32.Тепловой поток. Плотность. Закон Фурье.
- •33.Дифиринциальное уравнение теплопроводности.
- •34.Условее однозначности для процессов теплопроводности.
- •35.Стационарная теплопроводность однослойной и многослойной плоской стенки при граничных условиях 1-го рода.
- •36. Стационарная теплопроводность однослойной и многослойной плоской стенки при граничных условиях 3-его рода.
- •37.Стационарная теплопроводность однослойной и многослойной трубы 1-ого рода.
- •39.Пути интенсификации теплопередачи.
- •41.Дифферинциальные уравнения конвективного теплообмена: уравнения теплоотдачи, энергии, движения, неразрывности.
- •43.Условия подобия физических процессов.
- •44.Теплоотдача плоской поверхностью.
- •46.Теплоотдача при движении жидкости в трубах.
- •47.Теплоотдача при поперечном омывании.
- •48.Теплоотдача при свободном движении жидкости.
- •49.Общее представление о процессе кипения. Кризисы кипения.
- •50.Теплоотдача при плёночной и капельной конденсации.
- •51. Тепловое излучение. Основные понятия и определения
- •52. Основные законы теплового излучения.
- •53. Теплообмен излучения между параллельными пластинами и при наличии экрана
- •54.Теплообмен излучением между телами произвольно расположенными в пространстве. Угловые коэффициенты и их свойства
- •55. Классификация теплообменников
- •56. Основные положения теплоотсчёта рекуперативных аппаратов
15.Энтропия и ее изменение энтропии в необратимых процессах
Для прямого цикла
Карно
![]() или
или
![]() .
.
Поскольку отводимая
теплота отрицательна, то
![]() или
или
![]() .
.
Отношение теплоты к температуре, при которой оно подводится или отводится, называется приведенным теплом. Таким образом, для обратимого цикла Карно алгебраическая сумма теплот равна нулю.
Полученное
соотношение можно распространить на
любой обратимый цикл. Для этого пересечем
произвольный обратимый цикл бесконечно
б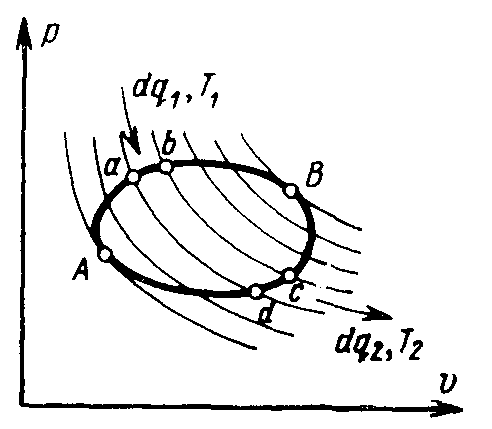 ольшим
количеством адиабат и образуем, таким
образом, бесконечно большое количество
элементарных циклов. В каждом из них
(например, в цикле a–b
– c
–d
–a)
теплота подводится на верхнем участке
в количестве dq1
при температуре Т1
и отводится на нижнем участке в количестве
dq2
при температуре Т2.
Изменение температур на этих элементарных
участках бесконечно мало, поэтому их
можно считать изотермическими, т.е.
каждый из полученный элементарных
циклов можно считать циклом Карно.
ольшим
количеством адиабат и образуем, таким
образом, бесконечно большое количество
элементарных циклов. В каждом из них
(например, в цикле a–b
– c
–d
–a)
теплота подводится на верхнем участке
в количестве dq1
при температуре Т1
и отводится на нижнем участке в количестве
dq2
при температуре Т2.
Изменение температур на этих элементарных
участках бесконечно мало, поэтому их
можно считать изотермическими, т.е.
каждый из полученный элементарных
циклов можно считать циклом Карно.
Для каждого из них по уже доказанному можно написать, что
![]() .
(5.7)
.
(5.7)
Общее количество подведенной и отведенной можно представить в виде суммы:
![]() или
или
![]() ,
,
Из математики известно, что если линейный интеграл, взятый по любому замкнутому контуру, равен нулю, то под интегралом находится полный дифференциал, т.е. в данном случае
![]() ,
,
г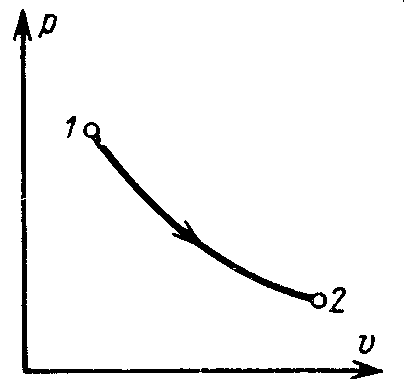 де
s
– некоторая функция состояния, значение
которой однозначно определяется
состоянием тела и изменение которой
зависит от начального и конечного
состояний тела, но не от пути, по которому
тело переходит от начального состояния
к конечному. Следовательно, если тело
переходит из состояния 1 в состояние 2
(рис. 5.8), то по какому бы пути не был
осуществлен переход, величина
де
s
– некоторая функция состояния, значение
которой однозначно определяется
состоянием тела и изменение которой
зависит от начального и конечного
состояний тела, но не от пути, по которому
тело переходит от начального состояния
к конечному. Следовательно, если тело
переходит из состояния 1 в состояние 2
(рис. 5.8), то по какому бы пути не был
осуществлен переход, величина
Рисунок 5.8![]()
будет иметь одно и то же значение. Функция состояния S была названа Клаузиусом энтропией.
Важная роль этой величины в термодинамике определяется тем, что в соответствии с равенством (5.9) изменение ее в любом обратимом процессе является признаком наличия теплообмена между рабочим телом и окружающей средой.
Энтропию можно рассматривать как параметр состояния и, следовательно, изменение ее можно вычислить для любого процесса, если известно изменение двух других параметров состояния.
Для идеального газа значение энтропии S = 0, при нормальных условиях.
Всякая необратимость процесса связана с потерей работы. Например, на трение, поэтому термический к.п.д. необратимого процесса всегда меньше обратимого:
![]() или
или
![]() ,
,
откуда получаем
![]() .
.
Учитывая, что теплота dq1 положительна, а теплота dq2 отрицательна, имеем
![]()
и следовательно,
![]() .
.
Таким образом, в любом необратимом цикле интегральная сумма приведенных теплот, взятая по всему контуру цикла, отрицательна.
Сопоставляя формулы (5.8) и (5.28), получаем обобщенное выражение для интеграла Клаузиуса
![]()
 ,
(5.29)
,
(5.29)
в котором знак равенства относится к обратимым циклам, а знак неравенства – к необратимым циклам.
Рисунок 5.19
![]() .
.
В соответствии с формулой (5.10) для обратимого процесса 2-1
![]() .
.
следовательно,
![]() ,
т.е.
,
т.е.
![]() ,
,
а в дифференциальной форме
![]() .
.
Применительно к адиабатным необратимым процессам, для которых dq = 0, полученное равенство означает, что
![]() ,
,
или в конечной
форме![]() ,
,
т.е. необратимые адиабатные процессы сопровождаются увеличением энтропии рабочего тела, хотя теплота не подводится.
