
- •1. Основные понятия технической термодинамики
- •2. Параметры состояния рабочего тела, единицы измерения.
- •3. Внутренняя энергия и энтальпия.
- •4. Работа изменения объема рабочего тела.
- •5. Первый закон термодинамики.
- •6. Уравнение состояния идеальных газов
- •7. Основные законы идеальных газов.
- •8. Смеси идеальных газов
- •9. Теплоёмкость идеальных газов
- •Теплоемкости с и ср
- •10. Основные процессы изменения состояния идеальных газов.
- •Адиабатный процесс
- •11. Термодинамическая обратимость процессов
- •12. Оценка эффективности циклов.
- •13. Основные формулировки второго закона термодинамики
- •14. Цикл Карно
- •15.Энтропия и ее изменение энтропии в необратимых процессах
- •16. Физический смысл энтропии.
- •17. Аналитическое выражение второго закона термодинамики
- •18.Водяной пар. Основные понятия
- •19. Парообразование в – диаграмме
- •20.Влажный пар и его параметры
- •22.Влажный воздух. Основные определения
- •24.Термодинамический анализ работы компрессора, многоступенчатое сжатие в компрессорах.
- •25.Термодинамический цикл двс, цикл Отто.
- •26.Термодинамический цикл двс, цикл Дизеля.
- •27.Цикл воздушно холодильной установки.
- •28.Цикл парокомпрессионной холодильной установки.
- •29.Цикл теплового насоса.
- •30.Основные способы передачи тепловой энергии.
- •31.Основные положения теплопроводности. Температурное поле и градиент.
- •32.Тепловой поток. Плотность. Закон Фурье.
- •33.Дифиринциальное уравнение теплопроводности.
- •34.Условее однозначности для процессов теплопроводности.
- •35.Стационарная теплопроводность однослойной и многослойной плоской стенки при граничных условиях 1-го рода.
- •36. Стационарная теплопроводность однослойной и многослойной плоской стенки при граничных условиях 3-его рода.
- •37.Стационарная теплопроводность однослойной и многослойной трубы 1-ого рода.
- •39.Пути интенсификации теплопередачи.
- •41.Дифферинциальные уравнения конвективного теплообмена: уравнения теплоотдачи, энергии, движения, неразрывности.
- •43.Условия подобия физических процессов.
- •44.Теплоотдача плоской поверхностью.
- •46.Теплоотдача при движении жидкости в трубах.
- •47.Теплоотдача при поперечном омывании.
- •48.Теплоотдача при свободном движении жидкости.
- •49.Общее представление о процессе кипения. Кризисы кипения.
- •50.Теплоотдача при плёночной и капельной конденсации.
- •51. Тепловое излучение. Основные понятия и определения
- •52. Основные законы теплового излучения.
- •53. Теплообмен излучения между параллельными пластинами и при наличии экрана
- •54.Теплообмен излучением между телами произвольно расположенными в пространстве. Угловые коэффициенты и их свойства
- •55. Классификация теплообменников
- •56. Основные положения теплоотсчёта рекуперативных аппаратов
Теплоемкости с и ср
В технической термодинамике особо важную роль играют теплоемкости при постоянном объеме
![]()
и теплоемкости при постоянном давлении
Между ними существует связь уравнение Майера:
![]() .
.
Из этого видно
![]() т.к.
I
закон термодинамики: для изохорного
процесса вся теплота идёт на повышение
температуры, для изобарного часть тепла
на совершения работы.
т.к.
I
закон термодинамики: для изохорного
процесса вся теплота идёт на повышение
температуры, для изобарного часть тепла
на совершения работы.
10. Основные процессы изменения состояния идеальных газов.
Изохорный процесс
И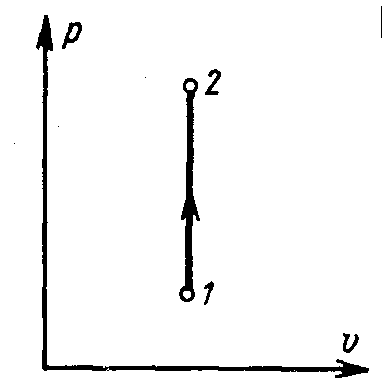 зохорным
называется равновесный процесс,
протекающий при постоянном объеме. В
зохорным
называется равновесный процесс,
протекающий при постоянном объеме. В
![]() диаграмме изохора представляет собой
отрезок вертикальной прямой 1–2,
соединяющий точки начального и конечного
состояния газа.
диаграмме изохора представляет собой
отрезок вертикальной прямой 1–2,
соединяющий точки начального и конечного
состояния газа.
закон Шарля:
,
Аналитическое выражение первого закона термодинамики
для изохорного
процесса, в котором
![]() ,
принимает вид:
,
принимает вид:
![]() .
.
Таким образом, в изохорном процессе все подводимое тепло расходуется на изменение внутренней энергии газа, а работа расширения равна нулю.
В теплотехнических расчетах следует учитывать зависимость теплоемкости газов от температуры, поэтому тепло изохорного процесса нужно определять по формуле:
![]() ,
,
в которой значения теплоемкостей берутся из таблиц.
Изобарный процесс Р=const
С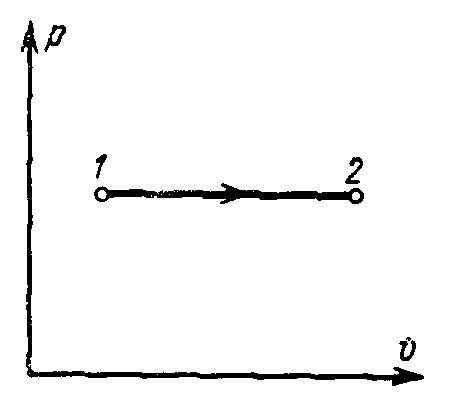 вязь
между термическими параметрами начального
и конечного состояний выражается законом
Гей – Люссака
вязь
между термическими параметрами начального
и конечного состояний выражается законом
Гей – Люссака
![]() ,
,
откуда видно, что изобара нагревания направлена слева направо, а изобара охлаждения – справа налево.
Аналитическое выражения первого закона термодинамики для изобарного процесса принимает вид
 Согласно
определению теплоемкости
Согласно
определению теплоемкости
![]() и
и
![]() ,
,
поэтому
![]() и
и
![]() .
.
Энтальпия является функцией состояния, и ее изменение не зависит от характера процесса, поэтому приведенные формулы справедливы для любого процесса.
В теплотехнических расчетах приходится учитывать зависимость теплоемкости от температуры, поэтому тепло изобарного процесса следует определять по формуле
![]() ,
,
в которой значения теплоемкостей берутся из таблиц.
Величина работы изменения объема газа в изобарном процессе
![]() ,
,
![]() .
.
Последнее уравнение позволяет выявить физический смысл постоянной R: это работа расширения 1 кг идеального газа при изобарном нагревании его на один градус.
Изотермический процесс T=const
 Поскольку
в изотермическом процессе
Поскольку
в изотермическом процессе
![]() ,
,
т.е. внутренняя энергия не изменяется, аналитическое выражение первого закона термодинамики принимает вид
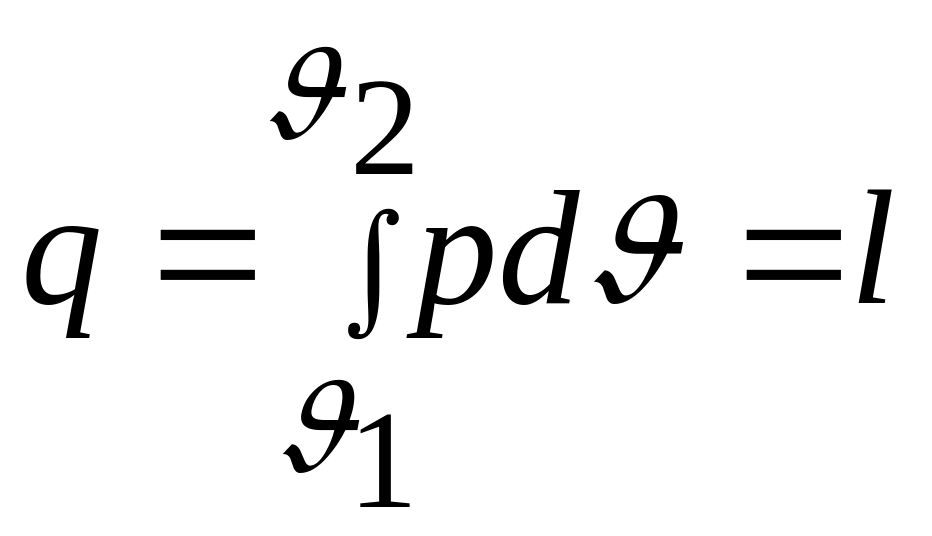 ,
,
т.е. все тепло, затрачиваемое на процесс, расходуется на совершение работы изменения объема газа. Для идеального газа
![]() ,
,
следовательно,
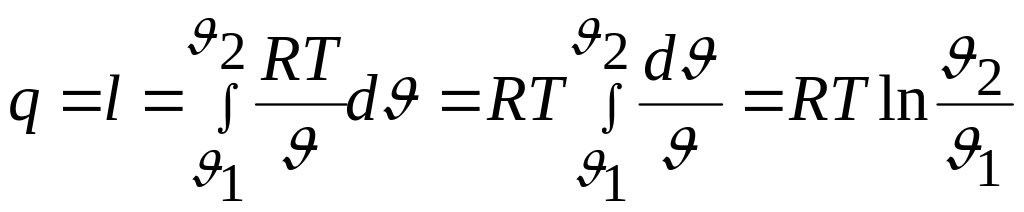 .
.
Полученное
выражение показывает, что если
![]() ,
то q
> 0 и l
> 0. Это означает, что при подводе тепла
газ расширяется, изотерма направлена
слева направо и работа его положительна.
Если же
,
то q
> 0 и l
> 0. Это означает, что при подводе тепла
газ расширяется, изотерма направлена
слева направо и работа его положительна.
Если же
![]() ,
то q
< 0 и l
< 0, т.е. при отводе теплоты газ сжимается,
изотерма направлена справа налево и
работа отрицательна.
,
то q
< 0 и l
< 0, т.е. при отводе теплоты газ сжимается,
изотерма направлена справа налево и
работа отрицательна.
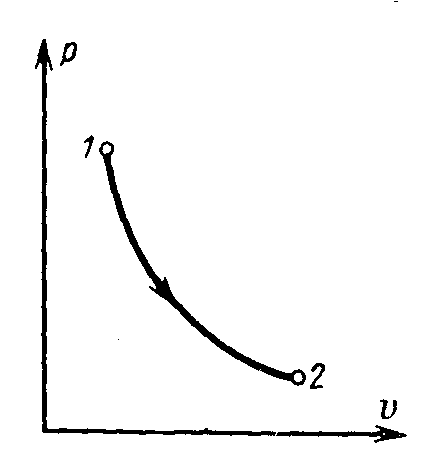
Адиабатный процесс
Адиабатным называется равновесный процесс, протекающий без теплообмена между рабочим телом и окружающей средой. Уравнение адиабаты в диаграмме может быть получено из аналитических выражений первого закона термодинамики, которые в данном случае принимают вид
![]()
и
![]() .
.
Из этих уравнений имеем
![]() и
и
![]() .
.
Разделив второе равенство на первое, получаем
![]() .
.
Это отношение представляет собой важную характеристику адиабатного процесса, обозначаемую буквой k. Таким образом,
![]()
или
![]() .
.
Интегрируя это дифференциальное уравнение, получаем
![]()
П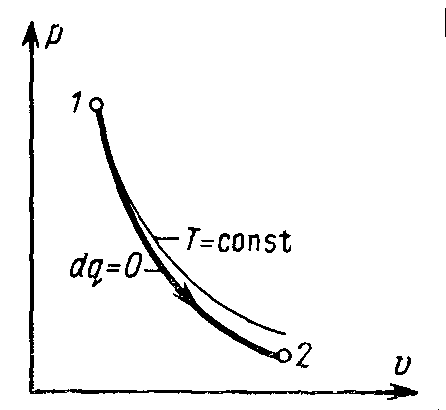 олученное
соотношение называется уравнением
Пуассона
и выражает аналитическую связь между
параметрами р
и
в адиабатном процессе, а потому
представляет собой уравнение адиабаты
в
олученное
соотношение называется уравнением
Пуассона
и выражает аналитическую связь между
параметрами р
и
в адиабатном процессе, а потому
представляет собой уравнение адиабаты
в
![]() диаграмме. Входящая в него величина k
называется
показателем
адиабаты.
Графически адиабата изображается линией
1–2, схожей с гиперболой, но расположенной
несколько круче.
диаграмме. Входящая в него величина k
называется
показателем
адиабаты.
Графически адиабата изображается линией
1–2, схожей с гиперболой, но расположенной
несколько круче.
В адиабатном
процессе все три термических параметра
(![]() )
переменны, поэтому связь между их
значениями для начального конечного
состояния газа выражается тремя
уравнениями.
)
переменны, поэтому связь между их
значениями для начального конечного
состояния газа выражается тремя
уравнениями.
а) Связь между параметрами р и . Из уравнения адиабаты имеем:
![]()
![]()
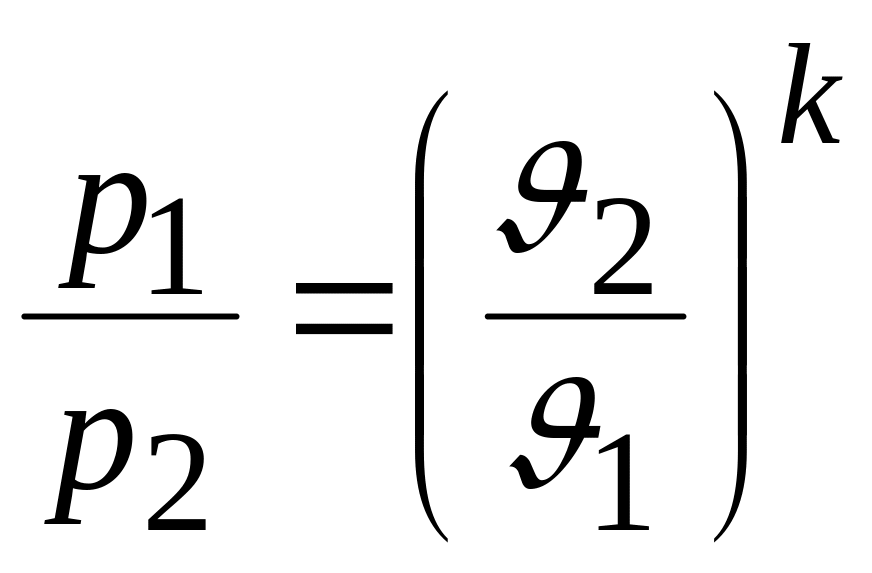 .
.
б) Связь между параметрами Т и :
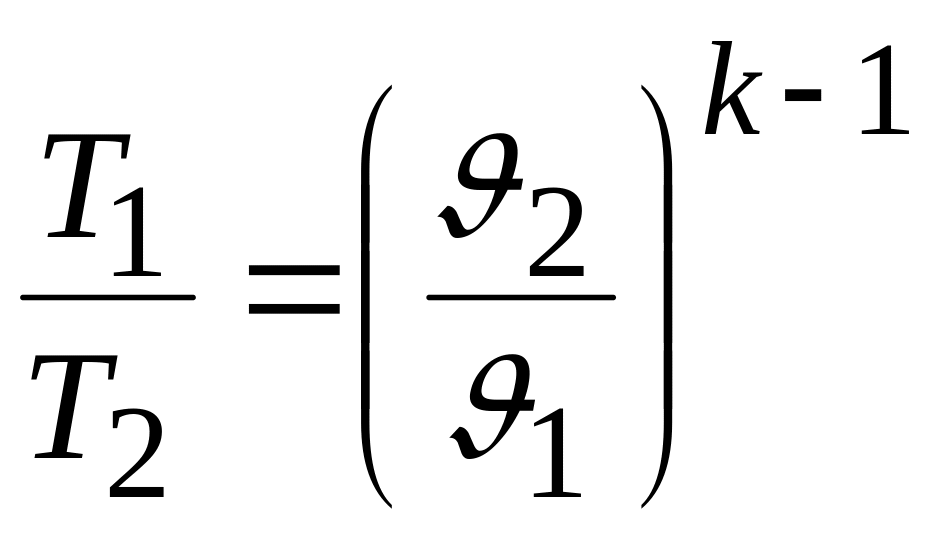
в) Связь между параметрами р и Т:
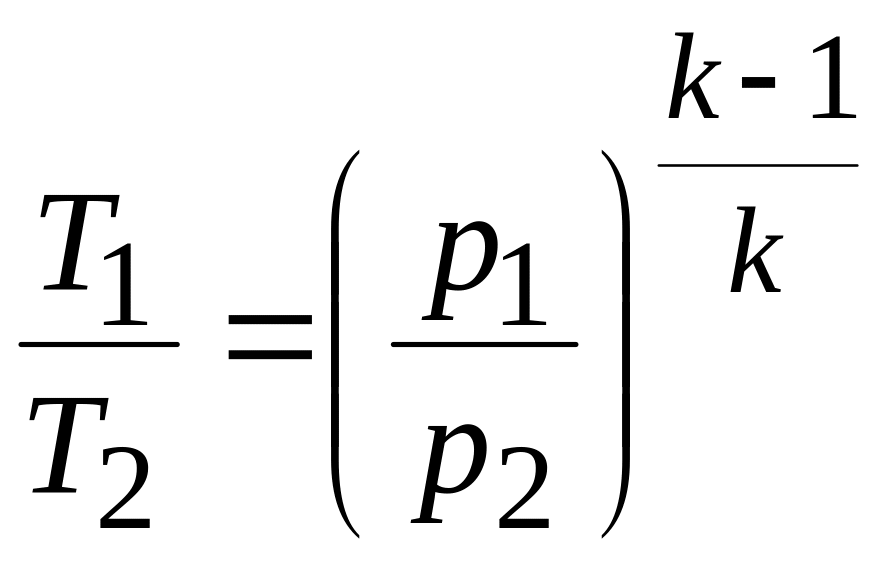 .
.
Аналитическое выражение первого закона термодинамики для адиабатного процесса примет вид
![]() .
.
Это означает, что работа изменения объема в адиабатном процессе совершается за счет изменения внутренней энергии. Если газ расширяется и работа положительна, то внутренняя энергия уменьшается; если происходит сжатие и работа газа отрицательна, то внутренняя энергия увеличивается. Поэтому адиабатное расширение сопровождается уменьшением температуры газа, а адиабатное сжатие – ее увеличением.
Работа адиабатного процесса может быть найдена по формуле
![]() .
.
Далее можно получить:
![]() .
.
